炭素-炭素結合
炭素–炭素結合は、2 つの炭素原子間の共有結合です。[ 1 ]最も一般的な形式は単結合、つまり 2 つの原子からそれぞれ 1 つずつ、合計 2 つの電子で構成される結合です。炭素–炭素単結合はシグマ結合であり、各炭素原子からの 1 つの混成軌道間で形成されます。エタンでは、軌道は sp 3混成軌道ですが、他の混成の炭素原子間で形成される単結合も発生します (例: sp 2から sp 2 )。実際、単結合の炭素原子は同じ混成である必要はありません。炭素原子は、アルケンと呼ばれる化合物で二重結合を、アルキンと呼ばれる化合物で三重結合を形成することもできます。二重結合は、 sp 2混成軌道と混成に関与しない p 軌道で形成されます。三重結合は、 sp 混成軌道と各原子からの 2 つの p 軌道で形成されます。 p軌道を利用することでπ結合が形成される。[ 2 ]
チェーンと分岐
炭素は、自身の原子が長い鎖を形成できる数少ない元素の一つであり、この性質は連鎖と呼ばれます。この性質と炭素-炭素結合の強さが相まって、膨大な数の分子形態が生み出されます。その多くは生命の重要な構成要素であるため、炭素化合物は有機化学という独自の研究分野を有しています。

C−C骨格では分岐もよく見られます。分子中の炭素原子は、隣接する炭素原子の数によって分類されます。
- 一次炭素原子には 1 つの炭素原子が隣接しています。
- 二次炭素原子には 2 つの炭素原子が隣接しています。
- 第三級炭素原子には 3 つの炭素原子が隣接しています。
- 第四級炭素原子には 4 つの炭素原子が隣接しています。
「構造的に複雑な有機分子」では、四級アミノ酸座における炭素-炭素結合の三次元的な配向が分子の形状を決定します。[ 3 ]さらに、四級アミノ酸座は、コルチゾンやモルヒネ などの多くの生物学的に活性な小分子に見られます。[ 3 ]
合成
炭素-炭素結合形成反応は、新たな炭素-炭素結合が形成される有機反応です。医薬品やプラスチックなど、多くの人工化学物質の製造において重要な役割を果たしています。炭素-炭素結合が切断される逆反応は、炭素-炭素結合活性化と呼ばれます。
炭素-炭素結合を形成する反応の例としては、アルドール反応、ディールス・アルダー反応、グリニャール反応、クロスカップリング反応、ミカエル反応、ウィッティヒ反応などがあります。
第三級炭素の望ましい三次元構造の誘導合成は20世紀後半に大部分が解決されましたが、第四級炭素の誘導合成に対する同様の能力は21世紀の最初の10年まで現れ始めませんでした。[ 3 ]
結合強度と長さ
炭素-炭素単結合は、 C-H、O-H、N-H、H-H、H-Cl、C-F、および多くの二重結合や三重結合よりも弱く、強度はC-O、Si-O、P-O、およびS-H結合に匹敵しますが、[ 4 ]一般的に強いと考えられています。
| C–C結合 | 分子 | 結合解離エネルギー(kcal/mol) |
|---|---|---|
| CH 3 −CH 3 | エタン | 90 |
| C 6 H 5 −CH 3 | トルエン | 102 |
| C 6 H 5 −C 6 H 5 | ビフェニル | 114 |
| CH 3 C(O)−CH 3 | アセトン | 84 |
| CH 3 −CN | アセトニトリル | 136 |
| CH 3 −CH 2 OH | エタノール | 88 |
上記の値は、一般的に見られる C–C 結合解離エネルギーを表しています。場合によっては、外れ値がこの範囲から大幅に逸脱することもあります。
| 分子 | エタン | エチレン | アセチレン |
|---|---|---|---|
| 式 | C2H6 | C 2 H 4 | C 2 H 2 |
| クラス | アルカン | アルケン | アルキン |
| 構造 |  | 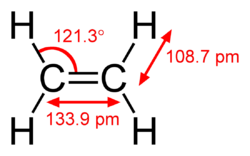 | 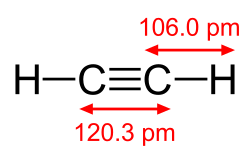 |
| 炭素の混成 | sp 3 | sp 2 | sp |
| C–C結合長 | 午後15時35分 | 午後1時33分9秒 | 午後12時30分 |
| C–C単結合の割合 | 100% | 87% | 78% |
| 構造決定法 | マイクロ波分光法 | マイクロ波分光法 | 赤外分光法 |
極端なケース
長く弱いC–C単結合
C–C結合が伸長する様々な極端な例が確認されている。ゴンバーグ二量体では、1つのC–C結合が159.7ピコメートルとかなり長い。この結合は、溶液中で室温において可逆的にかつ容易に切断される。[ 6 ]
さらに複雑な分子であるヘキサキス(3,5-ジ-tert-ブチルフェニル)エタンでは、安定化トリアリールメチルラジカルを形成するための結合解離エネルギーはわずか8 kcal/molです。また、その立体的混雑の結果として、ヘキサキス(3,5-ジ-tert-ブチルフェニル)エタンは、長さ167 pmの非常に長い中心結合を有しています。[ 7 ]
ねじれた弱いC-C二重結合
テトラキス(ジメチルアミノ)エチレン(TDAE)の構造は大きく歪んでいる。C =C 距離は通常の 135 pm であるにもかかわらず、両端の N 2 Cの二面角は 28 度である。ほぼ等構造のテトライソプロピルエチレンも C=C 距離は 135 pm であるが、C 6コアは平面構造である。[ 8 ]
短くて強いC-C三重結合
反対に、ジアセチレンの中心の炭素−炭素単結合は、sp混成の2つの炭素を結合するため、160 kcal/molと非常に強い。[ 9 ]炭素−炭素多重結合は一般にもっと強く、エチレンの二重結合とアセチレンの三重結合の結合解離エネルギーはそれぞれ174 kcal/molと230 kcal/molと測定されている。[ 10 ]ヨードニウム種[HC≡C–I + Ph] [CF 3 SO 3 – ]では、強い電子吸引性のヨードニウム部分のために、 115 pmの非常に短い三重結合が観測されている。[ 11 ]
参照
参考文献
- ^デンビッキ、ハリー (2016年10月6日).石油探査・生産のための実践的石油地球化学. エルゼビア. p. 7. ISBN 9780128033517。
- ^スミス、マイケル・B.;マーチ、ジェリー(2007年)、上級有機化学:反応、メカニズム、構造(第6版)、ニューヨーク:ワイリー・インターサイエンス、ISBN 978-0-471-72091-1
- ^ a b c Quasdorf, Kyle W.; Overman, Larry E. (2014). 「レビュー:第四級炭素立体中心の触媒的エナンチオ選択的合成」 . Nature (論文). 516 (7530): 181– 191. Bibcode : 2014Natur.516..181Q . doi : 10.1038/nature14007 . PMC 4697831. PMID 25503231 .

- ^ Yu-Ran Luo と Jin-Pei Cheng「結合解離エネルギー」、CRC 化学物理ハンドブック、第 96 版。
- ^ CRC化学物理ハンドブック、第88版
- ^ Bochkarev, LN; Molosnova, NE; Zakharov, LN; Fukin, GK; Yanovsky, AI; Struchkov, YT (1995). 「1-ジフェニルメチレン-4-(トリフェニルメチル)シクロヘキサ-2,5-ジエンベンゼン溶媒和物」. Acta Crystallographica Section C Crystal Structure Communications . 51 (3): 489– 491. doi : 10.1107/S0108270194009005 .
- ^ Rösel, Sören; Balestrieri, Ciro; Schreiner, Peter R. (2017). 「オールメタtert-ブチルヘキサフェニルエタンの解離におけるロンドン分散の役割の評価」 . Chemical Science . 8 (1): 405– 410. doi : 10.1039/c6sc02727j . ISSN 2041-6520 . PMC 5365070. PMID 28451185 .
- ^ Bock, Hans; Borrmann, Horst; Havlas, Zdenek; Oberhammer, Heinz; Ruppert, Klaus; Simon, Arndt (1991). 「テトラキス(ジメチルアミノ)エテン:結晶中および気相中における特異な構造を有する極めて電子豊富な分子」. Angewandte Chemie International Edition in English . 30 (12): 1678– 1681. doi : 10.1002/anie.199116781 .
- ^ 「NISTウェブブック」。
- ^ Blanksby, Stephen J.; Ellison, G. Barney (2003年4月). 「有機分子の結合解離エネルギー」. Accounts of Chemical Research . 36 (4): 255– 263. CiteSeerX 10.1.1.616.3043 . doi : 10.1021/ar020230d . ISSN 0001-4842 . PMID 12693923 .
- ^ Streitwieser, Andrew; Heathcock, Clayton H.; Kosower, Edward M. (1992). Introduction to Organic chemistry (4th ed.). Upper Saddle River, NJ: Prentice Hall. p. 574. ISBN 978-0139738500. OCLC 52836313 .

