| デスエフェクタードメイン | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 FADD(Mort1)デスエフェクタードメインの構造。[1] | |||||||||||
| 識別子 | |||||||||||
| シンボル | 死亡 | ||||||||||
| ファム | PF01335 | ||||||||||
| インタープロ | IPR001875 | ||||||||||
| 頭いい | 死亡 | ||||||||||
| プロサイト | PS50168 | ||||||||||
| SCOP2 | 1a1z / スコープ / SUPFAM | ||||||||||
| CDD | cd00045 | ||||||||||
| |||||||||||
デスエフェクタードメイン(DED)は、真核生物にのみ見られるタンパク質相互作用ドメインであり、さまざまな細胞シグナル伝達経路を制御します。[2] DEDドメインは、不活性プロカスパーゼ(システインプロテアーゼ)およびFAS関連デスドメイン含有タンパク質(FADD )などのアポトーシスカスケードでカスパーゼ活性化を制御するタンパク質に見られます。FADDは、プロカスパーゼ8およびプロカスパーゼ10を細胞死誘導シグナル伝達複合体(DISC)にリクルートします。このリクルートは、プロカスパーゼDEDと、活性化TNF受容体に直接関連するアダプタータンパク質内のデスエフェクタードメインである2番目のDEDとの間の同型相互作用によって媒介されます。複合体の形成により、プロカスパーゼがタンパク質分解によって活性化され、活性カスパーゼ形態になり、アポトーシス(細胞死)が開始されます。構造的には、DED ドメインはデスフォールドとして知られるタンパク質モチーフのサブクラスであり、デスドメイン(DD)の構造によく似た 6 つのアルファヘリックスを含みます。
構造

DEDはDDスーパーファミリーのサブファミリーです(このスーパーファミリーには、他にカスパーゼリクルートメントドメイン(CARD)、ピリンドメイン(PYD)、デスドメイン(DD)が存在します)。これらのサブファミリーは構造的に互いに類似しており、すべて(特にDED)は6本のαヘリックスの束で構成されていますが、表面の特徴は異なります。
このタンパク質ドメインの完全な一次構造は、まだ統一的に定義されていません。いくつかの研究では残基2~184が報告されていますが、C末端およびN末端の残基は未だ特定されていません。DEDへの溶解性と凝集性を決定するアミノ酸の存在により、カスパーゼ8やMC159といった様々なタンパク質におけるDEDの同定が可能になりました。このドメインの二次 構造は、前述の通り、6本のαヘリックスで構成されています。
このドメインの三次構造は、ヒトのカスパーゼ8の結晶化によって記述されている。構造記述にはX線回折法が用いられ、得られた分解能は2.2Åである。[3]このタンパク質のDEDは非対称なユニットダイマーを示し、その界面には2つの水素結合ネットワークが含まれ、フィラメント構造として現れる。DEDの機能はその構造によって決定される。知られている限りでは、カスパーゼを活性化しアポトーシスを誘発する同型相互作用は、パートナー間の非対称な表面接触(カスパーゼ8の場合のDED1とDED2など)によって媒介される。[4]表面を形成する残基は通常は荷電アミノ酸であるが、ドメインの相互作用表面には短い疎水性パッチも観察される。
関数
DEDドメインはアポトーシスにおける役割で最もよく知られています。しかし、DEDを含むタンパク質は他の細胞プロセスにも関与しており、細胞の生死の決定を制御しています。
外因性アポトーシス
[5]アポトーシスは、生物のライフサイクルにおいて様々な利点をもたらす、制御されたプログラム細胞死です。外因性経路は、死の刺激に反応して活性化するプロテアーゼファミリーによって制御されます。この過程におけるDEDの役割を理解することは、多タンパク質死シグナル伝達複合体(DISC)の形成を観察する上で重要です。
DR4、TRAIL-R2、およびCD95は、細胞内デスドメイン(DD)を介して相互作用するデスレセプター(TNF受容体スーパーファミリーのメンバー)です。DEDを含むタンパク質であるFADDのDDは、これらのDDと相互作用することができます。ここで、FADD DEDの機能は、FADDが自己会合することで安定化構造を形成することです。

[6]これらの相互作用は、α1/α4およびα2/α3ヘリックスによって定義されます。α1/α4の残基Ser1、Val6、His9、Leu43、Asp44、Glu51は、2番目の分子のα2/α3のThr21、Phe25、Lys33、Arg34、Glu37、Glu51と接触しています。各相互作用は1062Å2の面積を伴い、疎水性側鎖、水素結合、塩橋が寄与しています。最終的なホモ二量体は、各サブユニットが2つの相互作用部位を持つように配向された構造となります。
プロカスパーゼ8もDED含有タンパク質であり、FADD DEDに親和性があります。そのため、プロカスパーゼ8はDEDを介してモノマーとしてFADDにリクルートされます。これらの相互作用は、プロカスパーゼ8 DED-Aのα1/α4とFADD DEDのα2/α3またはα1/α4、およびプロカスパーゼ8 DED-Bのα2/α5によって定義されます。プロカスパーゼ8 DED-BはFADDと相互作用し、DED-Aはカパーゼ8鎖形成を仲介します(またはその逆)。ただし、どちらの場合も、相互作用によりプロカスパーゼ間に二量体が形成され、構造変化が生じます。この二量体化は活性部位の形成に不可欠であり、p12サブユニットが遊離し、その後、小さなp10サブユニットに処理されます。2つのプロカスパーゼ8分子はこれらのp10サブユニットと会合し、活性なプロテアーゼ8細胞死を引き起こします。[7] [8]
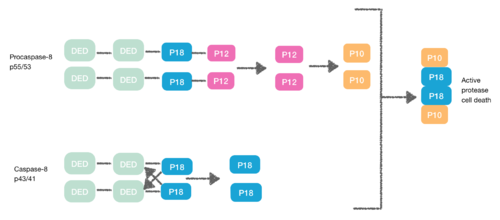
ネクロプトーシス
[9] DISCの生成中に、プロカスパーゼ8はFLIP Lとして知られる別のDED含有タンパク質とヘテロ二量体を形成することもできる。FLIP Lの擬似カスパーゼは、プロカスパーゼ8のN末端に非常に類似した2つのタンデムDEDを有するが、活性部位(システインからチロシン)に重要な変異がある。
DED間のヘテロ二量体化は、通常のホモ二量体化を阻害するため、擬似カスパーゼはアポトーシスカスケードを活性化することができません。FLIP Lの擬似カスパーゼは、構造変化を誘導する上でより効率的です。しかし、FLIP Lは酵素活性が不十分であるため、DEDとp18間の切断は不可能です。その結果、活性プロテアーゼによる細胞死を引き起こすことは不可能です。[10]
プロカスパーゼ-8は、同じくDED含有タンパク質であるFLIP Sとヘテロ二量体を形成することもできる。この場合、プロカスパーゼ-8のカスパーゼドメインにおける初期の構造変化が起こらないため、ヘテロ二量体形成はプロカスパーゼ-8を直接活性化することができない。[10]

このようにして、DED はアポトーシスカスケードを阻害し、その結果としてネクロプトーシスを引き起こします。
DEDタンパク質ファミリー
DED含有タンパク質
カスパーゼ8とカスパーゼ10
[11]カスパーゼはアポトーシスの際に細胞を分解する役割を担うシステインプロテアーゼである。
これらのタンパク質は酵素原であり、分子内の特定の部位で切断された後に活性化します。
構造:
- デスエフェクタードメイン(DED)とカスパーゼリクルートメントドメイン(CARD)は、N末端に位置するプロドメインと呼ばれる構造に包み込まれている。
- C 末端の触媒プロテアーゼドメイン。
プロテアーゼには2つのグループがあります。
- エフェクターカスパーゼ: アポトーシス中に起こる形態変化の大部分を引き起こします。
- イニシエーターカスパーゼ:エフェクターカスパーゼの活性化を担う。これらのカスパーゼは、オリゴマー形成と切断によって活性化され、タンパク質の機能を発揮する。
カスパーゼのプロドメイン内の 2 つのタンデム DED は、FADDなどの他のタンパク質とのタンパク質間相互作用を誘発します。
カスパーゼはアポトーシスを制御するだけでなく、細胞の必要性に応じて阻害も行うため、その研究は重要です。科学者たちは、カスパーゼが細胞寿命を調節するメカニズムであり、がん治療において重要であることを発見しています。
FLICE様阻害タンパク質(FLIP)
FLICE 様阻害タンパク質 (FLIP) は、細胞のアポトーシスを引き起こすデスレセプターのシグナルを阻止できる細胞阻害剤です。
最初に同定されたFLIPはγヘルペスウイルスによって発現していたため、v-FLIPと呼ばれていました。これらのv-FLIPは細胞死誘導シグナル伝達複合体(DISC)の受容体と結合し、CD95を介したアポトーシスを阻害しました。
[12] vFLIPは主に2つの連続したDEDを含み、これはカスパーゼ8のN末端と高い相同性を持っています。
[10] v-FLIPの細胞相同体は一般 的に2つの形式で発現される:
- c-FLIP S(ショート):アミノ末端タンデムDEDのみを含み、それに続く短いカルボキシ末端セクションを含む。その構造はウイルスのFLIPに類似している。
- c-FLIP L (長い): タンデム DED だけでなく、活性部位のシステインを含む、プロテアーゼ活性に重要なさまざまなアミノ酸が変異しているプロテアーゼ様ドメイン (カスパーゼ 8 と相同) で構成されています。
[12] c-FLIPの両方の形態はCD95 DISCに誘導され、そこでカスパーゼ8とヘテロ二量体を形成する。c-FLIPはCD95受容体をNF-κB、JNK、MAPK経路に接続する代替経路のシグナル伝達に関与している。
PEA-15/PED
PEA-15 (アストロサイトに濃縮されたリンタンパク質 - 15 kDa)は、 PED (糖尿病に濃縮されたリンタンパク質)としても知られ、多面的効果を持つDED 含有タンパク質です。
PEDは、N末端のデスエフェクタードメイン(DED)と不規則な構造を持つC末端テールからなる、小型の非触媒性タンパク質です。 [13] PED/PEA-15は、DEDの有無にかかわらずさまざまな種類のタンパク質と相互作用し、これらのタンパク質に結合する特異性は、C末端テールの 2つのセリン残基のリン酸化によって媒介されます。
- Ser104 :プロテインキナーゼC (PKC)によってリン酸化される。
- Ser116 :カルシウム/カルモジュリン依存性タンパク質キナーゼII (CamKII)の基質。
[13] PEA-15は、いくつかのシグナル伝達カスケードにおいて抗アポトーシスDEDタンパク質として作用する。TNFα、CD95、TRAILを介した経路において、PEA-15はFADDとカスパーゼ8の相互作用に結合し、阻害する。
[10]アポトーシスに加えて、PEA-15は筋肉細胞におけるインスリン媒介グルコース輸送を阻害するため、PEA-15 mRNAの高レベル発現は2型糖尿病と関連付けられている。
DEDD/DEDD2
DNA結合能を持つデスエフェクタードメイン(DEDD)。DNA結合能を示し、過剰発現すると核小体に局在し、アポトーシスを増強するDEDAF(DED関連因子)と呼ばれる分子と会合する。さらに、DNAに結合して RNAポリメラーゼIの 転写を阻害する。
DEDD2(FLAME-3)はDEDDホモログであり、アミノ酸配列の48.5%を共有しています。c-FLIPおよびDEDDと相互作用し、ポリメラーゼII依存性転写抑制において重要な役割を果たすことが知られています。
DED関連ドメインを持つタンパク質
HIP-1とHIPPI
ハンチンチン相互作用タンパク質-1 (HIP-1)はハンチンチン (Htt)と相互作用するタンパク質であり、ハンチントン病 (HD)患者の脳内で変異 (ポリグルタミン反復の拡張) するとタンパク質凝集体を形成する別のタンパク質です。
[14] HIP-1は擬似デスエフェクタードメイン(pDED)を有しており、そのためHIP-1の過剰発現はDEDタンパク質と同様に複数の細胞でアポトーシスを誘導します。このタイプのアポトーシスはHIP-1のpDEDに依存し、野生型Httの発現時に減少する酵素であるカスパーゼ3の活性化を伴います。この事実は、ハンチントン病の病態機序においてHIP-1がHttと協調して機能していることを示唆しています。
[10]酵母ツーハイブリッドスクリーニングにより、HIP-1はHIPPI(HIP-1タンパク質相互作用因子)と呼ばれる419個のアミノ酸からなるタンパク質と相互作用することが示されました。その後の実験により、HIPPIの存在がHIP-1誘導性アポトーシスを決定することが明らかになりました。
フラッシュ
FLICE関連巨大タンパク質。DEDと類似のドメインを有するが、相同性は非常に低く、その機能は未だ不明である。
DEDの治療的利用
[7] DED複合体は、細胞の生死を制御する重要な段階で機能することが示されています。細胞生命の異常な制御に関連する病態は数多く存在するため、この知見は治療において特に有用です。
アポトーシスの欠如は癌の特徴です。プロカスパーゼ8をコードする遺伝子がメチル化によってサイレンシングされている場合、活性プロテアーゼを発現させるには、エピジェネティック治療を用いてこの遺伝子を活性化する必要があります。また、活性カスパーゼの形成を阻害する抗アポトーシス分子であるFLIPの過剰発現がみられる場合もあります。この場合、FLIPの発現を抑制する抗癌剤がいくつかあります。
しかし、異常なアポトーシスはがんだけに限らず、炎症や神経変性疾患など、この種の治療薬で治療できる他の病状もあります。
参考文献
- ^ Eberstadt M, Huang B, Chen Z, et al. (1998年4月). 「FADD (Mort1) デスエフェクタードメインのNMR構造と変異誘発」. Nature . 392 (6679): 941–5 . Bibcode :1998Natur.392..941E. doi :10.1038/31972. PMID 9582077. S2CID 4370202.
- ^ Valmiki MG, Ramos JW (2009年3月). 「デスエフェクタードメイン含有タンパク質」. Cell. Mol. Life Sci . 66 (5): 814–30 . doi :10.1007/s00018-008-8489-0. PMC 11131443. PMID 18989622. S2CID 13117680 .
- ^ Shen, Chen; Yue, Hong; Pei, Jianwen; Guo, Xiaomin; Wang, Tao; Quan, Jun-Min (2015). 「カスパーゼ8のデスエフェクタードメインの結晶構造」.生化学および生物理学的研究コミュニケーション. 463 (3): 297– 302. doi :10.1016/j.bbrc.2015.05.054. ISSN 0006-291X. PMID 26003730.
- ^ 「細胞死における構造、ドメインおよび機能」。
- ^ エルモア、スーザン (2007). 「アポトーシス:プログラム細胞死のレビュー」.毒性病理学. 35 (4): 495– 516. doi :10.1080/01926230701320337. ISSN 1533-1601. PMC 2117903. PMID 17562483 .
- ^ Singh, Nitu; Hassan, Ali; Bose, Kakoli (2015). 「デスエフェクタードメイン鎖の組み立てとカスパーゼ8活性化における役割の分子基盤」 . The FASEB Journal . 30 (1): 186– 200. doi : 10.1096/fj.15-272997 . ISSN 1530-6860. PMID 26370846.
- ^ ab Riley, JS; Malik, A; Holohan, C; Longley, DB (2015). 「DEDか生きているか:デスエフェクタードメイン複合体の組み立てと制御」. Cell Death and Disease . 6 (8): e1866. doi :10.1038/cddis.2015.213. ISSN 2041-4889. PMC 4558505. PMID 26313917 .
- ^ Yao, Zhan; Duan, Shanshan; Hou, Dezhi; Heese, Klaus; Wu, Mian (2007). 「カスパーゼ8/Mch5の自己切断産物であるデスエフェクタードメインDEDaは、ERK1/2に結合して核に移行し、p53依存性メカニズムを介してプロカスパーゼ8の発現をアップレギュレーションする」. The EMBO Journal . 26 (4): 1068– 1080. doi :10.1038/sj.emboj.7601571. ISSN 1460-2075. PMC 1852837. PMID 17290218 .
- ^ Lee, Eun-Woo; Seo, Jinho; Jeong, Manhyung; Lee, Sangsik; Song, Jaewhan (2012). 「外因性アポトーシスおよびネクロプトーシスにおけるFADDの役割」BMB Reports . 45 (9): 496– 508. doi : 10.5483/BMBRep.2012.45.9.186 . ISSN 1976-670X. PMID 23010170.
- ^ abcde Barnhart, Bryan C; Lee, Justine C; Alappat, Elizabeth C; Peter, Marcus E (2003). 「デスエフェクタードメインタンパク質ファミリー」. Oncogene . 22 (53): 8634– 8644. doi :10.1038/sj.onc.1207103. ISSN 0950-9232. PMID 14634625.
- ^ Schleich, K.; Buchbinder, JH; Pietkiewicz, S.; Kähne, T.; Warnken, U.; Öztürk, S.; Schnölzer, M.; Naumann, M.; Krammer, PH (2016-04-01). 「DISCにおけるDED鎖の分子構造:短鎖DEDタンパク質c-FLIPおよびプロカスパーゼ8プロドメインによるプロカスパーゼ8活性化の制御」. Cell Death & Differentiation . 23 (4): 681– 694. doi :10.1038/cdd.2015.137. ISSN 1350-9047. PMC 4986640. PMID 26494467 .
- ^ ab Yu, JW; Shi, Y (2008). 「FLIPとデスエフェクタードメインファミリー」. Oncogene . 27 (48): 6216– 6227. doi : 10.1038/onc.2008.299 . ISSN 0950-9232. PMID 18931689.
- ^ ab Twomey, Edward C; Cordasco, Dana F; Wei, Yufeng (2012). 「NMRバックボーンダイナミクスによるERK2複合体におけるPED/PEA-15の顕著な構造変化」Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics . 1824 (12): 1382– 1393. doi :10.1016/j.bbapap.2012.07.001. ISSN 1570-9639. PMID 22820249.
- ^ Bhattacharyya, Nitai P; Banerjee, Manisha; Majumder, Pritha (2008). 「ハンチントン病:アポトーシスと転写の制御におけるハンチンチン相互作用タンパク質1(HIP-1)とその分子パートナーHIPPIの役割」. The FEBS Journal . 275 (17): 4271– 4279. doi : 10.1111/j.1742-4658.2008.06563.x . ISSN 1742-464X. PMID 18637945.
外部リンク
- ナッシュ研究所: DED [永久リンク切れ]
- InterPro: デスエフェクタードメイン
- スマート: DED
- Receptores de la Muerte: señalización y modulación 2017-01-28ウェイバック マシンにアーカイブ