脱炭酸クロスカップリング反応は、カルボン酸と有機ハロゲン化物が反応して新たな炭素-炭素結合を形成し、同時にCO 2が失われる化学反応です。この反応にはアリールハロゲン化物とアルキルハロゲン化物が関与します。金属触媒、塩基、酸化剤が必要です。

この反応の大きな利点は、比較的安価なカルボン酸(またはその塩)を使用し、一般的なクロスカップリング有機金属試薬と比較して、空気や湿気に対する感受性がはるかに低いことです。さらに、カルボン酸部分は天然物に共通する特徴であり、比較的無害な空気酸化によっても調製できます。さらに、官能基に対する許容範囲が広く、強塩基の使用を回避できることも利点です。この反応における重要な基本ステップは、まずC–COOH結合をそれぞれC–H結合またはC–M結合に変換するプロト脱炭酸またはメタル化です。 [1]
歴史と触媒開発
銅の単金属系
最初に報告された脱炭酸クロスカップリング反応は、1966年にニルソンらによって報告されたウルマン反応である。ハロゲン化アリールの存在下での銅安息香酸塩の熱脱炭酸により、アリール-Cu中間体を経て(対称および非対称の両方の)ビアリールが生成されることが判明した。[2]

この単一金属銅系は、完全なクロスカップリング反応を実現するために厳しい条件を必要とし、また様々な固有の制約を有していたため、この反応の触媒的予備反応の開発は阻まれていた。 [3] 2009年になってようやく、LiuとShangらは、単一金属ヨウ化銅を触媒として用いることで、アリール臭化物およびアリールヨウ化物とポリフルオロ安息香酸カリウムとの脱炭酸的クロスカップリング反応が達成できることを発見した。銅のみの触媒サイクルにおいて、酸化付加段階が律速段階であることが判明した(Pd触媒による脱炭酸的クロスカップリングとは対照的である)。[4]

Cu(I)のみの系は、アルキニルカルボン酸とアリールハライド(下記のアリールアルキンを参照)とのカップリングや、アミノ酸とアルキン(または同様の求核剤)との脱炭酸脱水素クロスカップリングを促進することもわかっています。[5] [6]

脱炭酸クロスカップリング触媒はML2型触媒の一般形であり、様々な基質に最適化した多様な配位子タイプが存在する。銅(および銀)中心はフェナントロリンと錯体を形成することが多く、配位子上の電子過剰置換基によって活性が上昇することが報告されている。[1]
パラジウム単金属系
2000年にSteglichらはラメラリンLの合成において分子内Pd(II)を介した脱炭酸クロスカップリング反応を報告した。[7] Myersらは2002年に酸化剤(Ag 2 CO 3 )存在下でのオルト置換アレーンカルボキシレートの脱炭酸オレフィン化を報告した。[8]

その後の研究では、均一系Pd触媒はCuやAg触媒よりも低温で酸を脱炭酸できることが示されたが、電子豊富なオルト置換芳香族カルボン酸に限られていた。[9] [10] それにもかかわらず、パラジウム触媒は、ビアリール形成やアリールアルキン形成などの幅広いクロスカップリング反応、およびカルボン酸が芳香族に結合していないさまざまなクロスカップリング反応を促進することができる。[5] [11] [12]その他のPd触媒脱炭酸クロスカップリング反応には、共役ジエンの調製(以下のジエンとトリエンを参照)と脱水素反応(さまざまな基質と触媒の組み合わせを使用) がある。[1] [13]

銅のみのシステムとは対照的に、脱炭酸パラジウム化はパラジウム触媒サイクルにおける律速段階である。 [4]

パラジウム-銅二金属系
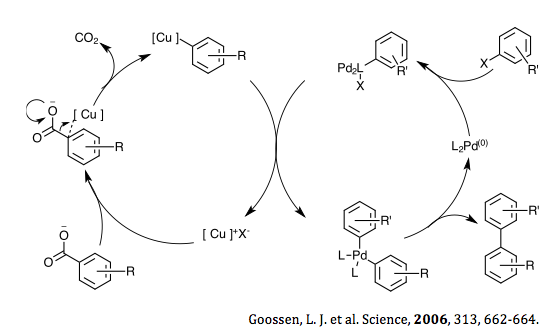
Pd–Cu 二金属系は、2006 年に Goossenらがハロゲン化アリールとオルト置換芳香族カルボン酸の脱炭酸クロスカップリングを報告して初めて発見されました。 [14]その後の研究で、アリールトリフラート の使用により、クロスカップリングの基質範囲がオルト置換のない(反応性が低い)芳香族カルボキシレートにまで拡張されることがわかりました。これは、反応で生成されたハロゲン化物アニオンが Cu 触媒による脱炭酸プロセスを阻害するという事実によるものです。[15] システムと触媒条件をさらに最適化することで、Pd–Cu 二金属系を使用した脱炭酸クロスカップリングを有機合成、特にビアリールの形成に応用できるようになりました。[3]また、この複合触媒システムの可変性により、アリールケトン形成、C-ヘテロ原子クロスカップリングなど、 さまざまな反応を促進できます。 [1]

パラジウム-銀二金属系
銀は銅と同じグループに属しているため、Pd–Ag(I) 二金属システムは本質的に Pd–Cu触媒システムと類似しています。しかし、銀塩は銅同等物よりもカルボン酸のプロト脱炭酸に適しており、Pd–Ag サイクルでは Pd–Cu サイクルに比べて反応条件が穏やかになります。[16] Ag(I) 触媒一金属システムも報告されています。銅に比べて銀塩の方が優れているのは、基質の脱炭酸を促進するd 軌道の拡張が大きいことと電気陰性度が低いためです。 [17] この触媒の組み合わせの制限の 1 つは、銀塩が不溶性のハロゲン化銀を形成するため、ハロゲン化物が存在する場合は反応に化学量論量の Ag が必要になることです。この障害は、2010 年にGoossenらによってアリールトリフラートを使用することで克服され、アリールスルホン酸塩との触媒反応も報告されています。[3] [18]

基板のバリエーションによる製品範囲
この反応の生成物の範囲は、様々な基質を用いることで非常に広範囲にわたります。しかし、様々な機能性物質の開発には、適切な触媒系を決定するための付随研究が必要でした。最も一般的な反応は、C–COOH結合とC–X結合のカップリングですが、C–COOHとC–Mのクロスカップリング、カルボン酸のホモカップリング、ヘックカップリング、脱水素クロスカップリングも、CO2を放出するため、この反応に含まれます。C – N、C–S、C–P、C–X結合の形成を伴う ヘテロ原子クロスカップリング反応も実証されています。 [1]
ビアリール形成
IUPACによれば、ビアリールという用語は、単結合でつながった2つの芳香環の集合体を指し、[19]最も単純なビフェニルから始まります。ビアリールは、物理的有機、合成、触媒の重要な構造モチーフを構成しており、例えば、エナンチオ選択的合成におけるアトロプ異性体の領域の基礎となっています。また、多くの医薬品、農薬、材料(例:LCD)用途に使用されています。[要出典]ビアリールの製造に用いられるカップリング反応の例は、従来の鈴木およびスティルのクロスカップリング反応の代替であり、この変換にはさまざまな触媒が使用されています。Goossenらは、塩基の存在下でアリールまたはヘテロアリールカルボン酸とアリールハロゲン化物(I、Br、またはCl)とのパラジウムおよび銅触媒クロスカップリング反応からビアリールを生成することを報告しました。[20]

アリールアルキン
アリールアルキンは、通常、末端アルキンとハロゲン化アリールとのパラジウム触媒クロスカップリング反応である薗頭反応を利用して製造されます。末端アルキンの代わりにアルキンカルボン酸を使用すると、取り扱いや保管が容易になるという利点があります。アルキンカルボン酸の脱炭酸カップリング反応は、2008年にS. Leeによって初めて報告されました。彼らはアルキン源としてプロピオール酸を用いました。1年後、S. Leeはこの脱炭酸カップリング反応を2-オクチン酸とフェニルプロピオール酸に適用しました。2010年には、Xueらが、銅のみの触媒を用いて、穏やかな反応条件下でハロゲン化アリールとアルキニルカルボン酸をカップリングし、アリールアルキンを得ることを報告しました。
[21] [22] [23] [24]

アリールケトン
グーセンらによるさらなる研究では、α-オキソカルボン酸とアリールまたはヘテロアリール臭化物からアシルアニオン中間体を経てケトンを合成する方法が報告されている。 [25]

アリールエステル
Shangらは、シュウ酸カリウムモノエステルとアリールハライドとの脱炭酸カップリングによりアリールエステルまたはアルケニルエステルを得る方法を発見した。 [5]

sp3Cカルボン酸
多くの脱炭酸クロスカップリング反応はsp 2 C–COOH結合およびsp C–COOH結合の切断を伴うため、その後の研究ではsp 3 Cカルボン酸とのクロスカップリングを可能にする試みがなされてきました。Shangらによるそのような反応の一つは、パラジウム触媒を用いたクロスカップリング反応であり、官能基化されたピリジン、ピラジン、キノリン、ベンゾチアゾール、およびベンゾオキサゾールの形成を可能にしました。結合に対して2位の窒素原子の位置が重要であることが示されており、したがって遷移状態においてPdに結合することが示唆されています。 [26]

ジエンとトリエン
三浦らは、パラジウム触媒を用いた臭化ビニルとアルケニルカルボン酸とのクロスカップリング反応を報告した。合成された共役ジエンの中には、固体状態で蛍光を発するものもあったと報告されている。 [27]

ヘック型オレフィン
Suらによる脱炭酸Heckカップリングは、ベンゾキノンを酸化剤として使用してアリールオレフィンを得るために使用できる。 [28]

フェナントレン誘導体
王らは、パラジウム触媒を用いた分子間経路による[4+2]環化の新しい方法を提案した。誘導体は中程度から良好な収率で生成するが、高い反応効率を得るにはアクリジンが不可欠である。 [29]

C–Nカップリング
Jiaoらは、空気を酸化剤として、銅触媒を用いてクロスカップリング反応によるC–N結合の形成を可能にした。sp 3またはsp 2 C–COOH結合を切断するC–Nクロスカップリングの条件は知られていない。 [30]

CSカップリング
Liuらは、Pd/Cu触媒系を用いたアリールカルボン酸とジスルフィドまたはチオールとのCSカップリングを報告した。 [31]

C–Pカップリング
YangらはPd-CuまたはCu触媒を用いて、脱炭酸C-Pクロスカップリングの最初の例を報告した。 [32]

C–Xカップリング
Wuらは、CuX2(X = Br、Cl)と銀触媒を用いたC–Xクロスカップリングによりアリールハライドを得ることを報告した。 [ 33]

メカニズム研究
脱炭酸型ヘック型
2005年、Meyersらは脱炭酸クロスカップリング反応の以下の機構を提唱した[10] 。最初の段階であり、律速段階となるのは脱炭酸である。アレーン環のイプソ炭素が最初にパラジウム中心に配位し、続いて二酸化炭素が脱離してアリール-パラジウム中間体を形成すると考えられる。次に、オレフィンがアレーンとパラジウム中心の間に挿入され、β脱離によって目的のハロゲン化ビニルとパラジウム水素化物が形成される。このプロトンは炭酸銀によって引き抜かれ、炭酸銀は塩基と酸化剤の両方として作用して出発パラジウム錯体を再生し、触媒サイクルを完了する。

酸化還元中性脱炭酸クロスカップリングによるビアリール合成
2006年にGoossenらは、触媒的脱炭酸クロスカップリングによるビアリール化合物の合成反応を提案した[34] 。 この反応機構は、ハロゲン化銅を用いるサイクルとパラジウムを用いるサイクルの2つの重なり合うサイクルから構成される。置換安息香酸とハロゲン化銅の間で脱炭酸反応が起こり、中間体のアリール銅種が形成される。パラジウムは最初にアリールハロゲン化物から酸化付加を受け、Pd(II)アリール錯体を形成する。これらの初期段階の後、置換アリール銅はパラジウム錯体と金属交換反応を起こす。この段階でハロゲン化銅が形成され、これが置換安息香酸と陰イオン交換反応を起こしてアリール銅中間体を形成し、触媒サイクルが継続される。トランスメタル化段階で形成されるもう一つの錯体はビスアリールパラジウム(II)であり、その後還元的脱離を受けて目的のビスアリール種と出発物質のPd(0)錯体を形成し、触媒サイクルが完了します。
ヘテロ芳香族酸カップリング
Forgione, P., Bilodeau, F. らは、カルボン酸を含むヘテロ原子もパラジウム一金属系で許容され、ハロゲン化アリールと脱炭酸クロスカップリングを起こすことを報告した。[35]提案されたメカニズムでは、最初のステップはハロゲン化アリールの酸化付加であり、アリール–パラジウム中間体を形成する。次にヘテロ原子の炭素 3 で求電子パラジウム化が起こる。この中間体から、サイクルを継続するための 2 つの経路が考えられる。1 つ目は、二酸化炭素の排出を伴う炭素 3 から炭素 2 へのパラジウムの移動である。これにより、アリール–パラジウム–ヘテロ原子中間体が形成され、これが還元脱離して最終的なヘテロ芳香族化合物を形成する。2 つ目の経路は、R がプロトンの場合にのみ発生する。この場合、脱プロトン化が起こり、ヘテロ原子の芳香族性が回復する。この中間体はその後、還元脱離反応を起こし、アリール基をヘテロ原子の炭素3位にカップリングさせます。この化合物はカルボン酸をまだ含んでいるため、触媒サイクルに再び入り、炭素2位でカップリング反応を起こし、二酸化炭素を排出してビアリールヘテロ原子を形成します。この経路は脱炭酸反応と競合するため、2つの生成物が生成され、反応の選択性は低下します。その結果、炭素3位に置換されたヘテロ原子は、より高い制御性を示すため、より好ましい反応となります。

参考文献
- ^ abcde Shang R, Liu, L. 遷移金属触媒による脱炭酸クロスカップリング反応. Science China-Chemistry , 2011 , 11 , 54: 1670–1687 DOI: 10.1007/s11426-011-4381-0
- ^ Nilsson M. ウルマンビアリール合成と銅触媒脱炭酸反応の関連性を示す新たなビアリール合成法. Acta Chem Scand , 1966 , 20: 423–426. DOI: 10.3891/acta.chem.scand.20-0423
- ^ abc Rodríguez N, Goossen L. 脱炭酸カップリング反応:C–C結合形成のための最新戦略. Chem Soc Rev , 2011 , 40:5030–5048. DOI: 10.1039/C1CS15093F
- ^ ab Shang R, Fu Y, Wang Y, Xu Q, Yu HZ, Liu L. 銅触媒によるポリフルオロ安息香酸カリウムとアリールヨウ化物および臭化物の脱炭酸クロスカップリング. Angew Chem Int Ed , 2009 , 48: 9350–9354. DOI:10.1002/anie.200904916
- ^ abc Shang R, Fu Y, Li JB, Zhang SL, Guo QX, Liu L. シュウ酸カリウムモノエステルと臭化アリールおよび塩化アリールのPd触媒脱炭酸カップリングによる芳香族エステルの合成. J Am Chem Soc , 2009 , 131: 5738–5739 DOI: 10.1021/ja900984x
- ^ Bi HP, Zhao L, Liang YM, Li CJ. 銅触媒によるα-アミノ酸のsp3混成炭素原子の脱炭酸カップリング. Angew Chem Int Ed , 2009 , 48: 792–795 DOI: 10.1002/anie.200805122
- ^ Peschko C, Winklhofer C, Steglich W. 2つの異なるアリールピルビン酸ユニットのカップリングによるラメラリンLの生体模倣全合成. Chem Eur J , 2000 , 6: 1147–52 DOI: 10.1002/(SICI)1521-3765(20000403)6:7<1147::AID-CHEM1147>3.0.CO;2-1
- ^ Myers AG, Tanaka D, Mannion MR. 脱炭酸パラジウム化反応の開発とアレーンカルボキシレートのHeck型オレフィン化への応用. J Am Chem Soc , 2002 , 124: 11250–51 DOI: 10.1021/ja027523m
- ^ Dickstein JS, Mulrooney CA, O'Brien EM, Morgan BJ, Kozlowski MC. 触媒的芳香族脱炭酸反応の開発. Org Lett , 2007 , 9: 2441–44 DOI: 10.1021/ol070749f
- ^ ab Meyers et al. パラジウム(II)触媒によるアレーンカルボン酸の脱炭酸オレフィン化の機構について。非ホスフィンパラジウム(II)中間体の結晶構造解析とヘック様過程における段階的変化の観察 JACS, 2005, 127, 10323–33 DOI: 10.1021/ja052099l
- ^ Zhang WW, Zhang XG, Li JH. パラジウム触媒によるアルキニルカルボン酸とベンジルハライドまたはアリールハライドの脱炭酸カップリング. J Org Chem , 2010 , 75: 5259–5264 DOI: 10.1021/jo1010284
- ^ Yeung PY, Chung KH, Kwong FY. パラジウム触媒によるシアノ酢酸カリウムの脱炭酸アリール化:アリールハライドからのα-ジアリールニトリルの合成. Org Lett , 2011 , 13: 2912–15 DOI: 10.1021/ol2009522
- ^ 山下 正之、平野 健、佐藤 剛、三浦 正之. パラジウム触媒下における桂皮酸と臭化ビニルの脱炭酸カップリングによるα,ω-ジアリールブタジエンおよびヘキサトリエンの合成. Org Lett , 2010 , 12: 592–95 DOI: 10.1021/ol9027896
- ^ Goossen LJ, Deng GJ, Levy LM. 触媒的脱炭酸カップリングによるビアリールの合成. Science , 2006 , 313: 662–64 DOI: 10.1126/science.1128684
- ^ Goossen LJ, Rodriǵ uez N, Linder C. 芳香族カルボキシレートとアリールトリフラートからの脱炭酸ビアリール合成J Am Chem Soc , 2008 , 130: 15248–49 DOI: 10.1021/ja8050926
- ^ Goossen LJ, Rodríguez N, Linder C, Lange PP, Fromm A. 銅触媒および銀触媒によるカルボン酸のプロト脱炭酸反応の比較研究. ChemCatChem , 2010 , 2: 430–42 DOI: 10.1002/cctc.200900277
- ^ Lu P, Sanchez C, Cornella J, Larrosa I. 銀触媒によるヘテロ芳香族カルボン酸のプロト脱炭酸反応. Org Lett , 2009 , 11: 5710–5713 DOI:10.1021/ol902482p
- ^ Goossen LJ, Lange PP, Rodríguez N, Linder C. 低温Ag/Pd触媒によるアリールトリフラートと芳香族カルボン酸塩の脱炭酸クロスカップリングChem Eur J , 2010 , 16: 3906–09 DOI: 10.1002/chem.200903319
- ^ IUPAC ,化学用語集、第5版(「ゴールドブック」)(2025年)。オンライン版:(2006年以降)「環形成」。doi : 10.1351/goldbook.R05393
- ^ Goossen LJ, Rodríguez N, Melzer B, Linder C, Deng GJ, Levy LM. Pd触媒を用いた芳香族カルボン酸エステルとアリールハライドの脱炭酸カップリングによるビアリール合成. J Am Chem Soc , 2007 , 129: 4824–33 DOI: 10.1021/ja068993+
- ^ Park, K. Lee, S. 遷移金属触媒によるアルキニルカルボン酸の脱炭酸カップリング反応RSC Advances 2013 , 3: 14165-14182 DOI: 10.1039/C3RA41442F
- ^ Moon, J. Jeong, M. Nam, H. Ju, J. Moon, JH Jung HM Lee, S. パラジウム触媒Sonogashira反応およびsp炭素とsp2炭素の脱炭酸カップリングを用いたジアリールアルキンのワンポット合成Org. Lett. , 2008 , 10: 945–948. DOI: 10.1021/ol703130y
- ^ Moon, J. Jang, M. Lee, S. パラジウム触媒によるアルキニルカルボン酸とアリールハライドの脱炭酸カップリングJ. Org. Chem. , 2009 , 74: 1403-1406. DOI: 10.1021/jo802290r
- ^ Zhao DB, Gao C, Su XY, He YQ, You JS, Xue Y. 銅触媒によるアルキニルカルボン酸とアリールハライドの脱炭酸クロスカップリング. Chem Commun , 2010 , 46: 9049–51 DOI: 10.1039/c0cc03772a
- ^ Goossen LJ, Rudolphi F, Oppel C, Rodríguez N. Cu/Pd触媒を用いた脱炭酸クロスカップリングによるα-オキソカルボキシレートと臭化アリールからのケトン合成. Angew Chem Int Ed , 2008 , 47: 3043–3045 DOI: 10.1002/anie.200705127
- ^ Shang R, Yang ZW, Wang Y, Zhang SL, Liu L. パラジウム触媒による2-(2-アザアリール)酢酸エステルとアリールハライドおよびトリフラートの脱炭酸カップリングJ Am Chem Soc , 2010 , 132: 14391–93 DOI:10.1021/ja107103b
- ^ 山下 正之、平野 健、佐藤 剛、三浦 正之. パラジウム触媒下、桂皮酸と臭化ビニルの脱炭酸カップリングによるα,ω-ジアリールブタジエンおよびヘキサトリエンの合成. Org Lett , 2010 , 12: 592–95 DOI: 10.1021/ol9027896
- ^ Hu P, Kan J, Su W, Hong M. Pd(O2CCF3)2/ベンゾキノン:アレーンカルボン酸の脱炭酸オレフィン化のための多用途触媒システム. Org Lett , 2009 , 11: 2341–44 DOI: 10.1021/ol9007553
- ^ Wang CY, Rakshit S, Glorius F. パラジウム触媒による2-フェニル安息香酸とアルキンのCHおよびCC結合活性化を介した分子間脱炭酸カップリングJ Am Chem Soc , 2010 , 132: 14006– 14008DOI: 10.1021/ja106130r
- ^ Jia W, Jiao N. 銅触媒による空気中プロピオール酸の酸化アミド化と脱炭酸カップリング. Org Lett , 2010 , 12: 2000–03 DOI: 10.1021/ol1004615
- ^ Duan ZY, Ranjit S, Zhang PF, Liu XG. 脱炭酸CSクロスカップリングによるアリールスルフィドの合成. Chem Eur J , 2009 , 15: 3666–3669 DOI:10.1002/chem.200900133
- ^ Hu J, Zhao N, Yang B, Wang G, Guo LN, Liang YM, Yang SD. 銅触媒による脱炭酸反応を介したC–Pカップリング. Chem Eur J , 2011 , 17: 5516–5521 DOI: 10.1002/chem.201003561
- ^ Luo Y, Pan XL, Wu J. 銀触媒によるカルボン酸の脱炭酸ハロゲン化. Tetrahedron Lett , 2010 , 51: 6646–48 DOI: 10.1016/j.tetlet.2010.10.054
- ^ Lukas J. Gooßen他「触媒的脱炭酸カップリングによるビアリールの合成」、Science 313, 662 (2006), DOI: 10.1126/science.1128684
- ^ Forgione, P., Bilodeau. F. et al. ヘテロ芳香族カルボン酸をカップリングパートナーとして用いた予期せぬ分子間Pd触媒クロスカップリング反応 J. Am. Chem. Soc., 2006, 128 (35), pp 11350–51 DOI: 10.1021/ja063511f