ハウザー塩基はマグネシウムアミド塩基とも呼ばれ、有機化学においてメタル化反応の塩基として用いられるマグネシウム化合物です。これらの化合物は、 1947年にチャールズ・R・ハウザーによって初めて報告されました。[1]有機リチウム試薬 と比較して、マグネシウム化合物は共有結合性が高く、したがって反応性が低い金属-配位子結合を有します。その結果、官能基許容度が高く、はるかに高い化学選択性を示します。[2]一般的に、ハウザー塩基は室温で使用されますが、有機リチウム試薬との反応は低温、一般的には-78℃で行われます。
構造
ハウザー塩基は、実験式R 2 NMgX(X = ハロゲン化物)で表される。ハロゲン化物架橋を有する二量体として結晶化する。Mgには、第二級アミンである2,2,6,6-テトラメチルピペリジン(TMP −)およびHMDS −)に由来するアミド(R 2 N)配位子が結合している。 [3] [4] [5]
アミド架橋ハウザー塩基は、Et 2 N −やPh 3 P=N −などのアミド配位子が比較的小さい場合に存在する。[4] [6] [7]
- 選択されたハウザー塩基の構造(わかりやすくするためにH原子は除去されている)
-
TMPハウザー基地
-
HMDSハウザー基地
-
ジエチルアミドハウザー塩基
溶液中のハウザー塩基の構造は、拡散秩序NMR分光法(DOSY)によって研究されている。[8]これらの研究は、i Pr 2 NMgClがシュレンク平衡に従うことを示している。[9]
- i Pr 2 NMgCl ( A ) ⇌ ( i Pr 2 N) 2 Mg ( B ) + MgCl 2
この平衡は温度依存性があり、高温ではヘテロレプティック(A)が主成分であり、低温ではホモレプティック(B)が優勢である。THF溶液中には、架橋塩化物やアミドを含む二量体も存在する。低温では、MgCl 2の付加物が溶液中に存在する。[9]
準備と反応
ハウザー塩基は、第二級アミンをグリニャール試薬で処理することによって製造されます。
- R 2 NH + R′MgX → R 2 NMgX + R′H X = Cl, Br, I
(:R 2 NH =ジイソプロピルアミン、TMP)
多くの有機リチウム試薬と同様に、ハウザー塩基は一般にメタル化試薬として用いられる。i Pr 2 NMgBrはカルボキサミドを選択的にマグネシウム化する。[10] i Pr 2 NMgX (X = Cl, Br)はチオフェンの脱プロトン化を促進する。[11]およびフェニルスルホニル置換インドールの脱プロトン化を促進する。[12]
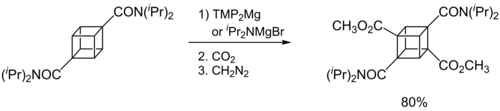

ターボハウザーベース
ハウザー塩基の主な欠点は、THFへの溶解性が低いことである。その結果、メタル化速度は遅く、大過剰の塩基(例えば10当量)が必要となる。この状況は、メタル化中間体の求電子剤による官能基化を複雑にする。ハウザー塩基に化学量論量のLiClを添加することで、溶解性と反応性を向上させることができる。これらのいわゆるターボハウザー塩基(例えばTMPMgCl·LiClやi Pr 2 NMgCl·LiCl)は市販されており、これらは優れた速度論的塩基性、位置選択性、および官能基許容性を示す。[13]
参考文献
- ^ Hauser CR, Walker H (1947). 「臭化ジエチルアミノマグネシウムによる特定のエステルの縮合」. J. Am. Chem. Soc . 69 (2): 295. doi :10.1021/ja01194a040.
- ^ Li–Yuan Bao, R.; Zhao, R.; Shi, L. (2015). 「ターボグリニャール試薬i-PrMgCl·LiClの進歩と発展:10年間の歩み」. Chem. Commun. 51 (32): 6884– 6900. doi :10.1039/C4CC10194D. PMID 25714498.
- ^ 例えば、Seven, Ö.、Bolte, M.、Lerner, H.-W. (2013). 「ジ-μ-ブロミド-ビス[(ジエチルエーテル-κO)(2,4,6-トリメチルフェニル)マグネシウム]:メシチルグリニャール試薬」(PDF) . Acta Crystallogr. E. 69 ( 7): m424. doi :10.1107/S1600536813017108. PMC 3772445. PMID 24046588 .
- ^ ab García–Álvarez, P.; Graham, DV; Hevia, E.; Kennedy, AR; Klett, J.; Mulvey, RE; O'Hara, CT; Weatherstone, S. (2008). 「TMP活性ハウザー塩基およびターボハウザー塩基の代表的構造の解明」Angew. Chem. Int. Ed. 47 (42): 8079– 8081. doi : 10.1002/anie.200802618 . PMID 18677732.
- ^ Yang, K.-C.; Chang, C.-C.; Huang, J.-Y.; Lin, C.-C.; Lee, G.-H.; Wang, Y.; Chiang, MY (2002). 「アルキル、アルキニル、アルコキソ、ハロマグネシウムアミドの合成、特性評価および結晶構造」(PDF) . J. Organomet. Chem. 648 ( 1– 2): 176– 187. doi :10.1016/S0022-328X(01)01468-1.
- ^ Batsanov, AS; Bolton, PD; Copley, RCB; Davidson, MG; Howard, JAK; Lustig, C.; Price, RD (1998). 「塩化エチルマグネシウムによるイミノ(トリフェニル)ホスホランのメタル化:[Ph 3 P=NMgCl·O=P(NMe 2 ) 3 ] 2の合成、単離およびX線構造」. J. Organomet. Chem. 550 ( 1– 2): 445– 448. doi :10.1016/S0022-328X(97)00550-0.
- ^ Armstrong DR; García–Álvarez, P.; Kennedy, AR; Mulvey, RE; Parkinson, JA (2010). 「ジイソプロピルアミドとTMPターボグリニャール試薬:その対照的な反応性の構造的根拠」Angew. Chem. Int. Ed. 49 (18): 3185– 3188. doi : 10.1002/anie.201000539 . PMID 20352641.
- ^ Neufeld, R.; Stalke, D. (2015). 「正規化拡散係数を用いた外部検量線を用いたDOSY-NMRによる小分子の正確な分子量測定」. Chem. Sci. 6 (6): 3354– 3364. doi :10.1039/C5SC00670H. PMC 5656982. PMID 29142693 .

- ^ ab Neufeld, R.; Teuteberg, TL; Herbst-Irmer, R.; Mata, RA; Stalke, D. (2016). 「THF中のHauser Base i Pr 2 NMgClおよびTurbo-Hauser Base i Pr 2 NMgCl·LiClの溶液構造とLiClのシュレンク平衡への影響」J. Am. Chem. Soc. 138 (14): 4796– 4806. doi :10.1021/jacs.6b00345. PMID 27011251.
- ^ Eaton, PE; Lee, CH; Xiong, Y. (1989). 「マグネシウムアミド塩基とアミドグリニャール。1. オルトマグネシウム化」. J. Am. Chem. Soc. 138 (20): 8016– 8018. doi :10.1021/ja00202a054.
- ^ Shilai, M.; Kondo, Y.; Sakamoto, T. (2001). 「マグネシウムアミド塩基によるチオフェンおよびチアゾール環の選択的メタル化」. J. Chem. Soc. Perkin Trans. 1 (4): 442– 444. doi :10.1039/B007376H.
- ^ 近藤 雄三; 吉田 明; 坂本 毅 (1996). 「マグネシウムアミド塩基によるインドールのマグネシウム化」. J. Chem. Soc. Perkin Trans. 1 (19): 2331– 2332. doi :10.1039/P19960002331.
- ^ Li-Yuan Bao, Robert; Zhao, Rong; Shi, Lei (2015). 「ターボグリニャール試薬 i-PrMgCl·LiCl の進歩と開発:10年間の歩み」. Chemical Communications . 51 (32): 6884– 6900. doi :10.1039/c4cc10194d. PMID 25714498.



