
セレン化合物は、セレン元素(Se)を含む化合物です。これらの化合物のうち、セレンは様々な酸化状態を持ち、最も一般的なものは-2、+4、+6です。セレン化合物は、自然界ではクロースタライト、グアナファタイト、ティエマンナイト、クルックサイトなどの様々な鉱物の形で存在し、黄鉄鉱や黄銅鉱などの硫化鉱物と共存することもあります。 [1]多くの哺乳類にとって、セレン化合物は不可欠です。例えば、セレノメチオニンとセレノシステインは、人体に存在するセレン含有アミノ酸です。セレノメチオニンは、セレノタンパク質の合成に関与しています。[2]セレノシステインの還元電位とpKa(5.47)はシステインよりも低いため、一部のタンパク質は抗酸化活性を持ちます。[3]セレン化合物は半導体、ガラス・セラミック産業、医療、冶金などの分野で重要な用途がある。[4]
カルコゲン化合物と酸素酸
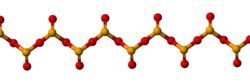
セレンは二酸化セレン(SeO 2)と三酸化セレン(SeO 3 )という2つの酸化物を形成します。二酸化セレンは、元素セレンと酸素の反応によって生成されます。[5]
亜セレン酸は、気相中でモノマーSeO 2分子を形成する高分子固体です。水に溶解すると亜セレン酸(H 2 SeO 3 )を形成します。亜セレン酸は、元素セレンを硝酸で酸化することによって直接生成することもできます。[6]
安定した三酸化物を形成する硫黄とは異なり、三酸化セレンは熱力学的に不安定であり、185℃以上で二酸化物に分解する。[5] [6]
- (ΔH = −54 kJ/モル)
三酸化セレンは、無水 セレン酸カリウム(K 2 SeO 4)と三酸化硫黄(SO 3 )の反応によって実験室で生成される。[7]
亜セレン酸塩は亜セレン酸塩と呼ばれます。これには亜セレン酸銀(Ag 2 SeO 3)や亜セレン酸ナトリウム(Na 2 SeO 3)が含まれます。
硫化水素は亜セレン酸水溶液と反応して二硫化セレンを生成します。
二硫化セレンは8員環から構成されています。SeS 2とほぼ同様の組成を持ちますが、個々の環の組成はSe 4 S 4やSe 2 S 6のように異なります。二硫化セレンは、シャンプーのフケ防止剤、高分子化学の抑制剤、ガラス染料、花火の還元剤として使用されています。[6]
三酸化セレンは、セレン酸H 2 SeO 4を脱水することによって合成することができる。セレン酸H 2 SeO 4自体は、二酸化セレンを過酸化水素で酸化することによって生成される。[8]
高温高濃度のセレン酸は金と反応してセレン酸金(III)を形成する。[9]
ハロゲン化合物
セレンのヨウ化物はあまり知られていない。唯一安定な塩化物は一塩化セレン(Se 2 Cl 2 )であり、これは塩化セレン(I)としてよく知られているかもしれない。対応する臭化物も知られている。これらの種は、対応する二塩化二硫黄と構造的に類似している。二塩化セレンは、セレン化合物(例えばSe 7 )の調製において重要な試薬である。これは、セレンを塩化スルフリル(SO 2 Cl 2)で処理することによって調製される。[10]セレンはフッ素と反応して六フッ化セレンを生成する。
硫黄の類似体(六フッ化硫黄)と比較して、六フッ化セレン(SeF 6)はより反応性が高く、有毒な肺刺激物質である。[11]オキシフッ化セレン(SeOF 2)やオキシ塩化セレン(SeOCl 2 ) などの一部のセレンオキシハロゲン化物は、特殊溶剤として使用されている。[5]
セレン化物
他のカルコゲンと同様に、セレンはセレン化水素(H 2 Se)を形成する。これは強い臭気を放ち、毒性があり、無色の気体である。H 2 Sよりも酸性度が高い。溶液中ではHSe −にイオン化する。セレン化二イオンSe 2−は、セレンが商業的に得られる鉱物を含む様々な化合物を形成する。代表的なセレン化物としては、セレン化水銀(HgSe)、セレン化鉛(PbSe)、セレン化亜鉛(ZnSe)、二セレン化銅インジウムガリウム(Cu(Ga,In)Se 2)などが挙げられる。これらの物質は半導体である。アルミニウムなどの電気陽性率の高い金属と反応すると、これらのセレン化物は加水分解を受けやすい。[5]
アルカリ金属セレン化物はセレンと反応してポリセレン化物(Se)を形成する。2−
n、チェーンとして存在します。
その他の化合物
四窒化セレン(Se 4 N 4 )は、四窒化四硫黄(S 4 N 4 )に類似したオレンジ色の爆発性化合物である。[5] [12] [13]四塩化セレン(SeCl 4)と[((CH
3)
3シ)
2N]
2Se . [14]
セレンはシアン化物と反応してセレノシアン酸塩を生成する:[5]
有機セレン化合物
セレンは、特に酸化状態IIにおいて、炭素と安定な結合を形成し、これは対応する有機硫黄化合物と構造的に類似しています。特に一般的なのは、セレニド(R 2 Se、チオエーテルの類似体)、ジセレニド(R 2 Se 2、ジスルフィドの類似体)、およびセレノール(RSeH、チオールの類似体)です。セレニド、ジセレニド、およびセレノールの代表例としては、それぞれセレノメチオニン、ジフェニルジセレニド、およびベンゼンセレノールが挙げられます。硫黄化学におけるスルホキシドは、セレン化学ではセレノキシド(化学式RSe(O)R)で表され、これは有機合成における中間体であり、セレノキシド脱離反応で示されます。二重結合則によって示される傾向と一致して、セレノケトンR(C=Se)RおよびセレンアルデヒドR(C=Se)Hはほとんど観察されない。[15]
参照
参考文献
- ^ "无上"文明古国:郭实猎笔下の大英、UniSIM Center for Chinese Studies、SIM University、2015 年 3 月、pp. 1–268、doi :10.1142/9789814667227、ISBN 978-981-4667-21-0、 2023年12月1日取得
- ^ Block, Eric; Birringer, Marc; Jiang, Weiqin; Nakahodo, Tsukasa; Thompson, Henry J.; Toscano, Paul J.; Uzar, Horst; Zhang, Xing; Zhu, Zongjian (2001-01-01). 「アリウム化学:Se-アルキル(アルケニル)セレノシステインおよびそのγ-グルタミル誘導体と酸化生成物の合成、天然起源、生物活性、化学」 . Journal of Agricultural and Food Chemistry . 49 (1): 458– 470. Bibcode :2001JAFC...49..458B. doi :10.1021/jf001097b. ISSN 0021-8561. PMID 11305255.
- ^ Byun, Byung Jin; Kang, Young Kee (2011年5月). 「セレノシステイン残基のコンフォメーション選好性とp K a 値」 . Biopolymers . 95 (5): 345– 353. doi :10.1002/bip.21581. ISSN 0006-3525. PMID 21213257.
- ^ "无上"文明古国:郭实猎笔下の大英、UniSIM Center for Chinese Studies、SIM University、2015 年 3 月、pp. 1–268、doi :10.1142/9789814667227、ISBN 978-981-4667-21-0、 2023年12月1日取得
- ^ abcdef House, James E. (2008).無機化学. アカデミック・プレス. p. 524. ISBN 978-0-12-356786-4。
- ^ abc Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001).無機化学. サンディエゴ: Academic Press. p. 583. ISBN 978-0-12-352651-9。
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Chemistry of the Elements (第2版). Butterworth-Heinemann . p. 780. doi :10.1016/C2009-0-30414-6. ISBN 978-0-08-037941-8。
- ^ Seppelt, K.; Desmarteau, Darryl D. (1980). 「セレノニルジフルオリド」.無機合成. 第20巻. pp. 36– 38. doi :10.1002/9780470132517.ch9. ISBN 978-0-471-07715-2。この報告書ではセレン酸の合成について説明します。
- ^ Lenher, V. (1902年4月). 「セレン酸の金に対する作用」.アメリカ化学会誌. 24 (4): 354– 355. Bibcode :1902JAChS..24..354L. doi :10.1021/ja02018a005.
- ^ Xu, Zhengtao (2007). Devillanova, Francesco A. (編).カルコゲン化学ハンドブック:硫黄、セレン、テルルにおける新たな展望. 英国王立化学協会. p. 460. ISBN 978-0-85404-366-8。
- ^ プロクター、ニック・H.、ハサウェイ、グロリア・J. (2004). ヒューズ、ジェームズ・P. (編).プロクターとヒューズの職場における化学的危険性(第5版). Wiley-IEEE. p. 625. ISBN 978-0-471-26883-3。
- ^ Woollins, Derek; Kelly, Paul F. (1993). 「 液体アンモニア中におけるSe 4 N 4の反応性」. Polyhedron . 12 (10): 1129– 1133. doi :10.1016/S0277-5387(00)88201-7.
- ^ Kelly, PF; Slawin, AMZ; Soriano-Rama, A. (1997). 「Se 4 N 4およびSe(NSO) 2を用いた二窒化二セレンSe 2 N 2のパラジウム付加物の調製;[PPh
4]
2[Pd
2Br
6(セ
2北
2)] ". Dalton Transactions (4): 559– 562. doi :10.1039/a606311j. - ^ Siivari, Jari; Chivers, Tristram; Laitinen, Risto S. (1993). 「四窒化テトラセレンの簡便かつ効率的な合成」.無機化学. 32 (8): 1519– 1520. doi :10.1021/ic00060a031.
- ^ アーカー、G.;ホック、R.クルーガー、C.ヴェルナー、S.フロリダ州クラーナー; Artschwager-Perl、U. (1990)。 「モノマーセレノベンゾフェノンの合成と付加環化」。英語版のAngewandte Chemie国際版。29 (9): 1067–1068。土井:10.1002/anie.199010671。
![{\displaystyle {\mathrm {Se} {\vphantom {A}}_{\smash[{t}]{8}}{}+{}8\,\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}8\,\mathrm {SeO} {\vphantom {A}}_{\smash[{t}]{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ac74fa6f47ce5a408152c5ab340c75d8e7b27a94)
![{\displaystyle {3\,\mathrm {Se} {}+{}4\,\mathrm {HNO} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SeO} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}4\,\mathrm {NO} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8ad14ddaa6593b29471f315f7894df4b34d43457)
![{\displaystyle {2\,\mathrm {SeO} {\vphantom {A}}_{\smash[{t}]{3}}{}\mathrel {\longrightarrow } {}2\,\mathrm {SeO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e6f5e5c400494092efbd6d7bcae61f0d53dfe252)
![{\displaystyle {\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SeO} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {S} {}\mathrel {\longrightarrow } {}\mathrm {SeS} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1430ac3257a8a2e10209f0d7b5a7cc0c3f92880b)
![{\displaystyle {\mathrm {SeO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SeO} {\vphantom {A}}_{\smash[{t}]{4}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d6cef154e9e980e3616673a5bb9fb1f39fd24bed)
![{\displaystyle {\mathrm {Se} {\vphantom {A}}_{\smash[{t}]{8}}{}+{}24\,\mathrm {F} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}8\,\mathrm {SeF} {\vphantom {A}}_{\smash[{t}]{6}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8a14c7eb2f6e30d3bf46779f5d96de679648cd30)
![{\displaystyle {\mathrm {Al} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Se} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {Al} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {Se} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/073c833a39a05754916b07a4d5dd7793c0a41638)
![{\displaystyle {8\,\mathrm {KCN} {}+{}\mathrm {Se} {\vphantom {A}}_{\smash[{t}]{8}}{}\mathrel {\longrightarrow } {}8\,\mathrm {KSeCN} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c62f6c5f9a1d2a7cbfe30f1519a42daf19ad596f)