 | |
 | |
| 臨床データ | |
|---|---|
| 商号 | サフリス、シクレスト、セクアド |
| その他の名前 | ORG-5222 |
| AHFS / Drugs.com | モノグラフ |
| メドラインプラス | a610015 |
| ライセンスデータ | |
| 妊娠 カテゴリー |
|
投与経路 | 舌下、経皮 |
| 薬物クラス | 非定型抗精神病薬 |
| ATCコード |
|
| 法的地位 | |
| 法的地位 | |
| 薬物動態データ | |
| バイオアベイラビリティ | 35%(舌下)、<2%(経口)[4] [5] [2] [6]経皮バイオアベイラビリティは舌下より有意に高い[7] [8] |
| タンパク質結合 | 95% [4] [5] [2] [6] |
| 代謝 | 肝臓(UGT1A4によるグルクリン酸化とCYP1A2による酸化代謝)[4] [5] [2] [6] |
| 消失半減期 | 24時間(舌下)[4] [5] [2] [6] 30時間(経皮)[7] 33.9時間(経皮)[8] |
| 排泄 | 腎臓(50%)、糞便(40%;糞便中の未変化体薬物は約5~16%)[4] [5] [2] [6] |
| 識別子 | |
| |
| CAS番号 | |
| PubChem CID |
|
| IUPHAR/BPS |
|
| ドラッグバンク |
|
| ケムスパイダー | |
| ユニイ |
|
| ケッグ |
|
| チェビ | |
| チェムブル | |
| ECHA 情報カード | 100.059.828 |
| 化学および物理データ | |
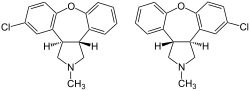
| 式 | C 17 H 16 Cl N O |
| モル質量 | 285.77 g·mol −1 |
| 3Dモデル(JSmol) |
|
| |
| |
 N N Y (これは何ですか?)(確認) Y (これは何ですか?)(確認) | |
アセナピンは、サフリスなどのブランド名で販売されており、統合失調症や双極性障害に伴う急性躁病の治療、および双極性障害の中期から長期の管理に使用される非定型抗精神病薬です。[3] [9]
これは、四環系(非定型)抗うつ薬であるミアンセリンの化学構造を変化させることによって化学的に誘導されたものである。[10]
米国では2009年に初めて承認され[11] 、 2020年にジェネリック医薬品として承認されました。 [12]
医療用途
アセナピンは、FDAによって統合失調症の成人の急性治療、および精神病的特徴の有無にかかわらず双極性I型障害に伴う躁病エピソードまたは混合エピソードの成人の急性治療に承認されています。 [11]オーストラリアでは、アセナピンの承認された( PBSにも記載されている)適応症は次のとおりです。[13]
- 統合失調症
- 双極性I型障害に伴う急性躁病エピソードまたは混合エピソードの治療(最大6ヶ月間)
- 双極性I型障害の維持療法(単剤療法)
欧州連合および英国では、アセナピンは双極性I型障害の急性躁病の治療薬としてのみ承認されている。[2] [6] [3]
アセナピンは舌下投与すると速やかに吸収されるが、飲み込んだ場合には吸収されにくい。[14]アセナピンの経皮製剤は、2019年10月に米国でセクアドというブランド名で承認された。[7]
統合失調症
コクランの 体系的レビューでは、アセナピンが陽性症状、陰性症状、うつ症状を改善するという予備的な証拠はあるものの、統合失調症の治療にアセナピンを推奨するだけの十分な研究結果は得られていないことが判明した。[15]
双極性障害
双極性障害のうつ病と躁病の両方の特徴の中期および長期の管理と制御において、アセナピンはオランザピンと同等の効果があるが、副作用プロファイルが大幅に優れていることが判明した。[9]
急性躁病において、アセナピンはプラセボよりも有意に優れていることが示された。[9]急性躁病治療における有効性に関しては、最近のメタアナリシスで、急性躁病および混合エピソードの患者における躁症状の改善は、リスペリドンやオランザピン(ジプラシドンを除く)などの他のほとんどの抗精神病薬と比較して比較的小さいことが示された。アセナピンの脱落率(臨床試験)も異常に高かった。[16] 2つの3週間臨床試験の事後解析によると、急性躁病または混合エピソードの患者において、アセナピンはある程度の抗うつ効果を有する可能性がある。[17]
副作用
副作用発現率[4] [5] [2] [6]
非常に一般的な(発生率 10% 以上)副作用には次のようなものがあります。
一般的な(発生率1~10%)副作用は次のとおりです。
- 体重増加†
- 食欲増加
- 錐体外路症状(EPS;ジストニア、アカシジア、ジスキネジア、筋強剛、パーキンソン症候群など)
- 鎮静
- めまい
- 味覚異常(味覚の変化)
- 口腔知覚低下(しびれ)は舌下投与時のみに起こる。経皮投与のアセナピンはこの副作用を排除することが示された。[7]
- アラニンアミノトランスフェラーゼの増加
- 消化不良、胃の不快感、および/または嘔吐[a]
- 倦怠感
まれな(発生率0.1~1%)副作用としては以下が挙げられます。
- 高血糖— 血糖値(糖分)の上昇
- 失神
- 発作
- 構音障害
- 洞性徐脈
- 脚ブロック
- QTc間隔延長(QTc間隔延長を引き起こすリスクは比較的低い。[18] [19])
- 洞性頻脈
- 起立性低血圧
- 低血圧
- 舌の腫れ
- 嚥下障害(飲み込み困難)
- 舌痛症
- 口腔知覚異常
まれな(発生率0.01~0.1%)副作用としては以下が挙げられます。
- 神経遮断薬による悪性症候群(発熱、筋肉の硬直、呼吸の速まり、発汗、意識の低下、血圧と心拍数の急激な変化の組み合わせ)
- 遅発性ジスキネジア
- 言語障害
- 横紋筋融解症
- 血管性浮腫
- 無顆粒球症、白血球減少症、好中球減少症などの血液疾患
- 調節障害[説明が必要]
- 肺塞栓症
- 女性化乳房
- 乳汁漏出症
発生率不明の副作用
- アレルギー反応
- むずむず脚症候群
- 口腔粘膜病変(潰瘍、水疱、炎症)
- 唾液過剰分泌
- 高プロラクチン血症
†アセナピンは、代謝性副作用で悪名高い非定型抗精神病薬としては比較的体重増加傾向が低いようで、2013年のメタアナリシスでは、パリペリドン(SMD:0.38、95 %CI:0.27-0.48)、リスペリドン(SMD:0.42、95%CI:0.33-0.50)、クエチアピン(SMD:0.43、95%CI:0.34-0.53)、セルチンドール( SMD:0.53、95%CI:0.38-0.68)、クロルプロマジン(SMD: 0.55; 95% CI: 0.34-0.76)、イロペリドン(SMD: 0.62; 95% CI: 0.49-0.74)、クロザピン(SMD: 0.65; 95% CI: 0.31-0.99)、ゾテピン(SMD: 0.71; 95% CI: 0.47-0.96)、オランザピン(SMD: 0.74; 95% CI: 0.67-0.81 )、およびアリピプラゾール( SMD : 0.17 ; 95% CI: 0.05-0.28)、ルラシドン(SMD: 0.10; 95% CI: (SMD : –0.02-0.21)、アミスルプリド(SMD: 0.20; 95% CI: 0.05-0.35)、ハロペリドール(SMD: 0.09; 95% CI: 0.00-0.17)、ジプラシドン(SMD: 0.10; 95% CI: –0.02-0.22)であった。[20]このメタアナリシスによると、血漿プロラクチン値を上昇させる可能性も比較的限られているようだ。[20]このメタアナリシスでは、アセナピンがプラセボ投与患者と比較して鎮静を引き起こすオッズ比(3.28; 95% CI: 1.37-6.69)はオランザピン(3.34; 95% CI: 2.46-4.50)やハロペリドール(2.76; 95% CI: 2.04-3.66)とほぼ同じであり、鎮静のオッズ比はアリピプラゾール(1.84; 95% CI: 1.05-3.05)、パリペリドン(1.40; 95% CI: 0.85-2.19)、アミスルプリド(1.42; 95% CI: 0.72-2.51)などよりも高い(ただし有意ではない)ため、軽度から中等度の鎮静作用を持つ抗精神病薬である。[20]同じメタアナリシスでは、アセナピンは他の非定型抗精神病薬と比較して錐体外路症状のリスクが比較的高いが、第一世代や定型抗精神病薬よりもリスクが低いことが示唆された。[20]
中止
英国国立処方集(National Formulary)では、すべての抗精神病薬について、急性離脱症候群や急速な再発を避けるため、服用を中止する際には徐々に用量を減らすことを推奨しています。[21]離脱症状としては、一般的に吐き気、嘔吐、食欲不振などが挙げられます。[22]その他の症状としては、落ち着きのなさ、発汗の増加、睡眠障害などが挙げられます。[22]まれに、世界が回転するような感覚、しびれ、筋肉痛などの症状が現れることもあります。[22]症状は通常、短期間で解消されます。[22]
抗精神病薬の投与中止により、一時的な離脱症状として精神病が発現する可能性があるという暫定的な証拠がある。[23]また、治療中の症状が再発することもある。[24]まれに、薬の投与中止時に遅発性ジスキネジアが発現することがある。[22]
薬理学
薬力学
| サイト | pK i | K i (nM) | アクション |
|---|---|---|---|
| 5-HT 1A | 8.6 | 2.5 | 部分作動薬 |
| 5-HT 1B | 8.4 | 4.0 | 敵対者 |
| 5-HT 2A | 10.2 | 0.06 | 敵対者 |
| 5-HT 2B | 9.8 | 0.16 | 敵対者 |
| 5-HT 2C | 10.5 | 0.03 | 敵対者 |
| 5-HT 5A | 8.8 | 1.6 | 敵対者 |
| 5-HT 6 | 9.5 | 0.25 | 敵対者 |
| 5-HT 7 | 9.9 | 0.13 | 敵対者 |
| α 1 | 8.9 | 1.2 | 敵対者 |
| α 2A | 8.9 | 1.2 | 敵対者 |
| α 2B | 9.5 | 0.32 | 敵対者 |
| α 2C | 8.9 | 1.2 | 敵対者 |
| D1 | 8.9 | 1.4 | 敵対者 |
| D2 | 8.9 | 1.3 | 敵対者 |
| D3 | 9.4 | 0.42 | 敵対者 |
| D4 | 9.0 | 1.1 | 敵対者 |
| H1 | 9.0 | 1.0 | 敵対者 |
| H2 | 8.2 | 6.2 | 敵対者 |
| mACh | <5 | 8128 | 敵対者 |
アセナピンは、セロトニン5 -HT 1A (8.6)、 5-HT 1B (8.4 ) 、 5-HT 2A (10.2)、5-HT 2B ( 9.8)、5-HT 2C (10.5)、5-HT 5A (8.8 ) 、 5-HT 6 (9.5) 、および5-HT 7 ( 9.9 ) 受容体、アドレナリンα 1 ( 8.9 )、α 2A (8.9)、α 2B (9.5)、および α 2C (8.9) 受容体、ドーパミン D 1 (8.9) 、D 2 ( 8.9 )、 D 3 ( 9.4)、およびD 4 (9.0)受容体、ヒスタミンH 1 (9.0) およびH 2 (8.2) 受容体を含む多数の受容体に対して高い親和性 (pKi)を示します。ムスカリン性アセチルコリン受容体に対する親和性は非常に低い(pKi < 5) 。アセナピンは5-HT 1A受容体に対して部分作動薬として作用する。[26]その他の標的に対してはアセナピンは拮抗薬として作用する。[25]
アセナピンは、他の非定型抗精神病薬と比較しても、5-HT 2A、5-HT 2C、5-HT 6、5 - HT 7受容体に対する親和性が異常に高く、 α 2受容体とH 1受容体に対する親和性も非常に高い。[25]
注記
- ^ 米国FDA承認取得のための第III相試験では、「誘発副作用」リストが用いられ、被験者全員にリストに記載されている副作用について質問したが、「吐き気」は含まれていなかった。誘発副作用リストには、「消化不良」、「胃部不快感」、「嘔吐」といった関連症状が含まれており、それぞれの発現率はプラセボよりも高く、アセナピン投与群の1~10%であった。[5]
参考文献
- ^ アンビサ(2023-03-31). 「RDC No. 784 - Listas de Substâncias Entorpecentes、Psicotropicas、Precursoras e Outras sob Controle Especial」[大学理事会決議 No. 784 - 特別管理下の麻薬、向精神薬、前駆体、およびその他の物質のリスト] (ブラジルポルトガル語)。Diário Oficial da União (2023-04-04 公開)。 2023-08-03 のオリジナルからアーカイブされました。2023-08-16に取得。
- ^ abcdefgh 「Sycrest 5mg舌下錠 - 製品特性概要(SmPC)」(emc) . 2020年9月9日閲覧。
- ^ abc 「Sycrest EPAR」.欧州医薬品庁(EMA) . 2018年9月17日. 2020年9月9日閲覧。
- ^ abcdef 「サフリス(マレイン酸アセナピン)製品情報」(PDF) . TGA eBusiness Services . Merck Sharp & Dohme (Australia) Pty Limited. 2013年1月14日. 2013年10月23日閲覧。
- ^ abcdefg 「サフリス(マレイン酸アセナピン)錠」.デイリーメッド。オルガノン製薬。 2013 年 3 月。2013 年10 月 23 日に取得。
- ^ abcdefg 「Sycrest製品情報 – EMEA/H/C/001177 –II/0012」(PDF) .欧州医薬品庁. NV Organon. 2013年2月21日. 2017年7月28日時点のオリジナル(PDF)からアーカイブ。 2013年10月23日閲覧。
- ^ abcd Carrithers B, El-Mallakh RS (2020年3月18日). 「統合失調症における経皮アセナピン:系統的レビュー」.患者の嗜好と遵守. 14 : 1541–1551 . doi : 10.2147/PPA.S235104 . PMC 7468370. PMID 32943849 .
- ^ ab Suzuki K, Castelli M, Komaroff M, Starling B, Terahara T, Citrome L (2021-03-16). 「アセナピン経皮吸収型製剤(HP-3070)の薬物動態プロファイル」. Journal of Clinical Psychopharmacology . 41 (3): 286– 294. doi :10.1097/JCP.0000000000001383. PMC 8083160. PMID 33734167 .
- ^ abc Vita A, De Peri L, Siracusano A, Sacchetti E (2013年9月). 「双極性I型障害における急性躁病に対するアセナピンの有効性と忍容性:ランダム化比較試験のメタアナリシス」. International Clinical Psychopharmacology . 28 (5): 219– 227. doi :10.1097/YIC.0b013e32836290d2. PMID 23719049. S2CID 20871442.
- ^ Minassian A, Young JW (2010年8月). 「統合失調症におけるアセナピンの臨床効果の評価」.薬物療法に関する専門家の意見. 11 (12): 2107– 2115. doi :10.1517/14656566.2010.506188. PMC 2924192. PMID 20642375 .
- ^ abc 「Saphris(アセナピン)の処方情報」(PDF) . Schering Corporation. 2009年8月1日. 2009年11月22日時点のオリジナル(PDF)からアーカイブ。 2009年9月5日閲覧。
- ^ 「ジェネリック医薬品の初承認」米国食品医薬品局(FDA)2021年2月13日閲覧。
- ^ Rossi, S. 編 (2013).オーストラリア医薬品ハンドブック(2013年版). アデレード: オーストラリア医薬品ハンドブックユニットトラスト. ISBN 978-0-9805790-9-3。
- ^ Stoner SC, Pace HA (2012年5月). 「アセナピン:第二世代抗精神病薬の臨床レビュー」. Clinical Therapeutics . 34 (5): 1023– 1040. doi :10.1016/j.clinthera.2012.03.002. PMID 22494521.
- ^ Hay A, Byers A, Sereno M, Basra MK, Dutta S (2015年11月). 「統合失調症に対するアセナピンとプラセボの比較」.コクラン・システマティック・レビュー・データベース. 2015 (11) CD011458. doi :10.1002/14651858.CD011458.pub2. PMC 6464872. PMID 26599405 .
- ^ Cipriani A, Barbui C, Salanti G, Rendell J, Brown R, Stockton S, 他 (2011年10月). 「急性躁病における抗躁薬の有効性と受容性の比較:複数治療メタアナリシス」Lancet . 378 (9799): 1306– 1315. doi :10.1016/S0140-6736(11)60873-8. PMID 21851976. S2CID 25512763.
- ^ Szegedi A, Zhao J, van Willigenburg A, Nations KR, Mackle M, Panagides J (2011年6月). 「急性躁病エピソードまたは混合エピソードを経験している双極性I型障害患者におけるアセナピンの抑うつ症状への効果:2つの3週間臨床試験の事後解析」. BMC Psychiatry . 11 : 101. doi : 10.1186/1471-244X-11-101 . PMC 3152513. PMID 21689438 .
- ^ Washington NB, Brahm NC, Kissack J (2012年10月). 「どの向精神薬がQTc延長のリスクが最も高いのか?」Current Psychiatry . 11 (10): 36– 39 . 2017年4月14日閲覧。
- ^ Taylor D, Paton C, Shitij K (2012).精神医学におけるモーズリー処方ガイドライン. ウェスト・サセックス: Wiley-Blackwell. ISBN 978-0-470-97948-8。
- ^ abcd Leucht S, Cipriani A, Spineli L, Mavridis D, Orey D, Richter F, et al. (2013年9月). 「統合失調症における15種類の抗精神病薬の有効性と忍容性の比較:多剤併用メタアナリシス」. Lancet . 382 (9896): 951– 962. doi :10.1016/S0140-6736(13)60733-3. PMID 23810019. S2CID 32085212.
- ^ Joint Formulary Committee B編(2009年3月)「4.2.1」英国国民処方集(第57版)英国王立薬剤師会、192頁。ISBN 978-0-85369-845-6
長期治療後の抗精神病薬の離脱は、急性離脱症候群や急速な再発のリスクを避けるために、常に段階的に行い、綿密に監視する必要があります
。 - ^ abcde Haddad P, Haddad PM, Dursun S, Deakin B (2004). 精神科薬物の有害症候群と臨床ガイド. OUP Oxford. pp. 207– 216. ISBN 978-0-19-852748-0。
- ^ Moncrieff J (2006年7月). 「抗精神病薬の離脱は精神病を誘発するのか? 急速発症精神病(過敏性精神病)と離脱関連再発に関する文献レビュー」Acta Psychiatrica Scandinavica 114 ( 1): 3– 13. doi :10.1111/j.1600-0447.2006.00787.x. PMID 16774655. S2CID 6267180.
- ^ Sacchetti E, Vita A, Siracusano A, Fleischhacker W (2013). 統合失調症における抗精神病薬の服薬アドヒアランス. Springer Science & Business Media. p. 85. ISBN 978-88-470-2679-7。
- ^ abc Shahid M, Walker GB, Zorn SH, Wong EH (2009年1月). 「アセナピン:ユニークなヒト受容体シグネチャーを持つ新規精神薬理学的薬剤」. Journal of Psychopharmacology . 23 (1): 65– 73. doi :10.1177/0269881107082944. PMID 18308814. S2CID 206489515.
- ^ Ghanbari R, El Mansari M, Shahid M, Blier P (2009年3月). 「ラット脳におけるアセナピンの5-HT(1A), 5-HT(2A), α(2)アドレナリンおよびD(2)受容体への作用の電気生理学的特徴づけ」. European Neuropsychopharmacology . 19 (3): 177– 187. doi :10.1016/j.euroneuro.2008.11.001. PMID 19116183. S2CID 140204044.
外部リンク
- 「アセナピン」。薬物情報ポータル。米国国立医学図書館。2017年1月24日時点のオリジナルよりアーカイブ。
- 「マレイン酸アセナピン」。薬物情報ポータル。米国国立医学図書館。2021年10月17日時点のオリジナルよりアーカイブ。
