| |||
| |||
| 名称 | |||
|---|---|---|---|
| 推奨IUPAC名
グアニジン[1] | |||
| その他の名称
イミノメタンジアミン、カルバミミドアミド
| |||
| 識別子 | |||
3Dモデル ( JSmol )
|
| ||
| 506044 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA情報カード | 100.003.656 | ||
| EC Number |
| ||
| 100679 | |||
| |||
| MeSH | グアニジン | ||
PubChem CID
|
| ||
| UNII | |||
CompTox Dashboard ( EPA )
|
| ||
| |||
| Properties | |||
| C H 5 N 3 | |||
| モル質量 | 59.072 g·mol −1 | ||
| 融点 | 50℃ (122°F; 323 K) | ||
| log P | −1.251 | ||
| 塩基度(p K b ) | 0.4 [2] | ||
| 共役酸 | グアニジニウム | ||
| 熱化学 | |||
標準生成エンタルピー (Δ f H ⦵ 298 ) |
−57 – −55 kJ/mol | ||
標準
燃焼エンタルピー (Δ c H ⦵ 298 ) |
−1.0511 – −1.0531 MJ/mol | ||
| 薬理学 | |||
| 薬物動態 | |||
| 7~8時間 | |||
| 危険性 | |||
| 致死量または濃度 (LD、LC) | |||
LD50 (中間用量)
|
475 mg/kg(経口、ラット)[3] | ||
| 関連化合物 | |||
関連化合物
|
|||
特に記載がない限り、データは標準状態(25℃ [77℉]、100kPa)における物質について示されています。
| |||
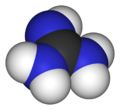
グアニジンは、化学式HNC(NH2)2で表される化合物です。無色の固体で、極性溶媒に溶解します。プラスチックや爆薬の製造に使用される強塩基です。主に腎不全患者の尿中に存在します。[4]グアニジン部分は、アルギニンの側鎖を含む、より大きな有機分子にも存在します。
構造
グアニジンは炭酸の窒素類似体と考えることができます。つまり、炭酸のC=O基はC=NH基に置き換えられ、各OHはNH
2基に置き換えられています。[5]グアニジンの詳細な結晶構造解析は、分子の単純さにもかかわらず、最初の合成から148年後に解明されました。[6] 2013年には、単結晶中性子回折を用いて、水素原子の位置とそれらの変位パラメータが正確に決定されました。[7]
製造
グアニジンは天然資源から得ることができ、1861年にアドルフ・ストレッカーによってペルーのグアノから単離された芳香族天然物であるグアニンの酸化分解によって初めて単離されました。[8] [9]
グアニジンを製造する実験室的な方法は、無水条件下での 乾燥チオシアン酸アンモニウムの穏やかな(180~190℃)熱分解です
- 3NH4SCN → 2CH5N3 + H2S + CS2
商業的な製造方法は、ジシアンジアミドとアンモニウム塩の反応から始まる2段階のプロセスです。ビグアニジンを介したこのアンモノリシス工程により、グアニジニウムカチオンの塩が得られます(下記参照)。第2段階では、この塩をメトキシドナトリウムなどの塩基で処理します。[8]
イソチオウロニウム塩(S-アルキル化チオ尿素)はアミンと反応してグアニジニウム塩を与えます。[10]
- RNH2 + [CH3SC(NH2)2]+X− → [RN(H)C(NH2)2]+X− + CH3SH
The resulting guanidinium ions can often be deprotonated to give the guanidine. This approach is sometimes called the Rathke synthesis, in honor of its discoverer Bernhard Rathke.[11][12]
Chemistry
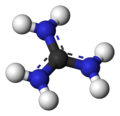
Guanidinium cation
The conjugate acid is called the guanidinium cation, (C(NH
2)+
3). This planar, symmetric ion consists of three amino groups each bonded to the central carbon atom with a covalent bond of order 4/3. It is a highly stable +1 cation in aqueous solution due to the efficient resonance stabilization of the charge and efficient solvation by water molecules. As a result, its pKaH is 13.6[2] (pKb of 0.4) meaning that guanidine is a very strong base in water; in neutral water, it exists almost exclusively as guanidinium. Due to this, most guanidine derivatives are salts containing the conjugate acid.
-
canonical forms
Testing
Guanidine can be selectively detected using sodium 1,2-naphthoquinone-4-sulfonic acid (Folin's reagent) and acidified urea.[13]
Uses
Industry
The main salt of commercial interest is the nitrate [C(NH
2)3]NO
3. It is used as a propellant, for example in air bags.
Medicine
Since the Middle Ages in Europe, guanidine has been used to treat diabetes as the active antihyperglycemic ingredient in French lilac. Due to its long-term hepatotoxicity, further research for blood sugar control was suspended at first after the discovery of insulin. Later development of nontoxic, safe biguanides led to the long-used first-line diabetes control medicine metformin, introduced to Europe in the 1950s & United States in 1995 and now prescribed to over 17 million patients per year in the US.[14][15]
Guanidinium chloride[14] is a now-controversial adjuvant in treatment of botulism. Recent studies have shown some significant subsets of patients who see no improvement after the administration of this drug.[16]
Biochemistry
Guanidine exists protonated, as guanidinium, in solution at physiological pH.
塩化グアニジニウム(グアニジン塩酸塩とも呼ばれる)はカオトロピック特性を持ち、タンパク質の変性に使用されます。塩化グアニジニウムは、濃度とタンパク質の変性自由エネルギーの間に直線関係があることが知られています。6Mの塩化グアニジニウムを含む水溶液では 、ほぼすべてのタンパク質が二次構造全体を失い、ランダムコイル状のペプチド鎖になります。チオシアン酸グアニジニウムも、様々な生物学的サンプルに対する変性効果を目的として使用されます
最近の研究では、グアニジニウムは細菌によって毒性のある副産物として生成されることが示唆されています。グアニジニウムの毒性を軽減するために、細菌はグアニジニウム排出体またはGdxタンパク質として知られる輸送体の一種を開発し、このイオンの余分な量を細胞外に排出しています。[17] Gdxタンパク質は、グアニジニウムおよび一置換グアニジニル化合物に対して高い選択性を示し、薬物排出体EmrEと重複する非標準的な基質セットを共有しています。[18]
その他
水酸化グアニジニウムは、一部の非苛性ソーダ系ヘアリラクサーの有効成分です。
グアニジン誘導体

グアニジンは、一般構造(R
1R
2N)(R
3R
4N)C=N−R
5 を持つこの基の中心結合はイミンであり、構造的にはアミジンおよび尿素と関連しています。グアニジンの例としては、アルギニン、トリアザビシクロデセン、サキシトキシン、クレアチンなどがあります。
参照
参考文献
- ^ 国際純正応用化学連合(2014).有機化学命名法:IUPAC勧告および推奨名2013.王立化学協会. p. 883. doi :10.1039/9781849733069. ISBN 978-0-85404-182-4。
- ^ ab Perrin DD (1972).水溶液中の有機塩基の解離定数(補遺版). ロンドン: バターワース
- ^ 「グアニジン塩酸塩」. ChemIDplus .国立医学図書館. 2014年8月12日時点のオリジナルよりアーカイブ。2014年8月10日閲覧
- ^ Sawynok J, Dawborn JK (1975). 「正常被験者および腎不全患者におけるグアニジン誘導体の血漿濃度と尿中排泄」. Clinical and Experimental Pharmacology & Physiology . 2 (1): 1– 15. doi :10.1111/j.1440-1681.1975.tb02368.x. PMID 1126056. S2CID 41794868.
- ^ Göbel M, Klapötke TM (2007年8月). 「グアニジンHN=C(NH(2))(2) の初めての構造解析」. Chemical Communications . 43 (30): 3180– 3182. doi :10.1039/B705100J. PMID 17653381.
- ^ Yamada T, Liu X, Englert U, Yamane H, Dronskowski R (2009年6月). 「ついに遊離塩基グアニジンの固体構造が解明」. Chemistry: A European Journal . 15 (23): 5651– 5655. doi :10.1002/chem.200900508. PMID 19388036
- ^ Sawinski PK, Meven M, Englert U, Dronskowski R (2013). 「グアニジンCN3H5の単結晶中性子回折研究」. Crystal Growth & Design . 13 (4): 1730–5 . doi : 10.1021/cg400054k .
- ^ ab Güthner T, Mertschenk B, Schulz B. 「グアニジンとその誘導体」. Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi :10.1002/14356007.a12_545.pub2. ISBN 978-3-527-30673-2。
- ^ Strecker A (1861). 「グアニン、キサンチン、テオブロミン、カフェイン、クレアチニンの化学的関係に関する研究」[グアニン、キサンチン、テオブロミン、カフェイン、クレアチニンの化学的関係に関する研究] Liebigs Ann. Chem . 118 (2): 151– 177. doi :10.1002/jlac.18611180203. 2021年7月16日時点のオリジナルよりアーカイブ。2019年7月2日閲覧
- ^ パーマー、デイビッド・C. (2001). 「S-メチルイソチオ尿素」. E-EROS有機合成試薬百科事典. doi :10.1002/047084289X.rm199s. ISBN 0471936235。
- ^ “ハインリヒ・ベルンハルト・ラトケ (1840-1923)”. Berichte der Deutschen Chemischen Gesellschaft (A および B シリーズ)。57 (9): A83 – A92。 1924 年 10 月 8 日。doi : 10.1002 /cber.19240570929。
- ^ Rathke, B. (1881年7月). 「シュウェフェルハルンストフスの誘導体と組成」.ドイツ化学協会報. 14 (2): 1774– 1780. doi :10.1002/cber.18810140247.
- ^ Sullivan MX (1935年10月1日). 「グアニジンの比色試験」.実験生物学医学会紀要. 33 (1): 106– 108. doi :10.3181/00379727-33-8270C. ISSN 0037-9727. S2CID 88290359
- ^ ab Blaslov K, Naranđa FS, Kruljac I, Renar IP (2018年12月). 「2型糖尿病への治療アプローチ:過去、現在、そして未来」. World Journal of Diabetes . 9 (12): 209–219 . doi : 10.4239 /wjd.v9.i12.209 . PMC 6304295. PMID 30588282.
- ^ 「2019年のトップ300」. clincalc.com . 2021年2月12日時点のオリジナルからのアーカイブ。 2022年2月17日閲覧。
- ^ Brook I (2001).小児嫌気性感染症:診断と管理(第3版). Taylor & Francis. p. 529. ISBN 0824741862。
- ^ Kermani AA、Macdonald CB、Gundepudi R、Stockbridge RB(2018年3月)。「グアニジニウムの輸出はSMRファミリートランスポーターの主要な機能である」。米国 科学アカデミー紀要。115 ( 12 ): 3060–3065。書誌コード: 2018PNAS..115.3060K。doi : 10.1073/ pnas.1719187115。PMC 5866581。PMID 29507227
- ^ Kermani AA、Macdonald CB、Burata OE、Ben Koff B、Koide A、Denbaum E、他 (2020年11月). 「小型多剤耐性トランスポーターにおける乱交性の構造的基盤」. Nature Communications . 11 (1): 6064. Bibcode :2020NatCo..11.6064K. doi :10.1038/s41467-020-19820-8 . PMC 7695847. PMID 33247110
- ^ Witters LA (2001年10月). 「フレンチライラックの開花」. The Journal of Clinical Investigation . 108 (8): 1105–1107 . doi :10.1172/JCI14178. PMC 209536. PMID 11602616.