ヒドロシランは、1つ以上のSi-H結合を含む四価ケイ素化合物です。親ヒドロシランはシラン(SiH 4 )です。一般的に、ヒドロシランは有機ケイ素誘導体を指します。例としては、フェニルシラン(PhSiH 3)やトリエトキシシラン((C 2 H 5 O) 3 SiH)などがあります。ヒドロシランを末端基とするポリマーやオリゴマーは樹脂であり、コーキング材などの有用材料の製造に用いられます。
合成
トリクロロシランは、塩化水素とシリコン の反応によって商業的に生産されます。
- Si + 3 HCl → HSiCl 3 + H 2
多くのアルコキシヒドロシランは、トリクロロシランのアルコール分解によって生成されます。一例として、トリエトキシシランが挙げられます。
- HSiCl 3 + 3 EtOH → HSi(OEt) 3 + 3 HCl
オルガノヒドロシランはシラン自体の 部分的なヒドロシリル化によって製造できる。
- SiH 4 + 3 C 2 H 4 → HSi(C 2 H 5 ) 3
実験室では、ヒドロシランは典型的にはクロロシランを水素化アルミニウムリチウムなどの水素化物試薬で処理することによって製造されます。
- 4 ClSi(C 2 H 5 ) 3 + LiAlH 4 → 4 HSi(C 2 H 5 ) 3 + LiAlCl 4
構造
ケイ素-水素結合はC-H結合よりも長く(148 pmに対して105 pm)、Si-H結合はC-H結合に比べて約10%弱い。
| ボンド | D (kJ/モル, 298K) |
|---|---|
| H 3 C-H | 441 |
| H 3 Si-H | 384 |
| (CH 3 ) 3 C-H | 404 |
| (CH 3 ) 3 Si-H | 397 |
| ((CH 3 ) 3 Si) 3 Si-H | 351 |
水素はケイ素よりも電気陰性度が高い(これがシリルヒドリドの命名規則である)。そのため、Si-H結合の分極はC-H結合の分極とは逆になる。シリルヒドリドは一般に無色で、物理的性質(溶解性、揮発性)は炭化水素に匹敵する。これらは自然発火性を示すこともあり、これはSi-H結合をSi-O結合に置換する大きな推進力を反映している。
反応と応用
シラン自体は主にマイクロエレクトロニクス産業でSiの原料として使用されていますが、ヒドロシランは多くの反応に関与しています。ヒドロシランは、主に工業規模および実験室規模の反応において、様々な還元反応に使用されています。これには、脱酸素化、ヒドロシリル化、イオン性水素化などが含まれます。
ヒドロシリル化
ヒドロシリル化では、アルケン、アルキン、イミン、カルボニルの複数の結合にSi-H結合が付加されます。アルケンの反応は商業的に重要です。多くの有機ケイ素化合物や材料がこの方法で製造されます。例として、ビニル末端シロキサンの架橋が挙げられます。

シラノールへの変換
白金系触媒の存在下では、ヒドロシランは水と反応してシラノールを生成します。
- R 3 SiH + H 2 O → R 3 SiOH + H 2
同様の変換は触媒の存在下で酸素を用いても起こり得る。[2]
フッ化物錯体
フッ化物イオンの存在下では、ヒドロシランは可逆的に式R 3 Si(F)H −で表される超原子価フルオロケイ酸塩を形成する。これらの種は水素化ホウ素に類似した還元剤である。[3] [4]

イオン水素化
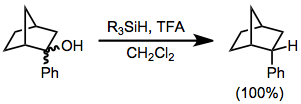
ヒドロシランによる還元は、イオン性水素化反応の一種です。このタイプの反応では、ヒドロシランの存在下で強いルイス酸またはブレンステッド酸の作用によりカルボカチオンが生成され、その後水素化物が転移します。代表的な酸はトリフルオロ酢酸(TFA)です。
反応は化学量論的です。
脱酸素化とイオン水素化
ヒドロシランはホスフィンオキシドやスルホキシドの脱酸素化に使用されます。 [5]
ヒドロシランは、いくつかのイオン性水素化において水素化物供与体として機能します。
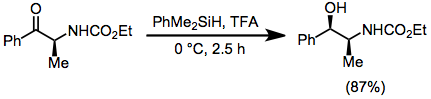
金属の配位
ヒドロシランは不飽和金属とシグマ錯体を形成する。この結合は二水素錯体のものと類似しているが、より強い。一例として、(CH3C5H4)Mn(CO)2(H2SiPh2)が挙げられる。[6]このような付加物は、Si-H結合の酸化的付加のモデルであり、また競合相手でもある。
有機基質の還元または添加
アルケンのヒドロシリル化と同様に、ヒドロシランはさまざまな不飽和基質に付加します。
一例として、PMHSが挙げられます。ある研究では、トリエチルシランがフェニルアジドからアニリンへの変換に使用されています。[7]
この反応では、ACCNがラジカル開始剤となり、脂肪族 チオールがシリルヒドリドにラジカル性を付与します。トリエチルシリルフリーラジカルはアジドと反応し、窒素を脱離してN-シリルアリールアミニルラジカルを形成します。このラジカルはチオールからプロトンを奪い、触媒サイクルを完了します。
さらに読む
選択的読書
- ラミレス・オリバ、エウラリア州。エルナンデス、アレハンドロ。マルティネス・ロザレス、J. マーセド;アギラール・エルゲサバル、アルフレド。エレーラ・ペレス、ガブリエル。セルバンテサ、ホルヘ (2006)。 「フェニルアセチレンのヒドロシリル化における Pt/MgO の合成法の影響」。Arkivoc : 126–136。ISSN 1424-6376 – ResearchGate経由。
参考文献
- ^ Chatgilialoglu, Chryssostomos (1995). 「シリルラジカルの構造と化学的性質」. Chemical Reviews . 95 (5): 1229– 1251. doi :10.1021/cr00037a005.
- ^ Jeon, Mina; Han, Junghoon; Park, Jaiwook (2012). 「ヒドロシランからのシラノールの触媒合成とその応用」ACS Catalysis . 2 (8): 1539– 1549. doi :10.1021/cs300296x.
- ^ チュイット、C.;コリュー、RJP;ペルツ、R. Reyé、C. Synthesis 1982、981。
- ^ Fleck, TJ (2001). 「フェニルシラン-フッ化セシウム」.有機合成試薬百科事典. doi :10.1002/047084289X.rp101. ISBN 0-471-93623-5。
- ^ コルビン、アーネスト・W. (1981). 「還元剤としてのシラン」.有機合成におけるケイ素. pp. 325– 336. doi :10.1016/B978-0-408-10831-7.50027-5. ISBN 9780408108317。
- ^ マグレディ、G. ショーン;サーシュ、ピーター。チャタートン、ニコラス P.オスターマン、アンドレアス。ガッティ、カルロ。アルトマンショファー、サンドラ。ヘルツ、ヴェレナ;アイカーリング、ゲオルク。シェラー、ヴォルフガング (2009)。 「金属シランσ錯体における結合の性質」。無機化学。48 (4): 1588 ~ 1598 年。土井: 10.1021/ic8019777。PMID 19146446。S2CID 40616439 。
- ^ ベナティ、ルイーザ;ベンチヴェンニ、ジョルジョ。ラルディーニ、リノ。ミノッツィ、マッテオ。ナンニ、ダニエレ。スカルピ、ロザンナ。スパニョーロ、ピエロ。ザナルディ、ジュゼッペ (2006)。 「トリエチルシランによる芳香族アジドのアミンへのラジカル還元」。J.Org.化学。 71 (15): 5822–5825。土井:10.1021/jo060824k。PMID 16839176。