 | |
| 名前 | |
|---|---|
| 推奨IUPAC名
3,5,5-トリメチルシクロヘキサ-2-エン-1-オン | |
| その他の名前
3,5,5-トリメチル-2-シクロヘキセン-1-オン
1,1,3-トリメチル-3-シクロヘキセン-5-オン イソホロン イソ アセトホロン IP | |
| 識別子 | |
3Dモデル(JSmol)
|
|
| ケムスパイダー | |
| ECHA 情報カード | 100.001.024 |
| EC番号 |
|
| ケッグ | |
PubChem CID
|
|
| ユニイ | |
CompToxダッシュボード (EPA)
|
|
| |
| |
| プロパティ | |
| C 9 H 14 O | |
| モル質量 | 138.210 g·mol −1 |
| 外観 | 無色から白色の液体 |
| 臭い | ペパーミントのような[2] |
| 密度 | 0.9255 g/cm 3 |
| 融点 | −8.1 °C (17.4 °F; 265.0 K) |
| 沸点 | 215.32 °C (419.58 °F; 488.47 K) |
| 1.2 g/100 mL | |
| 溶解度 | エーテル、アセトン、ヘキサン、ジクロロメタン、ベンゼン、トルエン、アルコール |
| 蒸気圧 | 0.3 mmHg(20℃)[2] |
屈折率(nD )
|
1.4766 |
| 粘度 | 2.62 cP |
| 熱化学 | |
標準生成エンタルピー (Δ f H ⦵ 298) |
43.4 kJ/モル |
| 危険 | |
| 引火点 | 84℃(183℉; 357K) |
| 460℃(860℉; 733 K) | |
| 爆発限界 | 0.8~3.8% [2] |
| 致死量または濃度(LD、LC): | |
LD 50(中間投与量)
|
2280 mg/kg(ラット、経口)[要出典] 2330 mg/kg(ラット、経口) 2690 mg/kg(マウス、経口)[3] |
LC 50(中央値濃度)
|
4600 ppm(モルモット、8時間)[3] |
LC Lo (公表最低額)
|
885 ppm(ラット、6時間) 1840 ppm(ラット、4時間)[3] |
| NIOSH(米国健康曝露限界): | |
PEL(許可)
|
TWA 25 ppm (140 mg/m 3 ) [2] |
REL(推奨)
|
TWA 4 ppm (23 mg/m 3 ) [2] |
IDLH(差し迫った危険)
|
200ppm [2] |
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。
| |
イソホロンはα,β-不飽和環状ケトンです。特徴的なペパーミントのような香りを持つ無色の液体ですが、市販のサンプルは黄色がかった色を呈することがあります。溶媒やポリマーの前駆体として使用され、工業的に大規模に生産されています。[4]
構造と反応性
イソホロンはα,β-不飽和ケトンに特徴的な反応を起こす。水素化によりシクロヘキサノン誘導体が得られる。塩基性過酸化水素によるエポキシ化によりオキシドが得られる。[5]
イソホロンはヒドロキシラジカルの攻撃によって分解される。[6]
光二量化
イソホロンは水溶液中で太陽光に曝露されると、2+2光環化付加反応を起こし、3つの異性体光二量体(図)を生成します。これらの「ジケトマー」は、シス-シン-シス、頭尾型(HT)、シス-アンチ-シス型(HT)、および頭頭型(HH)です。媒体の極性が増加するにつれて、HT型光二量体よりもHH型光二量体の形成が促進されます。[7]
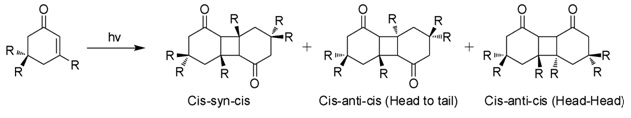
自然発生
イソホロンはクランベリーに天然に含まれています。[8]
合成
イソホロンは、KOHを用いたアセトンのアルドール縮合によって数千トン規模で生産されている。ジアセトンアルコール、メシチルオキシド、および3-ヒドロキシ-3,5,5-トリメチルシクロヘキサン-1-オンが中間体として生成する。副生成物として、C=C基がケトンと共役していないβ-イソホロンが生成される。 [4]
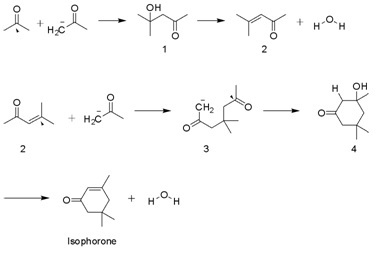
アプリケーション
部分水素化誘導体トリメチルシクロヘキサノンは、ポリカーボネートの製造に用いられます。フェノールと縮合してビスフェノールAの類似体が得られます。これらの2つのジオールをホスゲン化することで製造されるポリカーボネートは、熱安定性が向上したポリマーとなります。[9]トリメチルアジピン酸と2,2,4-トリメチルヘキサメチレンジアミンは、トリメチルシクロヘキサノンとトリメチルシクロヘキサノールから製造されます。これらは特殊ポリアミドの製造に用いられます。ヒドロシアノ化によりニトリルが得られ、その後還元アミノ化によりイソホロンジアミンが得られます。このジアミンは、特定のニッチ用途を持つイソホロンジイソシアネートの製造に用いられます。 [4]

完全な水素化により、日焼け止めと化学兵器の両方の原料となる 3,3,5-トリメチルシクロヘキサノールが生成されます。
安全性
ラットおよびウサギにおける経口曝露によるイソホロンのLD50値は約2.00 g/kgである。[ 10 ]イソホロンの安全性については、いくつかの研究が行われてきた。[11]
歴史
イソホロンを溶媒として使用することは、ホック法によるフェノール合成の廃棄物であるアセトンを処分またはリサイクルする方法の探索から生まれた。[12]
参照
参考文献
- ^ Merck Index、第13版、 5215。
- ^ abcdef NIOSH化学物質ハザードポケットガイド。「#0355」。米国国立労働安全衛生研究所(NIOSH)。
- ^ abc 「イソホロン」。生命または健康に直ちに危険を及ぼす濃度。米国労働安全衛生研究所。
- ^ abc Hardo Siegel; Manfred Eggersdorfer (2005). 「ケトン」. Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi :10.1002/14356007.a15_077. ISBN 978-3-527-30673-2。
- ^ Richard L. Wasson; Herbert O. House (1957). 「イソホロンオキシド」. Org. Synth . 37:58 . doi :10.15227/orgsyn.037.0058.
- ^ “TOXNET”. toxnet.nlm.nih.gov . 2017年10月24日時点のオリジナルよりアーカイブ。2016年3月11日閲覧。
- ^ Gonçalves, Huguette; Robinet, Germaine; Barthelat, Michèle; Lattes, Armand (1998-01-28). 「イソホロンの超分子性と光二量化:FTIRと分子力学研究」. The Journal of Physical Chemistry A. 102 ( 8): 1279– 1287. Bibcode :1998JPCA..102.1279G. doi :10.1021/jp9729270.
- ^ 「イソホロン」。
- ^ フォルカー・セリーニ (2000)。 「ポリカーボネート」。ウルマンの工業化学百科事典。ワインハイム: ワイリー-VCH。土井:10.1002/14356007.a21_207。ISBN 978-3-527-30673-2。
- ^ 「毒性影響」. tools.niehs.nih.gov . 2016年3月11日閲覧。
- ^ W. Morton Grant、Joel S. Schuman MD(2016年2月11日)「眼の毒性学:化学物質、薬物、金属・鉱物、植物、毒素、毒液による眼と視覚系への影響、および眼からの全身的副作用」Med(2巻セット)第4版、863ページ。
- ^ デグサにおけるイソホロンの歴史

