| バイヤー・ビリガー酸化 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 名前の由来 | アドルフ・フォン・バイヤー ヴィクトル・ビリガー | ||||||||
| 反応タイプ | 有機酸化還元反応 | ||||||||
| 反応 | |||||||||
| |||||||||
| 識別子 | |||||||||
| 有機化学ポータル | バイヤー・ビリガー酸化 | ||||||||
| RSCオントロジーID | 受信番号:0000031 | ||||||||
バイヤー・ビリガー酸化は、過酸または過酸化物を酸化剤として用いて、ケトンからエステルを、または環状ケトンからラクトンを生成する有機反応である。[1]この反応は、1899年に初めてこの反応を報告したアドルフ・フォン・バイヤーとヴィクトール・ビリガーにちなんで名付けられた。 [1]

反応機構
反応機構の第一段階では、過酸がカルボニル基の酸素をプロトン化する。[1]これにより、カルボニル基は過酸による攻撃を受けやすくなる。[1]次に、過酸がカルボニル基の炭素を攻撃し、クリギー中間体と呼ばれるものを形成する。[1]協調機構により、ケトン基の置換基の1つが過酸化物基の酸素に移動し、カルボン酸が離脱する。[1]この移動段階が律速段階であると考えられている。[2] [3]最後に、オキソカルベニウムイオンの脱プロトン化によりエステルが生成される。[1]

バイヤー・ビリガー酸化の生成物は、一次立体電子効果と二次立体電子効果の両方によって制御されると考えられている。[4]バイヤー・ビリガー酸化における一次立体電子効果とは、過酸化物基の酸素-酸素結合が、移動する基に対して反ペリプラナーでなければならないということである。 [4] [3]この配向により、移動する基の𝛔 軌道と過酸化物基の𝛔* 軌道が最適に重なり合う。 [1]二次立体電子効果とは、水酸基の酸素上の孤立電子対が、移動する基に対して反ペリプラナーでなければならないということである。[4]これにより、酸素の非結合軌道と移動する基の 𝛔* 軌道が最適に重なり合う。[5]この移動ステップは(少なくともコンピューター上では)、2つまたは3つの過酸ユニットによっても支援され、水酸基プロトンが新しい位置に移動できるようになる。[6]
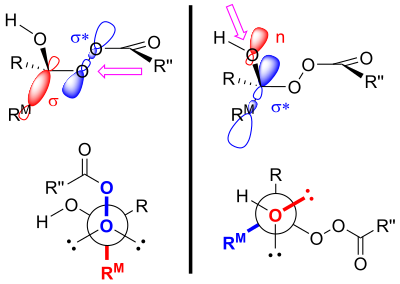
移動能力は、第三級 > 第二級 > アリール > 第一級の順にランク付けされます。[7] アリル基は第一級アルキル基よりも移動しやすいですが、第二級アルキル基ほど移動しにくいです。[5]置換基上の 電子吸引基は移動速度を低下させます。[8]この移動能力の傾向には 2 つの説明があります。 [9] 1 つの説明は、クリギー中間体の分解の遷移状態における正電荷の蓄積に依存しています (クリギー中間体のカルボカチオン 共鳴構造で説明)。 [9]この構造を念頭に置くと、正電荷を最もよく維持できる置換基が最も移動する可能性が高いことは理にかなっています。[9]一般に、置換度が高いほど、カルボカチオンはより安定します。[10]したがって、第三級 > 第二級 > 第一級の傾向が見られます。

別の説明では、立体電子効果と立体論的議論が用いられる。[11]前述のように、遷移状態において過酸化物基に対して反ペリプラナーである置換基は移動する。[4]この遷移状態では、過酸と移動しない置換基との間にゴーシュ相互作用が生じる。 [11]より嵩高い基が過酸化物基に対して反ペリプラナーに配置されると、形成中のエステル上の置換基と過酸のカルボニル基との間のゴーシュ相互作用は減少する。[11]したがって、より嵩高い基が過酸化物基に対して反ペリプラナーであることを好むため、移動適性が高まる。[11]

非環式ケトンの移動基は通常、1°アルキル基ではありません。しかし、CF 3 CO 3 HまたはBF 3 + H 2 O 2を試薬として用いることで、2°または3°基よりも優先的に移動するように誘導することができます。[12]
この移動は転移する基の立体化学を変化させない、すなわち立体保持性である。[13] [14]
歴史

1899年、アドルフ・バイヤーとヴィクトール・ヴィリガーは、現在バイヤー・ヴィリガー酸化として知られる反応を実証しました。[15] [16]彼らはペルオキシモノ硫酸を用いて、樟脳、メントン、テトラヒドロカルボンから対応するラクトンを合成しました。 [16] [17]
3つの反応機構が提案された。[18]これら3つの反応機構は、実際には、過酸攻撃の2つの経路、すなわちカルボニル基の酸素または炭素への経路に分けることができる。[19]酸素への攻撃では、2つの中間体が生成される可能性がある。BaeyerとVilligerはジオキシラン中間体を示唆し、Georg WittigとGustav Pieperはジオキシランを形成しない過酸化物を示唆した。 [19]炭素攻撃は、 Rudolf Criegeeによって提案された。[19]この経路では、過酸がカルボニル炭素を攻撃し、現在ではCriegee中間体として知られているものを生成する。[19]

1953年、ウィリアム・フォン・エッガース・ドーリングとエドウィン・ドーフマンは、ベンゾフェノンの酸素18標識を用いてこのメカニズムを特定した。[18]これまでに提案された3つのメカニズムは、それぞれ異なる分布の標識生成物を生成する。クリギー中間体は、カルボニル酸素のみが標識された生成物を生成する。[18]ウィッティヒ・ピーパー中間体の生成物は、エステルのアルコキシ基のみが標識される。 [18]バイヤー・ビリガー中間体は、上記2つの生成物が1:1で分布する。[18]標識実験の結果はクリギー中間体を支持するものであり、[18]現在では一般的に受け入れられている経路となっている。[1]

試薬
バイヤー・ビリガー酸化に使用される多くの過酸の中で、一般的な酸化剤としては、メタクロロ過安息香酸(mCPBA)とトリフルオロ過酢酸(TFPAA)がある。[2]一般的な傾向として、対応するカルボン酸(過酸化物の場合はアルコール)のpKaが低い(すなわち、酸性度が強い)ほど、反応性が高くなる。 [7]したがって、反応性の傾向は、TFPAA > 4-ニトロ過安息香酸 > mCPBA、過ギ酸>過酢酸>過酸化水素> tert-ブチルヒドロペルオキシドとなる。[5]ヒドロペルオキシドは、過酸に比べて反応性が低い。[2]過酸化水素を使用する場合には、触媒も必要となる。[7] [20]さらに、有機過酸化物と過酸化水素を使用すると、多くの場合、副反応が促進される。[21]酸素はシクロヘキサノールをカプロラクトン に変換するために使用できますが、その過程で過酸化水素が発生します。[7]
- C 6 H 11 OH + O 2 → C 6 H 10 O + H 2 O 2
- C 6 H 10 O + H 2 O 2 → C 6 H 10 O 2 + H 2 O
制限事項

バイヤー・ビリガー酸化を行う際に過酸や過酸化物を使用すると、他の官能基も酸化される可能性がある。[23]例えば、電子豊富なアルケンはエポキシドに酸化される可能性がある。[23]
変更点
接触バイヤービリガー酸化
過酸化水素を酸化剤として使用すると、反応はより環境に優しくなります。[7]ベンゼンセレニン酸誘導体を触媒として使用すると、過酸化水素を酸化剤として高い選択性を示すことが報告されています。[7]もう一つの有望な触媒クラスは、スズケイ酸塩などの固体ルイス酸触媒です。[24]
不斉バイヤービリガー酸化
有機金属触媒を用いてエナンチオ選択的なバイヤー・ビリガー酸化を行う試みがなされてきた。[7]プロキラルケトンの酸化反応として最初に報告された例は、銅触媒を用いて二酸素を酸化剤として用いたものである。[25]その後、白金やアルミニウム化合物などの他の触媒が続いた。[25]
バイヤービリガーモノオキシゲナーゼ

自然界では、バイヤー・ビリガーモノオキシゲナーゼ(BVMO)と呼ばれる酵素が、化学反応と同様に酸化反応を行います。[26]この化学反応を促進するため、BVMOにはフラビンアデニンジヌクレオチド(FAD)補因子が含まれています。[27]触媒サイクル(右の図を参照)では、まず細胞の酸化還元当量NADPHが補因子を還元し、続いて分子状酸素と反応します。結果として生じるペルオキシフラビンは、基質を酸素化する触媒体であり、理論的研究では、この反応は化学反応で観察されるのと同じクリギー中間体を経て進行することが示唆されています。[28]エステル生成物を形成する転位ステップの後、ヒドロキシフラビンが残り、これが自発的に水を除去して酸化フラビンを形成し、触媒サイクルを閉じます。
BVMOはフラビン含有モノオキシゲナーゼ(FMO)[29]と密接な関連があり、この酵素はヒトの体内にも存在し、シトクロムP450モノオキシゲナーゼとともに肝臓の最前線代謝解毒システム内で機能しています。[30]ヒトFMO5は実際にバイヤー・ビリガー反応を触媒できることが示されており、この反応がヒトの体内でも起こる可能性があることを示唆しています。[31]
BVMOsは生体触媒として、すなわち有機合成への応用の可能性から広く研究されてきた。 [32]ほとんどの化学触媒に対する環境問題を考慮すると、酵素の使用はより環境に優しい代替手段であると考えられている。[26]特にBVMOsは生体触媒において通常求められるさまざまな基準を満たすため、応用が興味深い。合成に有用な反応を触媒する能力の他に、一部の天然ホモログは非常に広い基質範囲を持つことが判明している(すなわち、酵素触媒においてしばしば想定されるように、その反応性は単一の化合物に限定されない)[33] 。それらは大規模に容易に製造することができ、多くのBVMOsの3次元構造が決定されているため、酵素工学を適用して、耐熱性や反応性が向上した変異体を製造できる可能性がある。 [34] [35]反応に酵素を使用するもう一つの利点は、酵素の活性部位内での触媒反応中に基質の配向を立体的に制御することにより、頻繁に観察される位置選択性とエナンチオ選択性である。[26] [32]
全合成における応用例

ゾアパタノールはゼオパトル植物から抽出され、バイヤー・ビリガー酸化によってラクトンに変換される。[36] [37]
ステロイドの デヒドロエピアンドロステロンは、バイヤー・ビリガーモノオキシゲナーゼを産生する真菌によって抗癌剤テストロラクトンに変換される。[38]

参照
- シュミット反応 — ケトンをアミドまたはラクタムに変換する
- ルボトム酸化 - エノラートの酸化は転位を防ぐ
- ダキン反応- ジオキシランは環に酸素を挿入するのではなく、 アレーンアルデヒドからパラフェノールを形成する。
参考文献
- ^ abcdefghi クルティ、ラースロー;チャコ、バルバラ (2005)。有機合成における名前付き反応の戦略的応用。バーリントン;サンディエゴ;ロンドン:エルゼビア・アカデミック・プレス。 p. 28.ISBN 978-0-12-369483-6。
- ^ abc Krow, Grant R. (1993). 「ケトンとアルデヒドのバイヤー・ビリガー酸化」.有機反応. 43 (3): 251– 798. doi :10.1002/0471264180.or043.03. ISBN 0471264180。
- ^ ab Carey, Francis A.; Sundberg, Richard J. (2007). Advanced Organic Chemistry: Part B: Reactions and Synthesis (第5版). New York: Springer. p. 1135. ISBN 978-0387683546。
- ^ abcd Crudden, Cathleen M.; Chen, Austin C.; Calhoun, Larry A. (2000). 「α-フルオロシクロヘキサノンのバイヤー・ビリガー酸化における一次立体電子効果の実証」Angew. Chem. Int. Ed . 39 (16): 2851– 2855. Bibcode :2000AngCh..39.2851C. doi :10.1002/1521-3773(20000818)39:16<2851::aid-anie2851>3.0.co;2-y. PMID 11027987.
- ^ abc Myers, Andrew G. 「化学115ハンドアウト:酸化」(PDF)。ハーバード大学。
- ^ 山辺真一 (2007). 「バイヤー−ビリガー反応における水素結合の役割」.有機化学ジャーナル. 72 (8): 3031– 3041. doi :10.1021/jo0626562. PMID 17367197.
- ^ abcdefg ten Brink, G.-J.; Arends, WCE ; Sheldon, RA (2004). 「バイヤー・ビリガー反応:より環境に優しい手順に向けた新たな展開」. Chem. Rev. 104 ( 9): 4105– 4123. doi :10.1021/cr030011l. PMID 15352787.
- ^ Li, Jie Jack; Corey, EJ編 (2007).官能基変換の名称反応. ホーボーケン, ニュージャージー州: Wiley-Interscience.
- ^ abc Hawthorne, M. Frederick; Emmons, William D.; McCallum, KS (1958). 「ケトンのペルオキシ酸分解の再検討.I. 相対的移動能」. J. Am. Chem. Soc . 80 (23): 6393– 6398. Bibcode :1958JAChS..80.6393H. doi :10.1021/ja01556a057.
- ^ ジョーンズ・ジュニア、メイトランド;フレミング、スティーブン A. (2010)。有機化学(第 4 版)。カナダ: WW Norton & Company。 p. 293.ISBN 978-0-393-93149-5。
- ^ abcd Evans, DA「ステレオ電子効果-2」。化学206(2006-2007年秋) .
- ^ Sanyal, SN (2003).反応、転位、試薬(第4版)p. 90. ISBN 978-81-7709-605-7。
- ^ Turner, Richard B. (1950). 「ケトンの過酸酸化の立体化学」. J. Am. Chem. Soc . 72 (2): 878– 882. Bibcode :1950JAChS..72..878T. doi :10.1021/ja01158a061.
- ^ Gallagher, TF; Kritchevsky, Theodore H. (1950). 「20-ケトステロイドの過安息香酸酸化とC-17の立体化学」. J. Am. Chem. Soc . 72 (2): 882– 885. Bibcode :1950JAChS..72..882G. doi :10.1021/ja01158a062.
- ^ バイヤー、アドルフ;ビクター、ヴィリガー (1899)。 「Einwirkung des Caro'schen Reagens auf Ketone」。ベル。ドイツ語。化学。ゲス。32 (3): 3625–3633。土井:10.1002/cber.189903203151。
- ^ ab Hassall, CH (1957). 「アルデヒドとケトンのバイヤー・ビリガー酸化」.有機反応. 9 (3): 73– 106. doi :10.1002/0471264180.or009.03. ISBN 0471264180。
{{cite journal}}:ISBN / 日付の非互換性(ヘルプ) - ^ レンツ、マイケル;ムニエ、バーナード (1999)。 「バイヤービリガー酸化の100年」。ユーロ。 J.Org.化学。1999 (4): 737–750。doi : 10.1002/(SICI)1099-0690(199904)1999:4<737::AID-EJOC737>3.0.CO;2-B 。
- ^ abcdef Doering, W. von E.; Dorfman, Edwin (1953). 「過酸ケトン-エステル変換の機構.有機化合物中の酸素-18分析」.J. Am. Chem. Soc . 75 (22): 5595– 5598. Bibcode :1953JAChS..75.5595D. doi :10.1021/ja01118a035.
- ^ abcd Doering, W. von E.; Speers, Louise (1950). 「非対称ケトンの過酢酸分解」. Journal of the American Chemical Society . 72 (12): 5515– 5518. Bibcode :1950JAChS..72.5515D. doi :10.1021/ja01168a041.
- ^ Cavarzan, Alessandra; Scarso, Alessandro; Sgarbossa, Paolo; Michelin, Rino A.; Strukul, Giorgio (2010). 「Pt(II)触媒を介した水中過酸化水素によるグリーン触媒バイヤー・ビリガー酸化」. ChemCatChem . 2 (10): 1296– 1302. doi :10.1002/cctc.201000088. S2CID 98508888.
- ^ シュバイツァー=シャプー、ベルトラン;クルテン、テオ。クラスマン、マーティン (2015)。 「クリージー付加物からのラジカルまたはバイヤービリガー酸化の酸媒介形成」。アンゲワンテ・ケミー国際版。54 (40): 11848–11851。土井:10.1002/anie.201505648。PMID 26267787。
- ^ Payne, GB (1962). 「ベンゾニトリル-過酸化水素によるエポキシ化の簡略化手順:2-アリルシクロヘキサノンの選択酸化」. Tetrahedron . 18 (6): 763– 765. doi :10.1016/S0040-4020(01)92726-7.
- ^ ab Grant R. Krow (1991). Trost, Barry M.; Fleming, Ian (編). 包括的有機合成 ― 現代有機化学における選択性、戦略、効率性 第1巻~第9巻. Elsevier. pp. 671– 688. ISBN 978-0-08-035930-4。
- ^ フェリーニ、パオラ;ダイクマンス、ジャン。クラーク、リク・デ;ヴァイバー、スタイン・ヴァン・デ。デュスリエ、ミシェル。ジェイコブズ、ピエール A.セルス、バート F. (2017)。 「シリカホストに組み込まれたシングルサイトSn中心に対するルイス酸触媒作用」。錯体化学のレビュー。343 : 220–255 .土井:10.1016/j.ccr.2017.05.010。
- ^ ab Seymour, Craig. 「ページ1 非対称バイヤー・ビリガー酸化」(PDF) . scs.illinois.edu .
- ^ abc Leisch, Hannes; Morley, Krista; Lau, Peter CK (2011年7月13日). 「バイヤー−ビリガーモノオキシゲナーゼ:単なるグリーンケミストリー以上のもの」. Chemical Reviews . 111 (7): 4165– 4222. doi :10.1021/cr1003437. ISSN 0009-2665. PMID 21542563.
- ^ Sheng, Dawei; Ballou, David P.; Massey, Vincent (2001年9月1日). 「シクロヘキサノンモノオキシゲナーゼの機構研究:触媒に関与する中間体の化学的性質」.生化学. 40 (37): 11156– 11167. doi :10.1021/bi011153h. ISSN 0006-2960. PMID 11551214.
- ^ Polyak, Iakov; Reetz, Manfred T.; Thiel, Walter (2012年2月8日). 「酵素バイヤー・ビリガー反応の機構に関する量子力学的/分子力学的研究」. Journal of the American Chemical Society . 134 (5): 2732– 2741. Bibcode :2012JAChS.134.2732P. doi :10.1021/ja2103839. ISSN 0002-7863. PMID 22239272.
- ^ ファン・バーケル、WJH;ニューメキシコ州カマーベーク。ミネソタ州フライジェ(2006 年 8 月 5 日)。 「フラボタンパク質モノオキシゲナーゼ、酸化生体触媒の多様なクラス」。バイオテクノロジージャーナル。124 (4): 670–689。土井:10.1016/j.jbiotec.2006.03.044。hdl : 11370/99a1ac5c-d4a4-4612-90a3-4fe1d4d03a11。ISSN 0168-1656。PMID 16712999。
- ^ 彌柳 隆 (2007年1月1日). 薬物代謝酵素の分子メカニズム:解毒への示唆. International Review of Cytology. Vol. 260. Academic Press. pp. 35– 112. doi :10.1016/S0074-7696(06)60002-8. ISBN 9780123741141. PMID 17482904。
- ^ Fiorentini, Filippo; Geier, Martina; Binda, Claudia; Winkler, Margit; Faber, Kurt; Hall, Mélanie; Mattevi, Andrea (2016年4月15日). 「ヒトFMO5の生体触媒特性:ヒトにおけるバイヤー・ビリガー反応の解明」. ACS Chemical Biology . 11 (4): 1039– 1048. doi :10.1021/acschembio.5b01016. ISSN 1554-8929. PMID 26771671.
- ^ ab Fürst、マクシミリアン・JLJ;グラン・シュシュ、アレハンドロ。オールバース、フリソ S.フライジェ、マルコ W. (2019 年 12 月 6 日) 「バイヤー・ビリガー モノオキシゲナーゼ: 調整可能な酸化生体触媒」。ACS触媒作用。9 (12): 11207–11241。土井: 10.1021/acscatal.9b03396。
- ^ Fürst, Maximilian JLJ; Romero, Elvira; Gómez Castellanos, J. Rúben; Fraaije, Marco W.; Mattevi, Andrea (2018年12月7日). 「無差別酵素における側鎖プルーニングは基質選択性に限られた影響を与える」. ACS Catalysis . 8 (12): 11648– 11656. doi : 10.1021/acscatal.8b03793 . PMC 6345240. PMID 30687578 .
- ^ Fürst, Maximilian JLJ; Boonstra, Marjon; Bandstra, Selle; Fraaije, Marco W. (2019). 「計算論的および実験的ライブラリ設計によるシクロヘキサノンモノオキシゲナーゼの安定化」. Biotechnology and Bioengineering . 116 (9): 2167– 2177. doi : 10.1002/bit.27022 . ISSN 1097-0290. PMC 6836875. PMID 31124128 .
- ^ 李光岳;ガルシア=ボラス、マルク。フュルスト、マクシミリアン・JLJ;イリエ、アドリアナ。フライジェ、マルコ W.カンザス州ホーク。マンフレッド・T・リーツ(2018年8月22日)。 「指向性進化による生体触媒バイヤー・ビリガー反応における従来の電子効果のオーバーライド」。アメリカ化学会誌。140 (33): 10464–10472。書誌コード:2018JAChS.14010464L。土井:10.1021/jacs.8b04742。ISSN 0002-7863。PMC 6314816。PMID 30044629。
- ^ Kane, Vinayak V.; Doyle, Donald L. (1981). 「(±)ゾアパタノールの全合成:主要中間体の立体特異的合成」. Tetrahedron Lett . 22 (32): 3027– 3030. doi :10.1016/S0040-4039(01)81818-9.
- ^ Kane, Vinayak V.; Doyle, Donald L. (1981). 「(±)ゾアパタノールの全合成」. Tetrahedron Lett . 22 (32): 3031– 3034. doi :10.1016/S0040-4039(01)81819-0.
- ^ Świzdor, Alina (2013). 「Penicillium lanosocoeruleumによるいくつかのC19ステロイドのBaeyer-Villiger酸化」. Molecules . 18 (11): 13812– 13822. doi : 10.3390/molecules181113812 . PMC 6270215. PMID 24213656 .
外部リンク
- バイヤー・ビリガー酸化のアニメーション