豚肝エステラーゼを用いた不斉エステル加水分解は、豚肝エステラーゼ(EC 3.1.1.1)の作用により、エステルをエナンチオ選択的にカルボン酸に変換する反応である。不斉エステル加水分解は、エナンチオトピック(同一分子内に存在する、分子の対称面によって関連している)またはエナンチオモルフィック(鏡像異性体分子内に存在する、鏡像として関連している)なエステル基のペアのうち、一方を選択的に反応させる反応である。 [1]
導入
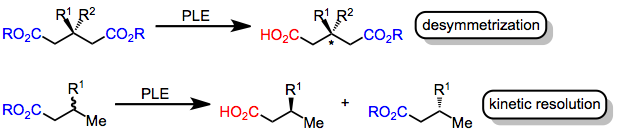
酵素はキラルアミノ 酸から構成され、高い立体選択性で化学反応を触媒する。具体的には、エステラーゼ酵素はエステルをカルボン酸に加水分解する触媒作用を持つ。この変換は、基質に2つのエナンチオトピックなエステル基が存在する場合、またはキラルエステルのラセミ混合物が使用される場合、不斉に進行する可能性がある。前者の場合(非対称化)、酵素活性部位のキラル環境により、基質が酵素に結合した際に、触媒活性セリン残基に近いエステルが選択的に加水分解される。後者の場合(速度論的分割)、一方のエナンチオマーが他方よりも速く加水分解されるため、一方のエナンチオマーから過剰の加水分解生成物が生じる。どちらの戦略も、キラル酵素によるエナンチオトピックまたはエナンチオモルフィックなエステル基の加水分解の遷移状態がジアステレオマーであるという事実を利用している。[2]
豚肝臓エステラーゼ(PLE)は、エステルの不斉加水分解に広く用いられる酵素です。元々はグルタル酸エステルの非対称加水分解に用いられていましたが、[3]マロン酸エステル、環状ジエステル、モノエステルなどの基質も加水分解します。PLEの選択性を説明するために、活性部位モデルが発展してきました。[4]
(1)
メカニズムと立体化学
一般的なメカニズム
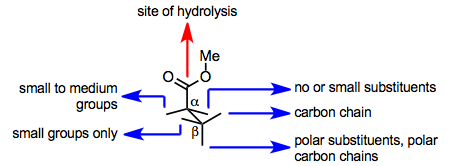
PLEの活性部位は、基質結合と加水分解の両方を促進します。活性部位の主要なセリン残基は加水分解を促進しますが、加水分解が起こるためには、基質が酵素活性部位に結合した後、この残基にエステル基を提示する必要があります。基質が触媒セリン残基にエステル基を提示できるかどうかは、活性部位における結合立体配座に依存し、これは活性部位のアミノ酸側鎖によって決定されます。そのため、PLEの活性部位モデルは、基質の構造から、2つのエナンチオトピックエステル基のうちどちらが加水分解されるか(あるいは加水分解が起こる可能性があるかどうか)を予測することを目的として開発されてきました。
PLEの活性部位におけるエステルの結合コンフォメーションの簡単なモデルを以下に示します。このモデルは、加水分解されたグルタル酸や類似の基質の立体配座を正確に予測します。
(2)
範囲と制限
PLEの基質適用範囲は広いものの、エナンチオ選択性は基質の構造に応じて変化します。本項では、PLEによって最も高いエナンチオ選択性で加水分解される基質、および副反応を起こさずに高収率でアキラルなカルボン酸へと加水分解される可能性のある、反応に敏感な基質について説明します。
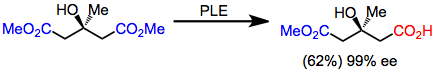
グルタル酸はPLEによって高いエナンチオ選択性で加水分解された最初の基質であった。収率は中程度であるものの、エナンチオ選択性は非常に高い。[5]
(3)
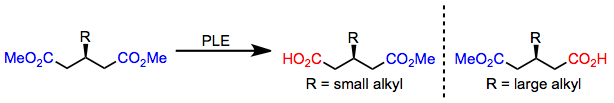
小さなアルキル置換基を持つ3-アルキルグルタレートは加水分解されて( R )-モノエステルとなるが、大きなアルキル置換基が存在する場合は( S )-モノエステルが形成される。[6]このエナンチオ選択性の切り替えは、上記の活性部位モデルによって正確に予測される。
(4)
2-メチルマロネートの非対称加水分解では逆の傾向が見られ、C-2位の他の置換基が小さい場合は( S )エナンチオマーが得られ、他のC-2位の置換基が大きい場合は( R )エナンチオマーが得られる。[7]
(5)
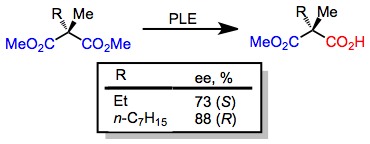
上記の基質以外にも、多くのメソジエステルがPLEによって高いエナンチオ選択性で加水分解される可能性がある。環状メソジエステルは非環状ジエステルよりも選択的に加水分解される傾向がある。[8]生成物の主なエナンチオマーは環の大きさに依存する。[9] [10]
(6)

7-オキサビシクロ[2.2.1]ヘプタン-2,3-ジカルボキシレートは、PLEによって高いエナンチオ選択性で加水分解される興味深いジエステル類である。[11]これらの基質は、生物学的に関連する糖のエナンチオ選択的構築に使用されている(以下の合成用途を参照)。
(7)
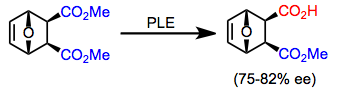
上記のすべての基質のラセミ混合物、および追加のキラルジエステル(式(8)のエポキシエステルなど)は、PLEを用いた速度論的分割によって分割することができる。[12]速度論的分割の大きな欠点は、加水分解生成物の最大収率が50%であることだ。しかし、加水分解と同時に急速なラセミ化が起こっている場合(動的速度論的分割の例)、最大収率は100%に達する可能性がある。[13]
(8)
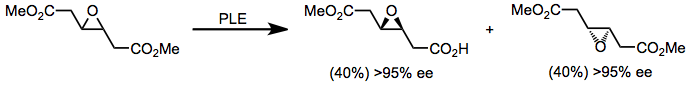
エステラーゼ酵素は塩基感受性モノエステルの加水分解にも用いられる。PLEはプロスタグランジンの合成に応用されており、β-ヒドロキシケトン部分を破壊せずにエステルを選択的に加水分解することができる。[14]
(9)

合成アプリケーション
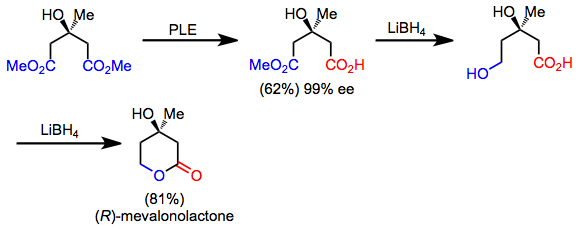
多くの合成対象は隠れた対称性を有しており、逆合成的な「対称化」変換を適用することで発見できる場合があります。順方向では、この操作は非対称化反応に相当します。例えば、メバロノラクトンは対称ジエステルから非対称化加水分解、化学選択的還元、そしてラクトン化を経て迅速に合成できます。[5]生成物自体は非対称ですが、非対称化と官能基操作により、アキラルな出発物質から合成することが可能です。
(10)
共役ジエステルのエナンチオ選択的加水分解とそれに続くオゾン分解により、リボースの骨格が得られる。得られた糖は、ヌクレオシドの合成に利用される。[15]
(11)

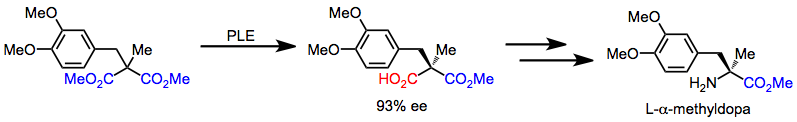
L-α-メチルドーパは、アキラルなマロン酸エステルから、非対称化反応から始まる一連の反応を経て迅速に合成できる。その後の化学選択的変換により、カルボン酸がアミンに変換される。[16]
(12)
他の方法との比較
不斉エステル加水分解に用いられる他の酵素としては、デンキウナギアセチルコリンエステラーゼ[17] 、キモトリプシン[3]、パン酵母[18]などが挙げられます。これらの酵素の基質範囲はPLEとは異なり、場合によってはPLEよりも高い収率またはエナンチオ選択性で加水分解生成物を与えることがあります。微生物もエナンチオ選択的加水分解に用いられることがありますが[19]、微生物の取り扱いに伴う困難さから、これらの方法は有機合成においてはあまり普及していません。
非酵素的方法では、キラル触媒または補助剤を用いてエナンチオトピック基を区別する。例えば、メソ二酸の両カルボン酸基にキラルな脱離基を導入すると、アキラルな求核剤が(その時点で)ジアステレオトピックなカルボニル基の1つを選択的に攻撃する。[20]
(13)
実験条件と手順
典型的な条件
酵素反応は、水性溶媒と中性付近の反応条件を必要とするため、その効果は限定されます。PLE加水分解は通常、リン酸緩衝液を用いてpHを7~8に維持しながら行われます。基質の水性溶媒への溶解性は重要であるため、酵素水溶液に少量の極性有機共溶媒を添加することもあります。市販のPLEは、ほとんどの用途に十分な純度を備えています。
参考文献
- ^ 大野正之; 大塚正之.有機反応. 1989 , 37 , 1. doi :10.1002/0471264180.or037.01
- ^ Rétey, J.; Robinson, J. Stereospecificity in Organic Chemistry and Enzymology、Verlag Chemie、Weinheim、1982年。
- ^ ab コーエン、S.;ケドゥリ、E.J.Am .化学。社会 1961 年、83 年、1093 年。
- ^ ゼムリッカ、J.クレイン、L.ヒーグ、M.-J.オリバー、J. J. Org.化学。 1988、53、937。
- ^ ab Huang、FC;リー、LFH。ミタル、RSD;ラヴィクマール、広報。チャン、JA;シ、CJ。カプシ、E.エック、CR J. Am.化学。社会 1975、97、4144。
- ^ ラム、LKP;ホイ、RAHF。ジョーンズ、JB J. Org.化学。 1986 年、51 年、2047 年。
- ^ ビョークリング、F.;ブテリエ、J.ガテンベック、S.ハルト、K。ノリン、T. Szmulik、P . Tetrahedron 1985、41、1347。
- ^ モール、P.ワスペ・サレヴィ、N.タム、C.ガウロンスカ、K.ガウロンスキー、J.ヘルブチム。アクタ 1983 , 66 , 2501。
- ^ サッビオーニ、G.シア、ML;ジョーンズ、J.B.J.Chem.学会、化学。共通。 1984年、236。
- ^ Schneider, M.; Engel, N.; Hönicke, P.; Heinemann, G.; Görisch, H. Angew. Chem. Int. Ed. Engl. 1984 , 23 , 67.
- ^ グアンティ、G.バンフィ、L.ナリサノ、E.リバ、R.テア、S. Tetrahedron Lett. 1986、27、 4639。
- ^ モール、P.ロスライン、L.タム、C.ヘルブ。チム。アクタ 1987、70、 142。
- ^ アレン、J.; ウィリアムズ、J.テトラヘドロンレット。 1996年、37、1859。
- ^ ハザト、A.田中哲也;徹、T.岡村直也;坂内、K.杉浦真司;真鍋和也;黒住、S.日本科学会誌 1983、9、1390 [CA、100、120720q (1984)] 。
- ^ Ohno, M.; Kobayashi, S.; Aomori, K. in Enzymes as Catalysts in Organic Synthesis , Schneider, MP Ed., D. Reidel Publishing, Dordrecht, 1986, pp. 123–142.
- ^ ビョークリング、F.;ブテリエ、J.ガテンベック、S.ハルト、K。ノリン、T. Tetrahedron Lett. 1985、26、 4957。
- ^ Deardorff, DR; Matthews, AJ; McMeekin, DS; Craney, CL Tetrahedron Lett. 1986 , 27 , 1255.
- ^ ケルシャー、V.;クライザー、W. Tetrahedron Lett. 1987、28、 531。
- ^ 小谷 宏; 久世 雄三; 内田 誠; 宮部 毅; 飯森 敏夫; 岡野 健; 小林 誠; 大野 正治;農業生物化学 1983 , 47 , 1363.
- ^ 長尾裕樹;池田哲也;八木正人;藤田英治;シロ、M.J.Am .化学。社会 1982年、104年、2079年。