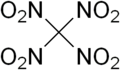| |||
| 名前 | |||
|---|---|---|---|
| IUPAC名
テトラニトロメタン
| |||
| その他の名前
TNM
テタン | |||
| 識別子 | |||
3Dモデル(JSmol)
|
| ||
| チェムブル | |||
| ケムスパイダー | |||
| ECHA 情報カード | 100.007.359 | ||
| EC番号 |
| ||
| ケッグ | |||
PubChem CID
|
| ||
| RTECS番号 |
| ||
| ユニイ | |||
| 国連番号 | 1510 | ||
CompToxダッシュボード (EPA)
|
| ||
| |||
| |||
| プロパティ | |||
| C(NO 2 ) 4 | |||
| モル質量 | 196.04 g/モル | ||
| 外観 | 無色から淡黄色の液体または固体 | ||
| 臭い | 刺激的な | ||
| 密度 | 1.623 g/cm 3 | ||
| 融点 | 13.8 °C (56.8 °F; 286.9 K) | ||
| 沸点 | 126℃(259°F; 399K) | ||
| 不溶性 | |||
| 蒸気圧 | 8 mmHg(20℃)[2] | ||
磁化率(χ)
|
−43.02·10 −6 cm 3 /モル | ||
| 危険 | |||
| 労働安全衛生(OHS/OSH): | |||
主な危険
|
酸化剤、爆発性混合物を形成する可能性がある | ||
| GHSラベル: | |||
   
| |||
| 危険 | |||
| H271、H301、H315、H319、H330、H335、H351 | |||
| P201、P202、P210、P220、P221、P260、P261、P264、P270、P271、P280、P281、P283、P284、P301+P310、P302+P352、P304+P340、P305+P351+P338、P306+P360、P308+P313、P310、P312、P320、P321、P330、P332+P313、P337+P313、P362、P370+P378、P371+P380+P375、P403+P233、P405、P501 | |||
| NFPA 704(ファイアダイヤモンド) | |||
| 致死量または濃度(LD、LC): | |||
LC 50(中央値濃度)
|
18 ppm(ラット、4時間) 100 ppm(ネコ、20分) 54 ppm(マウス、4時間)[3] | ||
| NIOSH(米国健康曝露限界): | |||
PEL(許可)
|
TWA 1 ppm (8 mg/m 3 ) [2] | ||
REL(推奨)
|
TWA 1 ppm (8 mg/m 3 ) [2] | ||
IDLH(差し迫った危険)
|
4ppm [2] | ||
| 安全データシート(SDS) | ICSC 1468 | ||
| 関連化合物 | |||
関連化合物
|
ヘキサニトロエタン オクタニトロペンタン トリニトロメタン | ||
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。
| |||
テトラニトロメタン(TNM)は、化学式C(NO 2 ) 4で表される有機 酸化剤です。その化学構造は、1つの炭素原子に4つのニトロ基が結合した構造です。1857年に、シアノアセトアミドナトリウムと硝酸の反応によって初めて合成されました。[4]
用途
二液推進ロケットの酸化剤としての利用が研究されている。高純度のテトラニトロメタンは爆発しないが、凍結防止剤などの酸化性汚染物質によって爆発感受性が劇的に高まる。[5]また、純物質は凝固点が 高すぎるため、確実に溶融状態を維持することができない。ただし、四酸化二窒素との共晶混合物は-30℃というはるかに低い温度で凍結し、ほぼ純粋なテトラニトロメタンよりも爆発性が低い。[6]しかしながら、この酸化剤は依然として非常に敏感であるため、効果的に利用することは不可能である。[5] [6]
実験室では、有機化合物中の二重結合の検出試薬やニトロ化試薬として使用されます。また、ディーゼル燃料のセタン価を高める添加剤としても使用されています。[7]
準備
TNMは淡黄色の液体で、実験室では無水酢酸を無水硝酸でニトロ化することで調製できます(チャタウェイ法)。[8] この方法は1950年代に米国ニューアークのニトロフォーム・プロダクツ社によって工業規模で試みられましたが、1953年の爆発により工場全体が破壊されました。[9]
最初の工業規模生産は、第二次世界大戦中にドイツで開始されました。ディーゼル燃料のセタン価を向上させるための試みでした。このプロセスは、酢酸と硝酸から始まった当初の方法を改良したものです。[10]収量やコストを考慮せずに、数週間で約10トンのTNMが生産されました。しかし、この製造プロセスは、関連コストが高かったため、戦後、工業的に再び使用されることはありませんでした。[11]
商業利用においては、アセチレンを原料とするより安価な方法が用いられている。[12] まず、硝酸第二水銀(II)を含む硝酸をアセチレンで還元し、トリニトロメタン(ニトロホルム)と二酸化炭素および窒素酸化物の混合物を廃ガスとして生成する。窒素酸化物は貴重な物質であり、通常は吸収塔で硝酸として回収される。得られたニトロホルムは、高温で硝酸と硫酸を加えることでトリニトロメタン(TNM)に変換される。この方法では、精製前の収率は90%(硝酸基準)に達する。[13]
構造

TNMは分子の柔軟性の好例である。TNMの構造決定が70年以上にわたり様々な段階で試みられたという事実からもわかるように、TNMは構造解析手法の適用範囲を限界まで押し上げた。[14]
初期の気体電子回折による研究では、観測された回折パターンを完全に記述することができず、C-N結合を中心とした4つのNO 2基の相関運動に関する4次元モデルを適用することによってのみ、実験観察を完全に記述することができた。この問題は、C-NO 2ユニットの2回対称性とC(NO 2 ) 3ユニットの3回対称性、そしてNO 2基の近接性が自由回転を阻害し、 NO 2基間の非常に複雑な相互干渉運動の原因となるために発生する。
結晶構造についても幾度か試みられてきました。この問題を初めて適切に解決するには、図1に示すような、高温相(>174.4 K)の高度に無秩序な高温結晶相を記述するモデルが必要でした。対称性の低減と結晶の双晶構造の解析により、最終的に図2に示す構造の無秩序性が解消されました。

秩序ある低温相の構造は、非対称単位内に3つの独立した分子を含んでいます。気相と固相の構造パラメータは、比較のために以下の表に示されています。
| パラメータ | GED | XRD(範囲) |
| r C–N | 1.509(5) | 1.502(4) – 1.554(5) |
| r N–O(日食) | 1.201(3) | 1.198(4) – 1.215(5) |
| r N–O(雄鹿) | 1.199(3) | 1.178(5) – 1.222(4) |
| ∡NCN_1 | 105.1(16) | 108.2(3) – 110.9(3) |
| ∡NCN_2 | 111.7(8) | 107.3(3) – 111.4(2) |
| ∡NCN_3 | 106.6(2) – 107.1(3) | |
| ∡小野 | 129.2(17) | 128.0(4) – 132.3(4) |
安全性
TNMの爆発能力は、たとえ少量であっても不純物の存在によって大きく左右されます。TNMは、燃料を化学量論比で添加すると、極めて強力な爆発性混合物を形成します。これらの混合物の多くは、ニトログリセリンよりも高い衝撃感受性を示します。[15]
テトラニトロメタンは、爆発性の高い液体爆薬の成分として、酸化剤として使用されることがあります。あらゆる可燃性物質と爆発性の高い混合物を形成します。この物質の実験を行う際は、ろ過に紙フィルターを使用してはいけません。わずかな不純物であっても、テトラニトロメタンは衝撃や摩擦で爆発する爆薬となります。 1920年にミュンスター大学で行われた悲惨な講義実験はよく知られています。テトラニトロメタン、トルエン、脱脂綿を入れた小さな鋼鉄管が燃え尽きる直前に爆発し、30人以上の学生が負傷し、中には重傷者もいました。[16]しかし、学長室の記録によると、10人もの死亡と12人以上の負傷が記録されています。[17]その後、ドイツ化学技術研究所は爆発速度を毎秒9300メートルと算出しました。その後、アルフレッド・ステットバッハーは、この混合物がヘキソゲン、ペントライト、爆破用ゼラチン、パンクラスタイトよりもはるかに爆発力が強く、すべての爆発物の中で最も破壊力の強いものであることを比較的に証明しました。
TNMはpHが高い状態で水分と反応してトリニトロメタン(ニトロホルム)を生成します。これは金属と容易に反応して非常に不安定で爆発性の高い塩を形成します。[18]
テトラニトロメタンは毒性が非常に強い。わずか2.5mg/kgの吸収でも、メトヘモグロビン血症、肺水腫、肝臓、腎臓、中枢神経系の損傷を引き起こす可能性がある。ヒトに対して発がん性がある可能性も十分に考えられる。[19]
参照
参考文献
- ^ Merck Index、第11版、 9164。
- ^ abcd NIOSH化学物質ハザードポケットガイド。「#0605」。米国国立労働安全衛生研究所(NIOSH)。
- ^ 「テトラニトロメタン」。生命または健康に直ちに危険を及ぼす濃度。米国労働安全衛生研究所。
- ^ LN シシコフ (1857)。 「安全性フルミニクの憲法と、安全性の新たな軍隊の派生」。筋肉と肉体の分析。49 (11): 310.
- ^ ab JG Tschinkel (1956). 「ロケット推進剤における酸化剤としてのテトラニトロメタン」.工業化学および工学化学. 48 (4): 732– 735. doi :10.1021/ie50556a022.
- ^ ab Clark, John Drury (2018年5月23日). Ignition!: An Informal History of Liquid Rocket Propellants. Rutgers University Press. pp. 17– 18. ISBN 978-0-8135-9918-2。
- ^ KV Altukhov, VV Perekalin (1976). 「テトラニトロメタンの化学」.ロシア化学評論. 45 (11): 1052– 1066. Bibcode :1976RuCRv..45.1052A. doi :10.1070/RC1976v045n11ABEH002759. S2CID 250859816.
- ^ Liang, P. (1941). 「テトラニトロメタン」(PDF) .有機合成. 21 : 105;集成第3巻、803ページ。
- ^ Mahoney対Nitroform Co.、114 A.2d 863(NJ Appellate Div 1955)。
- ^ FD Chattaway (1910). 「テトラニトロメタンの簡便な製造法」. Journal of the Chemical Society . 97 : 2099–2102 . doi :10.1039/CT9109702099.
- ^ KF Hager (1949). 「テトラニトロメタン」.工業化学および工学化学. 41 (10): 2168– 2172. doi :10.1021/ie50478a028.
- ^ KJP Orton, PV McKie (1920). 「不飽和炭化水素に対する硝酸の作用。アセチレンに対する硝酸の作用」. Journal of the Chemical Society . 117 : 283– 297. doi :10.1039/CT9201700283.
- ^ Urbanski, Tadeusz (1964).爆発物の化学と技術. 第1巻. Pergamon Press. pp. 589– 594. LCCN 83002261.
- ^ Vishnevskiy, Yury V.; Tikhonov, Denis S.; Schwabedissen, Jan; Stammler, Hans-Georg; Moll, Richard; Krumm, Burkhard; Klapötke, Thomas M.; Mitzel, Norbert W. (2017-08-01). 「テトラニトロメタン:気体および固体状態における分子柔軟性の悪夢」. Angewandte Chemie International Edition . 56 (32): 9619– 9623. doi :10.1002/anie.201704396. PMID 28557111.
- ^ Urbanski, Tadeusz (1964).爆発物の化学と技術. 第1巻. Pergamon Press. p. 593. LCCN 83002261.
- ^ 王立化学協会:ミュンスター大学化学研究所における爆発事故とその原因。J . Chem. Soc., Abstr. , 1920, 118, ii457-ii483. doi:10.1039/CA9201805457
- ^ Universitätsarchiv Münster、NU EI 9 spec.、Explosionsunglück im Chemischen Institut am 27。1920 年 5 月、Rüst、A. Ebert、K. Egli: Unfälle beim chemischen Arbeiten。ラッシャー、1948 年、S. 23。
- ^ Gakh, AA; Bryan, JC; Burnett, MN; Bonnesen, PV (2000). 「いくつかのトリニトロメタニド塩の合成と構造解析」. Journal of Molecular Structure . 520 ( 1–3 ): 221– 228. Bibcode :2000JMoSt.520..221G. doi :10.1016/S0022-2860(99)00333-6.
- ^ 米国国家毒性プログラム(2011). 「テトラニトロメタン」(PDF) .発がん性物質に関する報告書(第12版).米国国家毒性プログラム. 2013年1月31日時点のオリジナルよりアーカイブ(PDF) . 2012年8月14日閲覧.
さらに読む
- シュミット、エッカート・W. (2022). 「テトラニトロメタン」.ニトロメタン.酸化剤百科事典. De Gruyter. pp. 2832– 2860. doi :10.1515/9783110750294-022. ISBN 978-3-11-075029-4。
- シュミット、エッカート・W. (2023). 「モノ推進剤としてのテトラニトロメタン」.有機モノ推進剤.モノ推進剤百科事典. De Gruyter. pp. 1481– 1483. doi :10.1515/9783110751390-010. ISBN 978-3-11-075139-0。
外部リンク
- CN4O8のWebBookページ
- CDC - NIOSH 化学物質の危険性に関するポケットガイド