 トリメチレンメタン、3つの配置の平均。正式には、放射状結合の原子価は4/3 . 各末端炭素は2/3満たされていない原子価結合の
| |
| 名称 | |
|---|---|
| 推奨IUPAC名
2-メチリデンプロパン-1,3-ジイル | |
| その他の名称
トリメチレンメタンビラジカル;トリメチレンメタンジラジカル
| |
| 識別番号 | |
| |
3Dモデル(JSmol)
|
|
PubChem CID
|
|
| |
| |
| 性質 | |
| C4H6 | |
| モル質量 | 54.092 g·mol |
特に記載がない限り、データは標準状態(25℃ [77°F]、100kPa)における物質のものです
| |
トリメチレンメタン(TMMと略されることが多い)は、化学式Cの化合物です
4H
62つの不飽和原子価結合を持つ中性の自由分子であり、したがって反応性の高いフリーラジカルです。正式には、イソブチレン分子Cと見なすことができます
4H
8末端のメチル基から2つの水素原子が除去された
構造
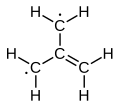
トリメチレンメタンの電子構造は1948年に議論されました。[1] [2]トリメチレンメタンは4つのπ分子軌道を持つ中性の4炭素分子です。約90 K(-183 °C)の固体マトリックスに閉じ込められると、分子の6つの水素原子は等価になります。したがって、両性イオン、またはケクレ構造を与えることができない最も単純な共役炭化水素として記述できます。3つの状態の重ね合わせとして記述できます

|

|
|
これは三重項 基底状態(3 A 2 ′/ 3 B 2)を持ち、したがって厳密な意味でのジラジカルである。 [3]計算によると、三回回転対称性を持つ平面分子で、結合長はおおよそ1.40 Å(C–C)、1.08 Å(C–H)と予測される。各メチレンにおけるH–C–H角は約121°である。[1]
3 つの一重項励起状態のうち、最初の 1 1 A 1 (基底エネルギーより 1.17 eV高い) は、平坦な形状と完全に縮退した 3 倍 ( D 3h ) 対称性を持つ閉殻ジラジカルです。2 番目の 1 1 B 2 (同じく 1.17 eV) は、 3 つの等しい形状の間でD 3h対称平衡を持つ開殻ラジカルです。各形状は、長い C–C 結合 (1.48 Å) と 2 つの短い C–C 結合 (1.38 Å) を持ち、長い方のメチレンが平面から 79° ねじれていることを除いて平坦で左右対称です ( C 2対称性) 。3 番目の一重項状態 2 1 A 1 / 1 A 1 ′ ( 3.88 eV) も、3 つの形状の D 3h 対称平衡です。[1]
次に高いエネルギー状態は、励起電子が1つある縮退三重項1 3 A 1と2 3 B 2 (4.61 eV)と、p軌道が単一の電子で占有されD 3h対称性を持つ五重項状態5 B 2(7.17 eV)である。[1]
製造
トリメチレンメタンは、-196℃(77 K)の凍結した希薄ガラス状溶液中で、窒素を放出しながらジアゾ化合物4-メチレン-Δ1-ピラゾリンを光分解することで初めて得られました。[ 3 ]
3-メチレンシクロブタノンの光分解からも、冷溶液中および単結晶の状態の両方で一酸化炭素を放出しながら得られました。どちらの場合も、電子スピン共鳴分光法によってトリメチレンメタンが検出されました。[3]

トリメチレンメタンは、カリウムを2-ヨードメチル-3-ヨードプロペンとイソブチレンジヨージド(IH)で処理することによっても得られます
2C ) 2 C= CH
2気相では。しかし、生成物はすぐに二量化して1,4-ジメチレンシクロヘキサンを生成し、また他の分子(炭化水素または水素化カリウム)から2つの水素原子を引き抜いて2-メチルプロペンも生成する。[4]
有機金属化学
Fe( C)をはじめとする多くの有機金属錯体が合成されています
4H
6)(CO) 3は、メチレンシクロプロパンを二鉄ノナカルボニル(Fe)で開環して得られたものである
2(CO)9)。[3]同じ錯体は、テトラカルボニル鉄酸二ナトリウム(Na
2Fe (CO) 4 )と1,1-ビス(クロロメチル)エチレン(H2C = C(CH2Cl ) 2 )との反応。[5]関連する反応ではM(TMM)(CO) 4 (M=Cr,Mo)が得られる。(TMM)Mo(CO) 4に至る反応ではMo( C
8H
12二量体化したTMMリガンドを含む)(CO) 3。[5]
TMM錯体は有機合成、特にトリメチレンメタンの環化付加反応における可能性について検討されてきたが、その成功率は中程度にとどまっている。一例として、パラジウム触媒によるトリメチレンメタンの[3+2]環化付加反応が挙げられる。 [6]
-
Ru(トリメチレンメタン)(CO) 3の構造をC3軸に沿って見た図。[7 ]
-
C 3軸に直交して見たRu(トリメチレンメタン)(CO) 3の構造。
参考文献
- ^ abcd Slipchenko Lyudmila V., Krylov Anna I. (2003). 「トリメチレンメタンジラジカルの基底状態および電子励起状態における電子構造:結合、平衡構造、および振動周波数」Journal of Chemical Physics . 118 (15): 6874– 6883. Bibcode :2003JChPh.118.6874S. doi :10.1063/1.1561052. S2CID 4204676
- ^ CA Coulson (1948)、Journal de Chimie Physique et de Physico-Chimie Biologique、第 45 巻、243 ページ。Slipchenko と Krylov が引用 (2003)
- ^ abcd Paul Dowd (1972). 「トリメチレンメタン」. Accounts of Chemical Research . 5 (7): 242–248doi=10.1021/ar50055a003. doi :10.1021/ar50055a003.
- ^ Skell Philip S., Doerr Robert G. (1967). 「トリメチレンメタン」. Journal of the American Chemical Society . 89 (18): 4688– 4692. Bibcode :1967JAChS..89.4688S. doi :10.1021/ja00994a020.
- ^ ab JS Ward & R. Pettit (1970). 「鉄、モリブデン、およびクロムのトリメチレンメタン錯体」Journal of the Chemical Society D (21): 1419– 1420. doi :10.1039/C29700001419.
- ^ バリー・M・トロスト (1979). 「新しい連結試薬.パラジウム(0)触媒によるメチレンシクロペンタン環化反応のための2-アセトキシメチル-3-アリルトリメチルシラン」アメリカ化学会誌. 101 (21): 6429– 6432. Bibcode :1979JAChS.101.6429T. doi :10.1021/ja00515a046.
- ^ Herberich, GE; Spaniol, TP (1993). 「化合物CH 2 =C(CH 2 SnMe 3 ) 2を介したルテニウム、オスミウム、ロジウムのトリメチレンメタン錯体」. Journal of the Chemical Society, Dalton Transactions (16): 2471– 2476. doi :10.1039/DT9930002471.
![Ru(トリメチレンメタン)(CO)3の構造、C3軸に沿って見た図[7]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/82/PETCEWtopView.png/120px-PETCEWtopView.png)
