| |
 | |
| 名前 | |
|---|---|
| IUPAC名
8-メチル-8-アザビシクロ[3.2.1]オクタン-3-オン
| |
| その他の名前
3-トロピノン
| |
| 識別子 | |
3Dモデル(JSmol)
|
|
| チェビ | |
| ケムスパイダー | |
| ドラッグバンク | |
| ECHA 情報カード | 100.007.756 |
PubChem CID
|
|
| ユニイ | |
CompToxダッシュボード (EPA)
|
|
| |
| |
| プロパティ | |
| C 8 H 13 NO | |
| モル質量 | 139.195 g/モル |
| 外観 | 茶色の固体 |
| 融点 | 42.5℃(108.5℉; 315.6 K) |
| 沸点 | (分解する) |
| 危険 | |
| GHSラベル: | |
  [1] [1]
| |
| 危険 | |
| H302、H314 [1] | |
| NFPA 704(ファイアダイヤモンド) | |
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。
| |
トロピノンはアルカロイドの一種で、1917年にロバート・ロビンソンによってアトロピンの合成 前駆体として合成されたことで有名です。アトロピンは第一次世界大戦中に希少資源でした。[2] [3]トロピノンとアルカロイドのコカインおよびアトロピンは、すべて同じトロパン骨格構造を共有しています。pH 7.3における対応する共役酸の主要種はトロピニウムオンとして知られています。[4]
合成
トロピノンの最初の合成は1901年にリチャード・ウィルステッターによって行われた。一見類似しているように見えるシクロヘプタノンから出発したが、窒素架橋を導入するために多くのステップを必要とし、合成経路全体の収率はわずか0.75%であった。 [5]ウィルステッターは以前にもトロピノンからコカインを合成しており、これはコカインの最初の合成と構造の解明であった。[6]

ロビンソンの「ダブル・マンニッヒ」反応
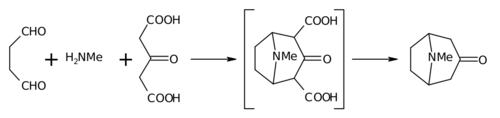
1917年にロビンソンが行った合成法は、その簡便さと生体模倣的アプローチから、全合成における古典的手法とみなされている[8] 。トロピノンは二環式分子であるが、その合成に用いられる反応物は、スクシンアルデヒド、メチルアミン、アセトンジカルボン酸(あるいはアセトン)と非常に単純である。この合成法は、生合成において同一の構成要素が用いられるため、生体模倣反応、あるいは生合成型合成の好例である。また、ワンポット合成におけるタンデム反応であることも実証している。さらに、この合成の収率は17%であったが、その後の改良により90%を超えた[5] 。
この反応は、明らかな理由から分子内「二重マンニッヒ反応」と呼ばれています。この点において、他の研究者もピペリジン合成においてこの反応を試みているため、特異なものではありません。[9] [10]
アセトンの代わりに、アセトンジカルボン酸が「合成同等物」として知られています。1,3-ジカルボン酸基は、環形成反応を促進するためのいわゆる「活性化基」です。カルシウム塩は「緩衝剤」として存在し、反応を「生理的 pH」で行えばより高い収率が得られるとされています。
反応機構
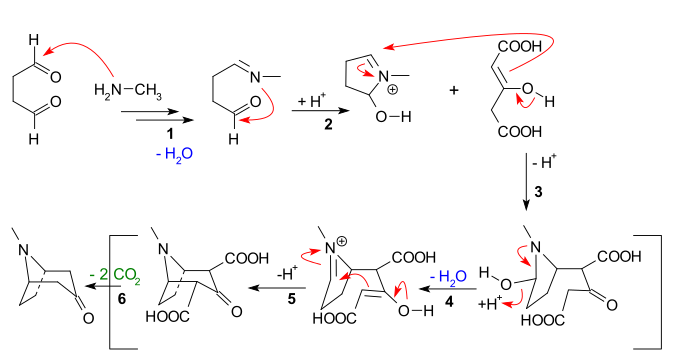
以下の反応シーケンスから明らかな主な特徴は次のとおりです。
- メチルアミンをスクシンアルデヒドに求核付加し、その後水を失ってイミンを生成する
- イミンの2番目のアルデヒドユニットへの分子内付加と最初の閉環
- アセトンジカルボキシレートのエノラートの分子間マンニッヒ反応
- 水の損失を伴う新しいエノラート形成と新しいイミン形成
- 第二分子内マンニッヒ反応と第二環閉環
- トロピノンへの2つのカルボキシル基の喪失
実際にCO2H基の1つを保持しようとした著者もいる。[11]
CO 2 R-トロピノンには 4 つの立体異性体がありますが、対応するエクゴニジンアルキルエステルには 1 組の鏡像異性体しかありません。
シクロヘプタノンから
シクロヘプタノン(スベロン)をIBX脱水素(酸化)して2,6-シクロヘプタジエノン[1192-93-4]とし、続いてアミンと反応させる方法は、トロピノンを形成する汎用的な方法です。[12] [13]引き起こされるメカニズムは、二重マイケル反応(すなわち共役付加)であると明確に描写されています。
生化学的方法
![[icon]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1c/Wiki_letter_w_cropped.svg/20px-Wiki_letter_w_cropped.svg.png) | This section is empty. You can help by adding to it. (April 2022) |
[14]
トロピノンの減少
トロピノンの還元は、複数の植物種で特徴付けられているNADPH依存性還元酵素によって行われます。 [15] これらの植物種はすべて、トロピノン還元酵素Iとトロピノン還元酵素IIの2種類を有しています。TRIはトロピンを、TRIIはシュードトロピンを生成します。酵素の速度論的特性とpH/活性特性の違い、そしてTRIの活性がTRIIの25倍高いことから、トロピノン還元の大部分はTRIからトロピンへの還元です。[16]

参照
参考文献
- ^ ab 「トロピノン」。物質情報。ECHA。
- ^ Robinson R (1917). 「LXIII. トロピノンの合成」. Journal of the Chemical Society, Transactions . 111 : 762–768 . doi :10.1039/CT9171100762.
- ^ Nicolaou KC , Vourloumis D, Winssinger N, Baran PS (2000). 「21世紀幕開けにおける全合成の芸術と科学」. Angewandte Chemie International Edition . 39 (1): 44– 122. doi :10.1002/(SICI)1521-3773(20000103)39:1<44::AID-ANIE44>3.0.CO;2-L. PMID 10649349.
- ^ 生物学的に興味深い化学物質識別コード: ChEBI:57851「トロピニウムオン」
- ^ ab スミット WA、スミット WA、ボチコフ AF、ケープル R (1998)。有機合成。土井:10.1039/9781847551573。ISBN 978-0-85404-544-0。
- ^ Humphrey AJ, O'Hagan D (2001). 「トロパンアルカロイド生合成。1世紀もの間未解決の問題」. Natural Product Reports . 18 (5). Royal Society of Chemistry : 494– 502. doi :10.1039/b001713m. PMID 11699882.
- ^ Doble M, Kruthiventi AK (2007).グリーンケミストリー&エンジニアリング. オックスフォード: エルゼビア. p. 34. ISBN 978-0-12-372532-5。
- ^ Birch AJ (1993). 「科学的伝説の探究:サー・ロバート・ロビンソン(FRS)によるトロピノン合成」.ロンドン王立協会記録. 47 (2): 277– 296. doi :10.1098/rsnr.1993.0034. JSTOR 531792. S2CID 143267467.
- ^ Wang S, Sakamuri S, Enyedy IJ, Kozikowski AP, Deschaux O, Bandyopadhyay BC, Tella SR, Zaman WA, Johnson KM (2000). 「3Dデータベースファーマコフォア探索による新規ドーパミントランスポーター阻害剤、4-ヒドロキシ-1-メチル-4-(4-メチルフェニル)-3-ピペリジル4-メチルフェニルケトンのコカイン拮抗薬としての有用性の発見。分子モデリング、構造活性相関、行動薬理学的研究」Journal of Medicinal Chemistry . 43 (3): 351– 360. doi :10.1021/jm990516x. PMID 10669562.
- ^ Wang S, Sakamuri, Enyedy, Kozikowski, Zaman, Johnson (2001). 「4-ヒドロキシ-1-メチル-4-(4-メチルフェニル)-3-ピペリジル-4-メチルフェニルケトンの新規ドーパミントランスポーター阻害剤としての分子モデリング、構造活性相関、および機能拮抗作用研究」Bioorganic & Medicinal Chemistry 9 ( 7): 1753– 1764. doi :10.1016/S0968-0896(01)00090-6. PMID 11425577.
- ^ Findlay SP (1957). 「2-カルボメトキシトロピノンについて」. Journal of Organic Chemistry . 22 (11): 1385– 1394. doi :10.1021/jo01362a022.
- ^ 米国特許 8,609,690
- ^ Nicolaou KC, Montagnon T, Baran PS, Zhong YL (2002). 「有機合成におけるヨウ素(V)試薬。第4部。一電子移動に基づく酸化プロセスのための化学特異的ツールとしてのO-ヨードキシ安息香酸」アメリカ化学会誌. 124 (10): 2245–58 . doi :10.1021/ja012127+. PMID 11878978.
- ^ Bedewitz MA, Jones AD, D'Auria JC, Barry CS (2018). 「非定型ポリケチド合成酵素とP450を介した環化反応によるトロピノン合成」. Nature Communications . 9 (1): 5281. Bibcode :2018NatCo...9.5281B. doi : 10.1038/s41467-018-07671-3 . ISSN 2041-1723. PMC 6290073. PMID 30538251 .
- ^ A. Portsteffen, B. Draeger, A. Nahrstedt (1992). 「Datura stramoniumの形質転換根培養物由来の2種類のトロピノン還元酵素」. Phytochemistry . 31 (4): 1135. Bibcode :1992PChem..31.1135P. doi :10.1016/0031-9422(92)80247-C.
- ^ Boswell HD, Dräger B, McLauchlan WR, et al. (1999年11月). 「BrugmansiaおよびDaturaにおけるN-アルキルトロパン生合成酵素の特異性」. Phytochemistry . 52 (5): 871–8 . Bibcode :1999PChem..52..871B. doi :10.1016/S0031-9422(99)00293-9. PMID 10626376.
外部リンク
- トロピノンのMSDS