カルシトリオール
 | |
 | |
| 臨床データ | |
|---|---|
| 発音 | 米国: / ˌ k æ l s ɪ ˈ t r aɪ ɒ l / ; [ 1 ] [ 2 ] [ 3 ] [ 4 ] [ 5 ]英国: / k æ l ˈ s ɪ t r i ɒ l / |
| 商号 | ロカルトロール、カルシジェックス、デコストリオール、その他 |
| その他の名前 | 1,25-ジヒドロキシコレカルシフェロール、1α,25-ジヒドロキシビタミンD3、1,25-ジヒドロキシビタミンD3、1α , 25- ( OH ) 2D3、1,25 (OH) 2D [ 6 ] |
| AHFS / Drugs.com | モノグラフ |
| メドラインプラス | a682335 |
| ライセンスデータ | |
| 妊娠カテゴリー |
|
| 投与経路 | 経口、静脈内[ 7 ] |
| ATCコード | |
| 法的地位 | |
| 法的地位 | |
| 薬物動態データ | |
| タンパク質結合 | 99.9% |
| 代謝 | 腎臓 |
| 消失半減期 | 5~8時間(成人)、27時間(小児) |
| 排泄 | 糞便(50%)、尿(16%) |
| 識別子 | |
| |
| CAS番号 |
|
| PubChem CID | |
| IUPHAR/BPS | |
| ドラッグバンク |
|
| ケムスパイダー |
|
| ユニイ | |
| ケッグ | |
| チェビ |
|
| チェムブル |
|
| PDBリガンド | |
| CompToxダッシュボード(EPA) | |
| ECHA 情報カード | 100.046.315 |
| 化学および物理データ | |
| 式 | C 27 H 44 O 3 |
| モル質量 | 416.646 g·mol −1 |
| 3Dモデル(JSmol) | |
| |
| |
| (確認する) | |
カルシトリオールはホルモンであり、ビタミンDの活性型で、通常は腎臓で産生されます。[ 8 ] [ 9 ] [ 10 ] 1,25-ジヒドロキシコレカルシフェロールとしても知られています。カルシトリオールは細胞核内のビタミンD受容体に結合して活性化し、多くの遺伝子の発現を増加させます。 [ 11 ]カルシトリオールは主に腸管からのカルシウムの吸収を増加させることで血中カルシウム濃度を高めます。[ 7 ]
カルシトリオールは、骨粗鬆症、骨軟化症、家族性低リン血症、副甲状腺機能低下症による低血中カルシウム、および腎臓病による低血中カルシウムと副甲状腺機能亢進症の治療薬として投与される。[ 7 ] [ 12 ]経口または静脈注射で摂取できる。[ 7 ]過剰摂取は、脱力感、頭痛、吐き気、便秘、尿路感染症、および腹痛を引き起こす可能性がある。 [ 7 ] [ 12 ]重篤な副作用には、高血中カルシウムやアナフィラキシーがある可能性がある。[ 7 ]
カルシトリオールは1971年にビタミンDの活性型として特定され、1978年に米国で医療用に承認されました。[ 7 ]ジェネリック医薬品として入手可能です。[ 12 ] 2023年には、米国で249番目に処方された薬であり、100万回以上の 処方がありました。[ 13 ] [ 14 ]世界保健機関の必須医薬品リストに掲載されています。[ 15 ]
医療用途
カルシトリオールは以下のような場合に処方されます。[ 16 ]
カルシトリオールは乾癬の治療に軟膏として使用されているが[ 17 ] 、ビタミンD類似体であるカルシポトリオール(カルシポトリエン)の方が一般的に使用されている。[ 18 ]カルシトリオールは乾癬の治療に経口投与されることもある[ 19 ]。また、乾癬性関節炎[ 20 ]の治療にも使用されている。カルシトリオールや他のVDRリガンド類似体の非カルシウム血症作用とその治療への応用可能性に関する研究がレビューされている。[ 21 ]
副作用
カルシトリオール療法に関連する主な副作用は高カルシウム血症です。初期症状には、吐き気、嘔吐、便秘、食欲不振、無気力、頭痛、喉の渇き、掻痒、発汗、多尿などがあります。臨床使用されている他のビタミンD化合物(コレカルシフェロール、エルゴカルシフェロール)と比較して、カルシトリオールは高カルシウム血症を誘発するリスクが高いです。しかし、半減期が比較的短いため、このような症状の発現は短期間で、治療も容易です。[ 16 ]
カルシトリオール値の上昇は、サプリメントを摂取していない患者においても、病状において見られることがあります。高カルシウム血症とカルシトリオール値の上昇を呈する患者では、通常、インタクト副甲状腺ホルモン値が低下します。
カルシトリオール値の上昇による高カルシウム血症の主な病態は、リンパ腫、結核、サルコイドーシスであり、マクロファージで発現する異所性25(OH)D-1-ヒドロキシラーゼ(CYP27B1)により過剰な産生が起こる。[ 22 ] 同様の所見を示す他の病態には以下が含まれる:
- 真菌感染症;ニューモシスチス・イロベチ、ヒストプラズマ症、コクシジオイデス症、パラコクシジオイデス症、カンジダ症
- その他の肉芽腫性疾患:PR3+血管炎、クローン病、急性肉芽腫性肺炎、タルク肉芽腫、シリコーン誘発性肉芽腫、BCG関連肉芽腫性肝炎、パラフィン関連肉芽腫
- 遺伝性疾患:ウィリアムズ症候群、弾性線維性仮性黄色腫、CYP24A1変異(成人/乳児)、SLC34A1変異
- その他; マイコバクテリウム・アビウム、ハンセン病、リポイド肺炎、猫ひっかき病、ベリリウム症
一部の植物には、1,25-ジヒドロキシコレカルシフェロールの配糖体が含まれています。放牧動物がこれらの配糖体を摂取すると、ビタミンD中毒を引き起こし、軟部組織への過剰なカルシウム沈着である石灰沈着症を引き起こします。これらの配糖体を含むことが知られている放牧植物は、 Cestrum diurnum(クストラム・ディウルヌム) 、Solanum malacoxylon(ソラナム・マラコキシロン)、Trisetum flavescens(トリセタム・フラベセンス)の3種です。これらのうち、C. diurnumのみがアメリカ合衆国、主にフロリダ州で見られます。[ 23 ]
作用機序
カルシトリオールは血中カルシウム濃度を上昇させる([ Ca2歳以上]) による:
- 消化管からの食事中のカルシウムの吸収を促進します。
- 尿細管でのカルシウムの再吸収を増加させ、尿中へのカルシウムの損失を減らします。
- 骨からのカルシウムの放出を促進する。このため、骨芽細胞と呼ばれる特定の種類の骨細胞に作用し、 RANKLの放出を促し、それが破骨細胞を活性化する。[ 24 ]
カルシトリオールは、これら3つの役割すべてにおいて、副甲状腺ホルモン(PTH)と協調して作用します。例えば、PTHは間接的に破骨細胞を刺激します。しかし、PTHの主な作用は、腎臓からのCaの対イオンである無機リン酸(P i)の排泄速度を高めることです。2歳以上その結果、血清リン酸値が減少するため、ハイドロキシアパタイト(Ca 5 (PO 4 ) 3 OH)が骨から溶解し、血清カルシウム値が上昇します。また、PTHはカルシトリオールの産生を刺激します(下記参照)。[ 25 ]
カルシトリオールの作用の多くは、ビタミンD受容体またはVDRとも呼ばれるカルシトリオール受容体との相互作用によって媒介されます。 [ 26 ]例えば、腸管上皮細胞におけるカルシトリオール受容体の非結合型不活性型は細胞質に存在します。カルシトリオールが受容体に結合すると、リガンド-受容体複合体は細胞核に移行し、そこでカルシウム結合タンパク質をコードする遺伝子の発現を促進する転写因子として作用します。カルシウム結合タンパク質のレベルが上昇し、細胞はより多くのカルシウム(Ca2歳以上)が腸から腸粘膜を通過して血液中へ移行する。[ 25 ]代替的な非ゲノム経路はPDIA3またはVDRのいずれかを介して媒介される可能性がある。[ 27 ]
電気的中性を維持するには、Ca2歳以上腸管上皮細胞によって触媒されるイオンは、主に無機リン酸などの対イオンを伴う。したがって、カルシトリオールは腸管におけるリン酸の吸収も促進する。[ 25 ]
カルシトリオールが骨からのカルシウム放出を促進するという観察は、血清中のカルシトリオール濃度が十分であれば骨からのカルシウムの全体的な損失は一般的に抑制されることを考えると、矛盾しているように思われる。カルシトリオール刺激による腸管吸収によって血清カルシウム濃度が上昇すると、骨は破骨細胞のホルモン刺激によって失われるカルシウムよりも多くのカルシウムを吸収すると考えられている。[ 25 ]食事性カルシウム欠乏症や腸管輸送の欠陥など、血清カルシウム濃度の減少につながる条件が満たされた場合にのみ、骨からのカルシウムの全体的な損失が起こる。
カルシトリオールはカルシトニンの放出も阻害します。[ 28 ]カルシトニンは主に骨からのカルシウムの放出を阻害することで血中カルシウムを減少させるホルモンです。[ 25 ]
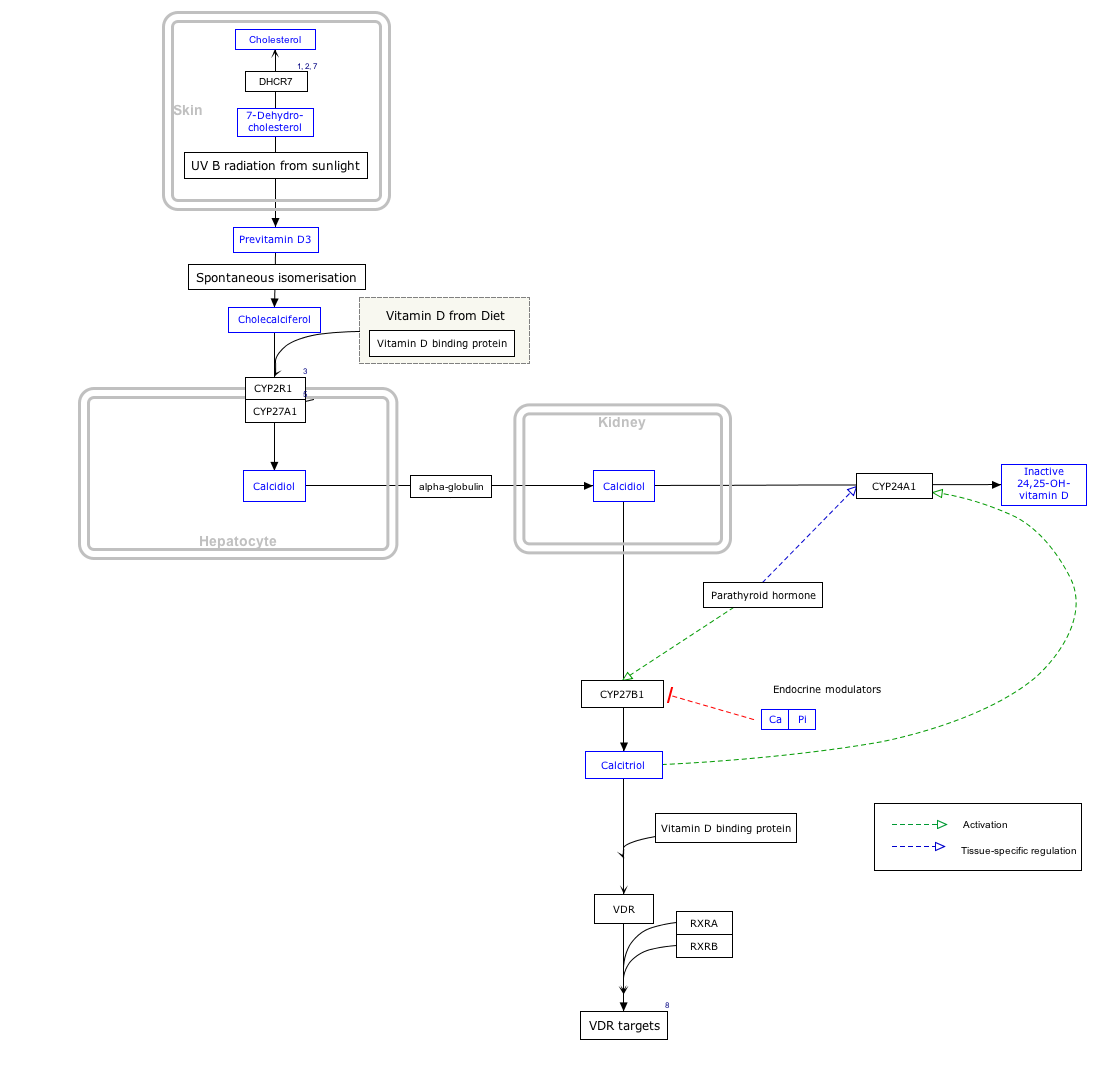
生合成とその制御

カルシトリオールは、腎臓のネフロンの近位尿細管の細胞内で、ミトコンドリアの酸素化酵素であり、25-ヒドロキシコレカルシフェロール(カルシフェジオール)の1-アルファ位の水酸化を触媒する酵素である25-ヒドロキシビタミンD 3 1-アルファ-ヒドロキシラーゼの作用によって生成されます。
この酵素の活性はPTHによって刺激されます。これはCa2 +恒常性維持における重要な制御点です。[ 25 ]カルシトリオール産生への追加的な影響としては、乳腺における乳汁生成(乳汁形成)を刺激するホルモンであるプロラクチンの増加が挙げられます。このプロセスには大量のカルシウムが必要です。[ 29 ]また、血清リン酸値の上昇や骨細胞によるホルモンFGF23の産生増加も、カルシトリオールの活性を低下させます。[ 30 ]
カルシトリオールは腎臓以外にも胎盤や活性化マクロファージなど多くの組織で少量産生される。[ 31 ]
アルファカルシドールという薬剤を使用すると、肝臓での25位水酸化反応により活性代謝物としてカルシトリオールが生成されます。これは、腎臓の1-α-ヒドロキシラーゼを欠損している腎疾患患者において、他のビタミンD前駆体よりも優れた効果をもたらします。[ 32 ]
インタラクティブな経路マップ
以下の遺伝子、タンパク質、代謝物をクリックすると、それぞれの記事にリンクします。[ § 1 ]
- ^インタラクティブなパスウェイマップはWikiPathwaysで編集できます: "VitaminDSynthesis_WP1531"。
代謝
カルシトリオールの体内での半減期は3.5時間[ 33 ]から12~21時間[ 34 ]と報告されており、これはその前駆体であるカルシフェジオールの半減期よりもはるかに短い。カルシフェジオールの半減期は、約15日[ 35 ] および21日[ 36 ]から最大149日および199日と推定されている。[ 37 ]カルシトリオールは、さらに水酸化されて不活性化され、1,24,25-トリヒドロキシビタミンD、カルシトリン酸が形成される。これは、CYP24A1 24-ヒドロキシラーゼの作用を介して起こる。[ 38 ]カルシトリン酸は水に溶けやすく、胆汁および尿中に排泄される。
歴史
1971年にヘクター・デルーカの研究室で働いていたマイケル・F・ホリックによって初めて特定され、[ 39 ] [ 40 ]、またトニー・ノーマンとその同僚によっても特定されました。[ 41 ]
1978年に米国で医療用として承認されました。[ 7 ]
名前
カルシトリオールは、1,25-ジヒドロキシコレカルシフェロールを指します。コレカルシフェロールは既に1つのヒドロキシル基を持っているため、この命名法ではさらに2つ(1,25)のみが指定されますが、実際には3つ(1,3,25-トリオール)あり、カルシトリオールという名称で示されています。1-ヒドロキシ基はα位にあり、これは名称にも明記され、例えば1α,25-(OH) 2 D 3という略語で表されます。[ 6 ]
カルシトリオールは、厳密には、エルゴカルシフェロール(ビタミンD 2 )の水酸化生成物ではなく、コレカルシフェロール(ビタミンD 3 )由来のカルシフェジオール(25-OHビタミンD 3 )の1-ヒドロキシ化生成物である。[ 6 ]ビタミンD 2生成物には、1α,25-ジヒドロキシエルゴカルシフェロール(エルカルシトリオール)を使用するべきである。[ 6 ]しかし、1,25-ジヒドロキシビタミンD、または1,25(OH) 2 Dという用語は、ビタミンDの活性型の両方を指すために使用されることが多い。実際、どちらもビタミンD受容体に結合し、生物学的効果を発揮する。[ 42 ]臨床使用では、これらの違いは大きな重要性を持たないと思われる。[ 32 ]
カルシトリオールは、ロカルトロール(ロシュ)、カルシジェックス(アボット)、デコストリオール(ミベ、ジェサリス)、ベクティカル(ガルデルマ)、およびロルシカル(サンファーマ)など、さまざまなブランド名で医療用医薬品として販売されています。
参考文献
- ^エルゼビア、Dorland's Illustrated Medical Dictionary、エルゼビア。
- ^ Wolters Kluwer、Stedman's Medical Dictionary、Wolters Kluwer。
- ^ Merriam-Webster、Merriam-Webster's Medical Dictionary、Merriam-Webster。
- ^ Houghton Mifflin Harcourt, The American Heritage Dictionary of the English Language、Houghton Mifflin Harcourt、2015年9月25日時点のオリジナルよりアーカイブ。 2015年9月25日閲覧。
- ^ Merriam-Webster、Merriam-Webster's Unabridged Dictionary、 Merriam-Webster、2020年5月25日時点のオリジナルよりアーカイブ。 2015年9月25日閲覧。
- ^ a b c d「 IUPAC-IUB生化学命名法合同委員会(JCBN):ビタミンDの命名法。1981年の勧告」。ヨーロッパ生化学ジャーナル。124 (2):223–227。1982年5月。doi : 10.1111 /j.1432-1033.1982.tb06581.x。PMID 7094913。
- ^ a b c d e f g h「専門家のためのカルシトリオールモノグラフ」 Drugs.com .アメリカ医療システム薬剤師協会. 2019年4月9日閲覧。
- ^ Plum LA, DeLuca HF (2010年12月). 「ビタミンD、疾患、そして治療機会」. Nature Reviews. Drug Discovery . 9 (12): 941– 955. doi : 10.1038/nrd3318 . PMID 21119732. S2CID 8894111 .
- ^内分泌疾患百科事典. アカデミックプレス . 2018年 . 344ページ . ISBN 978-0-12-812200-6。
- ^ 「Office of Dietary Supplements - Vitamin D」 ods.od.nih.gov 2020年10月9日. 2020年10月31日閲覧。
- ^ Norman AW (2008年8月). 「ビタミンDからホルモンDへ:健康に不可欠なビタミンD内分泌系の基礎」 .アメリカ臨床栄養学誌. 88 (2): 491S– 499S. doi : 10.1093/ajcn/88.2.491S . PMID 18689389 .
- ^ a b c英国国立処方集:BNF 76(第76版)。製薬出版社。2018年。1050 ~ 1051頁。ISBN 978-0-85711-338-2。
- ^ 「2023年のトップ300」ClinCalc . 2025年8月12日時点のオリジナルよりアーカイブ。2025年8月12日閲覧。
- ^ 「カルシトリオールの薬物使用統計、米国、2013年~2023年」ClinCalc . 2025年8月20日閲覧。
- ^世界保健機関(2023).必須医薬品の選択と使用 2023: ウェブ付録A: 世界保健機関必須医薬品モデルリスト: 第23次リスト (2023) . ジュネーブ: 世界保健機関. hdl : 10665/371090 . WHO/MHP/HPS/EML/2023.02.
- ^ a b Rossi S (2006). Rossi S (ed.).オーストラリア医薬品ハンドブック. アデレード: Australian Medicines Handbook Pty Ltd. ISBN 978-0-9757919-2-9。
- ^ Kircik L (2009年8月). 「慢性尋常性乾癬に対する新しい局所療法、局所カルシトリオール3μg/g軟膏の有効性と安全性」. Journal of Drugs in Dermatology . 8 (8 Suppl): s9–16. PMID 19702031 .
- ^ Kin KC, Hill D, Feldman SR (2016年6月). 「プラーク型乾癬の局所治療におけるカルシポトリエンとベタメタゾンジプロピオン酸エステル」. Expert Review of Clinical Pharmacology . 9 ( 6): 789– 797. doi : 10.1080/17512433.2016.1179574 . PMID 27089906. S2CID 38261070 .
- ^ Smith EL, Pincus SH, Donovan L, Holick MF (1988年9月). 「乾癬の評価と治療のための新たなアプローチ。1,25-ジヒドロキシビタミンD3の経口または局所投与は、乾癬に対する安全かつ効果的な治療法となり得る」. Journal of the American Academy of Dermatology . 19 (3): 516– 528. doi : 10.1016/S0190-9622(88)70207-8 . PMID 2459166 .
- ^ Huckins D, Felson DT, Holick M (1990年11月). 「経口1,25-ジヒドロキシビタミンD3による乾癬性関節炎の治療:パイロットスタディ」.関節炎とリウマチ. 33 (11): 1723– 1727. doi : 10.1002/art.1780331117 . PMID 2242069 .
- ^ナグパル S、ナ S、ラスナチャラム R (2005 年 8 月)。「ビタミンD受容体リガンドの非カルシウム血症作用」。内分泌のレビュー。26 (5): 662–687。土井: 10.1210/er.2004-0002。PMID 15798098。 。
- ^ Tebben PJ, Singh RJ, Kumar R (2016年10月). 「ビタミンD依存性高カルシウム血症:メカニズム、診断、および治療」 .内分泌レビュー. 37 (5): 521– 547. doi : 10.1210/er.2016-1070 . PMC 5045493. PMID 27588937 .
- ^ 「カルシウム生成グリコシド」 .家畜に有毒な植物. コーネル大学動物科学科. 2021年6月16日閲覧。
- ^ Bringhurst F, Demay MB, Krane SM, Kronenberg HM (2008). 「健康と疾患における骨とミネラル代謝」 . Fauci AS, Braunwald E, Kasper D, Hauser S, Longo D, Jameson J, Loscalzo J (編). Harrison's Principles of Internal Medicine (第17版). McGraw-Hill. ISBN 978-0-07-159991-7。
- ^ a b c d e f Voet D, Voet J (2004). 「生体分子、酵素作用機構、そして代謝」 .生化学. 第1巻(第3版). Wiley. pp. 663–4 . ISBN 978-0-471-25090-6。
- ^ Christakos S, Dhawan P, Verstuyf A, Verlinden L, Carmeliet G (2016年1月). 「ビタミンD:代謝、分子作用機序、そして多面的効果」 .生理学レビュー. 96 (1): 365– 408. doi : 10.1152/physrev.00014.2015 . PMC 4839493. PMID 26681795 .
- ^ Hii CS, Ferrante A (2016年3月). 「ビタミンDの非ゲノム作用」 . Nutrients . 8 ( 3): 135. doi : 10.3390/nu8030135 . PMC 4808864. PMID 26950144 .
- ^ Peleg S, Abruzzese RV, Cooper CW, Gagel RF (1993年8月). 「ビタミンDによるカルシトニン遺伝子転写のダウンレギュレーションには、2つの大きく離れたエンハンサー配列が必要である」 . Molecular Endocrinology . 7 (8). Baltimore, Md.: 999–1008 . doi : 10.1210/mend.7.8.8232320 . PMID 8232320 .
- ^ Ajibade DV, Dhawan P, Fechner AJ, Meyer MB, Pike JW, Christakos S (2010年7月). 「カルシウム恒常性におけるプロラクチンの役割の証拠:プロラクチンによる腸管一過性受容体電位バニロイド6型、腸管カルシウム吸収、および25-ヒドロキシビタミンD(3) 1α水酸化酵素遺伝子の調節」 .内分泌学. 151 (7): 2974– 2984. doi : 10.1210 / en.2010-0033 . PMC 2903940. PMID 20463051 .
- ^ロドリゲス=オルティス ME、ロドリゲス M (2015)。「カルシウム刺激ホルモンとしてのFGF23」。F1000リサーチ。4 : 1472.土井: 10.12688/f1000research.7189.1。PMC 4815615。PMID 27081473。
- ^ Adams JS, Hewison M (2012年7月). 「25-ヒドロキシビタミンD-1-ヒドロキシラーゼの腎外発現」 .生化学・生物理学アーカイブ. 523 (1): 95– 102. doi : 10.1016/j.abb.2012.02.016 . PMC 3361592. PMID 22446158 .
- ^ a b Mazzaferro S, Goldsmith D, Larsson TE, Massy ZA, Cozzolino M (2014年3月). 「ビタミンD代謝物および/または類似体:どの患者にどのDが必要か?」Current Vascular Pharmacology . 12 (2): 339– 349. doi : 10.2174/15701611113119990024 . PMID 23713876 .
- ^ Levine BS, Singer FR, Bryce GF, Mallon JP, Miller ON, Coburn JW (1985). 「正常ヒトにおけるカルシトリオールの薬物動態と生物学的効果」. The Journal of Laboratory and Clinical Medicine . 105 (2): 239– 246. ISSN 0022-2143 . PMID 3838330 .
- ^ Fakih MG, Trump DL, Muindi JR, Black JD, Bernardi RJ, Creaven PJ, 他 (2007年2月15日). 「進行固形腫瘍患者における静脈内カルシトリオールと経口ゲフィチニブの併用療法の第I相薬物動態および薬力学的試験」 . Clinical Cancer Research . 13 (4): 1216– 1223. doi : 10.1158/1078-0432.CCR-06-1165 . ISSN 1078-0432 . PMID 17317832 .
- ^ Jones KS, Assar S, Harnpanich D, Bouillon R, Lambrechts D, Prentice A, et al. (2014年9月1日). 「25(OH)D2の半減期は25(OH)D3の半減期よりも短く、DBP濃度と遺伝子型の影響を受ける」 . The Journal of Clinical Endocrinology and Metabolism . 99 (9 ) : 3373– 3381. doi : 10.1210/jc.2014-1714 . ISSN 0021-972X . PMC 4207933. PMID 24885631 .
- ^ Gray RW, Weber HP, Dominguez JH, Lemann J (1974). 「正常および無腎症患者におけるビタミンD 3 および25-ヒドロキシビタミンD 3 の代謝」 .臨床内分泌・代謝学ジャーナル. 39 (6): 1045–1056 . doi : 10.1210/jcem-39-6-1045 . ISSN 0021-972X . PMID 4372244 .
- ^ Datta P, Philipsen PA, Olsen P, Bogh MK, Johansen P, Schmedes AV, et al. (2017). 「UVB照射後の25(OH)Dの半減期は性別とビタミンD受容体の多型性にも依存するが、主に開始濃度に依存する」 . Photochemical & Photobiological Sciences . 16 (6): 985– 995. Bibcode : 2017PhPhS..16..985D . doi : 10.1039/c6pp00258g . ISSN 1474-905X . PMID 28485745 .
- ^ Jones G, Prosser DE, Kaufmann M (2014年1月). 「シトクロムP450を介したビタミンD代謝」 . Journal of Lipid Research . 55 (1): 13– 31. doi : 10.1194/jlr.R031534 . PMC 3927478. PMID 23564710 .
- ^ Holick MF, Schnoes HK, DeLuca HF, Suda T, Cousins RJ (1971年7月). 「1,25-ジヒドロキシコレカルシフェロールの単離と同定。腸管で活性を示すビタミンDの代謝物」.生化学. 10 (14): 2799– 2804. doi : 10.1021/bi00790a023 . PMID 4326883 .
- ^ Holick MF, Schnoes HK, DeLuca HF (1971年4月). 「腸管で代謝活性を示すビタミンD3の一種、1,25-ジヒドロキシコレカルシフェロールの同定」 . Proceedings of the National Academy of Sciences of the United States of America . 68 (4): 803– 804. Bibcode : 1971PNAS...68..803H . doi : 10.1073 / pnas.68.4.803 . PMC 389047. PMID 4323790 .
- ^ Norman AW, Myrtle JF, Midgett RJ, Nowicki HG, Williams V, Popják G (1971年7月). 「1,25-ジヒドロキシコレカルシフェロール:腸管におけるビタミンD3の活性型候補の同定」. Science . 173 (3991) .ニューヨーク, NY: 51– 54. Bibcode : 1971Sci...173...51N . doi : 10.1126/science.173.3991.51 . PMID 4325863. S2CID 35236666 .
- ^ Cantorna MT, Snyder L, Lin YD, Yang L (2015年4月). 「ビタミンDと1,25(OH)2DによるT細胞調節」 . Nutrients . 7 ( 4): 3011– 3021. doi : 10.3390/nu7043011 . PMC 4425186. PMID 25912039 .