 | |
 | |
| 名称 | |
|---|---|
| IUPAC名
酸化スズ(IV)
| |
| その他の名称
酸化スズ、酸化スズ(IV)、スズの花、[1] スズ石
| |
| 識別番号 | |
3Dモデル(JSmol)
|
|
| ケムスパイダー | |
| ECHA情報カード | 100.038.311 |
| EC番号 |
|
PubChem CID
|
|
| RTECS番号 |
|
| UNII | |
コンプトックスダッシュボード (EPA)
|
|
| |
| プロパティ | |
| O 2 Sn | |
| モル質量 | 150.708 g·mol −1 |
| 外観 | 黄色または薄灰色の粉末[2] |
| 臭い | 無臭 |
| 密度 | 6.95 g/cm 3 (20℃) [3] 6.85 g/cm 3 (24℃) [4] |
| 融点 | 1,630℃ (2,970℉; 1,900 K) [3] [4] |
| 沸点 | 1,800~1,900℃(3,270~3,450°F; 2,070~2,170 K) 昇華[3] |
| 不溶性[4] | |
| 溶解度 | 熱濃アルカリに可溶[4]、濃酸に 不溶[3] |
磁化率(χ)
|
−4.1·10 −5 cm 3 /モル[4] |
屈折率(nD )
|
2.006 [5] |
| 構造 | |
| ルチル 正方晶、tP6 [6] | |
| P4 2 /mnm、No. 136 [6] | |
| 4/m 2/m 2/m [6] | |
a = 4.737 Å、c = 3.185 Å [6] α = 90°、β = 90°、γ = 90°
| |
| 八面体(Sn 4+) 三方平面(O 2−) | |
| 熱化学 | |
熱容量 (℃)
|
52.6 J/mol·K [4] |
| 49.04 J/モル·K [4] [7] | |
標準生成エンタルピー (Δ f H ⦵ 298) |
−577.63 kJ/モル[4] [7] |
ギブスの自由エネルギー (Δ f G ⦵)
|
−515.8 kJ/モル[4] |
| 危険 | |
| NFPA 704(火災ダイヤモンド) | |
| 致死量または濃度(LD、LC): | |
LD 50(中間投与量)
|
> 20 g/kg(ラット、経口)[8] |
| NIOSH(米国健康曝露限界): | |
PEL(許可)
|
なし[2] |
REL(推奨)
|
TWA 2 mg/m 3 [2] |
IDLH(差し迫った危険)
|
ND [2] |
| 安全データシート(SDS) | ICSC 0954 |
| 関連化合物 | |
| 酸化スズ(II) | |
特に記載がない限り、データは標準状態(25℃ [77℉]、100kPa)における物質のものです
| |
酸化スズ(IV)は、酸化スズとも呼ばれ、化学式SnO₂の無機化合物です。SnO₂の鉱物形態は錫石と呼ばれ、スズの主鉱石です。[9]他にも多くの名前で呼ばれるこのスズの酸化物は、スズの化学において重要な物質です。無色、反磁性、両性固体 です
構造

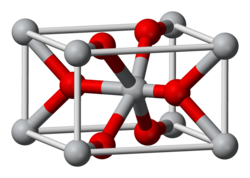
酸化スズ(IV)はルチル型構造で結晶化する。そのため、スズ原子は6配位、酸素原子は3配位となる。[9] SnO 2は通常、酸素欠損型のn型半導体とみなされる。[10]
SnO 2の水和形態はスズ酸として記述されている。このような物質はSnO 2の水和粒子であると考えられており、その組成は粒子サイズを反映している。[11]
製造
酸化スズ(IV)は天然に存在します。合成酸化スズ(IV)は、金属スズを空気中で燃焼させることで生成されます。[11]年間生産量は10キロトン程度です。[11]工業的には、 SnO2は反射炉で1200~1300℃で炭素と反応して金属に還元されます。 [12]
反応
酸化スズ(IV)と高温一酸化炭素の反応は、この炭素熱還元を利用して鉱石から金属スズを得るため、 大規模に実施されています
- SnO 2 + 2 CO → Sn + 2 CO 2
錫を鉱石から精製することに関連する他の反応は以下の通りである:[13]
- SnO 2 + MgCl 2 + CO → SnCl 2 + MgO +CO 2
- 4 SnO 2 + 6 FeCl 2 → 2 SnCl 2 + 2 SnCl 4 + 2 Fe 3 O 4
SnO2は1500℃で一酸化物に変換される:[13]
- 2 SnO 2 → 2 SnO + O 2
SnO 2は水に不溶です。硫酸と溶融水酸化ナトリウムには溶解します。両性ではありません。ルチルと同様に、酸や塩基の溶液には侵されません。
SnO2を硫酸に溶解すると硫酸塩が得られる。[11]
- SnO 2 + 2 H 2 SO 4 → Sn(SO 4 ) 2 + 2 H 2 O
後者の化合物は、追加の硫酸水素配位子を付加して六水素硫酸スズ酸を与えることができる。[14]
SnO 2は溶融アルカリに溶解して「スズ酸塩」となり、その公称化学式はNa 2 SnO 3です。[11]固化したSnO 2 /NaOH溶融物を水に溶かすとNa 2 [Sn(OH) 6 ](「調合塩」)が得られ、これは染色産業で使用されています。[11]
用途
酸化バナジウムと組み合わせて、カルボン酸や酸無水物の合成における芳香族化合物の酸化触媒として使用されます。 [9]
陶磁器の釉薬
SnO 2は、ガラス、エナメル、陶磁器の釉薬の製造において顔料として使用されています。この用途のために、毎年何千トンもの SnO 2が生産されています。純粋な SnO 2は乳白色ですが、他の金属酸化物と混合すると他の色が得られます。例えば、V 2 O 5 は黄色、Cr 2 O 3 はピンク色、Sb 2 O 5 は灰青色になります。[11] [15]この用途が、おそらく、化合物として酸化スズ(IV)を使用して生成された鉛錫黄色顔料の発見につながりました。 [16]酸化スズ(IV) の使用は、特に陶器、衛生陶器、壁タイルの釉薬で一般的です。 「錫釉」および「錫釉陶器」の記事を参照してください。酸化スズは焼成釉薬のガラス質母材中に懸濁状態で留まり、その高い屈折率が母材と十分に異なるため光を散乱させ、釉薬の不透明性を高める。焼成温度の上昇に伴い溶解度が上昇し、不透明性は減少する。[17]酸化スズの釉薬溶融物への溶解度は他の成分にも依存するが、一般的に低い。Na 2 O、K 2 O、B 2 O 3によって溶解度は上昇し、CaO、BaO、ZnO、Al 2 O 3、そしてある程度PbOによって溶解度は低下する。[18]
ガラスコーティング
SnO2コーティングは透明導電性酸化物(TCO)として高く評価されています。他のTCOと同様に、SnO2は優れた導電性を持ちながら透明であるという、珍しい特性の組み合わせです。SnO2でコーティングされた窓は赤外線も反射するため、スマートウィンドウの温度制御に関連します。[19]コーティングは、化学蒸着法、SnCl4 [ 9]または有機スズ三ハロゲン化物[20](例えば、ブチルスズトリクロリドを揮発剤として使用)を使用する蒸着技術 を使用して塗布できます。この技術は、ガラス瓶に薄い(0.1μm未満)SnO2層をコーティングするために使用され、これはポリエチレンなどの後続の保護ポリマーコーティングをガラスに接着するのに役立ちます。[9]
SbまたはFイオンをドープした厚い層は導電性があり、電界発光デバイスや太陽光発電に使用されます。[9]
ガス検知
SnO2は、一酸化炭素検知器を含む可燃性ガスのセンサーとして評価されてきました。これらのセンサーでは、センサー領域が一定温度(数百℃)に加熱され、可燃性ガスが存在すると電気抵抗率が低下します。[21]
歴史的な用途
この錫酸化物は、古代エジプトの時代から染色工程における媒染剤として利用されてきました。 [22] 1533年、クスターという名のドイツ人が初めてロンドンにその使用法を持ち込み、それだけで緋色が生成されました。[23]
この用途の酸化スズ(IV)は、「パテパウダー」[24]または「宝石用パテ」[1]と呼ばれることもあります。
研磨
酸化スズ(IV)は研磨粉として使用され、[11]時には酸化鉛と混合されて、ガラス、宝石、大理石、銀の研磨に使用されます。[1]
参考文献
- 王 春明、王 金鋒、蘇 文斌 (2006).「銅およびニオブドープ酸化スズ(IV)多結晶バリスタの微細構造と電気的特性」アメリカセラミックス協会誌. 89 (8): 2502– 2508. doi :10.1111/j.1551-2916.2006.01076.x[1]
- Dibb A.; Cilense M; Bueno PR; Maniette Y.; Varela JA; Longo E. (2006). 「希土類酸化物ドーピングSnO₂.(Co0.25,Mn0.75)Oベースバリスタシステムの評価」. Materials Research . 9 (3): 339– 343. doi : 10.1590/S1516-14392006000300015 . hdl : 11449/30580
- A. Punnoose; J. Hays; A. Thurber; MH Engelhard; RK Kukkadapu; C. Wang; V. Shutthanandan & S. Thevuthasan (2005). 「FeドーピングによるSnO2の高温強磁性とSnOの常磁性の発現」 . Phys. Rev. B. 72 ( 8) 054402. Bibcode :2005PhRvB..72e4402P. doi :10.1103/PhysRevB.72.054402.
参考文献
- ^ abc 「材質名:酸化スズ」ボストン美術館、 2007年2月10日。2012年11月4日時点のオリジナルよりアーカイブ。2013年3月29日閲覧
- ^ abcd NIOSH化学物質ハザードポケットガイド。「#0616」。米国国立労働安全衛生研究所(NIOSH)。
- ^ abcd CID 29011(PubChemより)
- ^ abcdefghi Lide, David R. 編 (2009). CRC 化学・物理ハンドブック(第90版).フロリダ州ボカラトン:CRC プレス. ISBN 978-1-4200-9084-0。
- ^ Pradyot, Patnaik (2003).無機化学ハンドブック. The McGraw-Hill Companies, Inc. p. 940. ISBN 0-07-049439-8。
- ^ abcd Baur, WH (1956). 「Über die Verfeinerung der Kristallstrukturbestimmung einiger Vertreter des Rutiltyps: TiO2 , SnO2 , GeO2 und MgF2 」 . Acta Crystallographica . 9 (6): 515– 520. Bibcode :1956AcCry...9..515B. doi :10.1107/S0365110X56001388
- ^ ab 酸化スズ、Linstrom, Peter J.、Mallard, William G.(編); NIST Chemistry WebBook、NIST標準参照データベース番号69、米国国立標準技術研究所、ゲイザースバーグ(MD)(2014年7月4日取得)
- ^ ab 「酸化スズ(IV)のMSDS」. fishersci.ca . フィッシャーサイエンティフィック. 2014年7月4日閲覧。
- ^ abcdef グリーンウッド, ノーマン・N. ; アーンショウ, アラン (1984). 元素の化学. オックスフォード:ペルガモン・プレス. pp. 447–48 . ISBN 978-0-08-022057-4。
- ^ 固体化学入門 レスリー・スマート、エレイン・A・ムーア (2005) CRCプレスISBN 0-7487-7516-1
- ^ abcdefgh ホレマン、アーノルド・フレデリック;ウィバーグ、エゴン(2001年)、ウィバーグ、ニルス(編)、無機化学、イーグルソン、メアリー、ブリューワー、ウィリアム訳、サンディエゴ/ベルリン:アカデミック・プレス/デ・グリュイター、ISBN 0-12-352651-5
- ^ 錫:無機化学、JL Wardell著、無機化学百科事典、R. Bruce King編、John Wiley & Son Ltd.、(1995) ISBN 0-471-93620-0
- ^ ab Graf, Günter G. (2000). 「スズ、スズ合金、およびスズ化合物」. Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi :10.1002/14356007.a27_049. ISBN 978-3-527-30385-4。
- ^ グリーンウッド、ノーマン・N. 、アラン・アーンショウ(1984年)。『元素の化学』オックスフォード:ペルガモン・プレス、p.844。ISBN 978-0-08-022057-4。
- ^ 『グレイザーの本』第2版。ABSearle.The Technical Press Limited.ロンドン.1935年。
- ^ ヘルマン・キューン、1967年、「Blei-Zinn-Gelb und seine Verwendung in der Malerei」、 Farbe und Lack 73 : 938-949
- ^ 『陶磁器産業に関する論文集』E.Bourry著。第4版。スコット・グリーンウッド・アンド・サン社。ロンドン。1926年。
- ^ 『セラミック釉薬』第3版。CWParmelee & CGHarman。Cahners Books、マサチューセッツ州ボストン。1973年。
- ^ Batzill, Matthias; Diebold, Ulrike (2005). 「酸化スズの表面および材料科学」. Progress in Surface Science . 79 ( 2–4 ): 47–154 . Bibcode :2005PrSS...79...47B. doi :10.1016/j.progsurf.2005.09.002.
- ^ US 4130673、Larkin, William A.、「ブチルスズ三塩化物を使用してガラスにスズ酸化物を塗布するプロセス」、1978 年 12 月 19 日発行、M & T Chemicals Inc. に譲渡。
- ^ ジョセフ・ワトソン著「酸化スズ半導体ガスセンサー」電気工学ハンドブック第3版、センサーナノサイエンスバイオメディカルエンジニアリングおよび機器編RCドルフCRCプレステイラーアンドフランシスISBN 0-8493-7346-8
- ^ サー・トーマス・エドワード・ソープ著 『化学史』(1909年)第1巻、11~12ページ
- ^ トーマス・モーティマー著『商業・貿易・製造業の一般辞典』(1810年)「染色」
- ^ 無機化学と理論化学、F. シャーウッド・テイラー、ハイネマン、第6版(1942年)


