セルロプラスミン
| CP | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 識別子 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| エイリアス | CP、CP-2、セルロプラスミン(フェロキシダーゼ)、セルロプラスミン、AB073614 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 外部ID | オミム: 117700 ; MGI : 88476 ;ホモロジーン: 75 ;ジーンカード: CP ; OMA : CP - オルソログ | ||||||||||||||||||||||||||||||||||||||||||||||||||
| EC番号 | 1.16.3.1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| ウィキデータ | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
セルロプラスミン(またはセルロプラスミン)は、ヒトではCP遺伝子によってコードされているフェロキシダーゼ酵素である。[ 5 ] [ 6 ] [ 7 ]
セルロプラスミンは血液中の主要な銅運搬タンパク質であり、鉄代謝にも関与している。1948年に初めて報告された[ 8 ]。もう一つのタンパク質であるヘファエスチンはセルロプラスミンと相同性があることで知られており、鉄代謝、そしておそらく銅代謝にも関与している。
関数
セルロプラスミン(CP)は肝臓で合成される酵素(EC 1.16.3.1 )で、その構造内に6つの銅原子を含んでいます。 [ 9 ]セルロプラスミンは健康なヒトの血漿中の総銅の95%以上を運搬します。[ 10 ]残りはマクログロブリンが占めています。セルロプラスミンは銅依存性酸化酵素活性を示し、これはFe 2+(第一鉄)をFe 3+ (第二鉄)に酸化することと関連しており、そのため鉄を第二鉄の状態でのみ運搬できるトランスフェリンと関連して血漿中での輸送を助けます。[ 11 ] ヒトセルロプラスミンの分子量は151kDaと報告されています。
広範な研究にもかかわらず、CPの正確な機能については未だ多くのことが解明されていません。しかし、その機能の多くは、銅中心の存在に着目したCPに起因すると考えられています。これらの機能には、銅を肝外組織へ輸送する銅輸送、腸液および血漿中の生体アミン濃度を制御するアミン酸化酵素活性、血漿からの酸素およびその他のフリーラジカルの除去、そしてトランスフェリンを介した輸送のために細胞から鉄を排出することが含まれます。[ 12 ]
突然変異により CP への銅の結合が阻害され、鉄代謝が阻害されて鉄過剰症を引き起こすことが知られています。
セルロプラスミンは比較的大きな酵素(約 10 nm)であり、サイズが大きいため、輸送中に結合した銅が人の尿中に失われるのを防ぎます。
活性部位構造
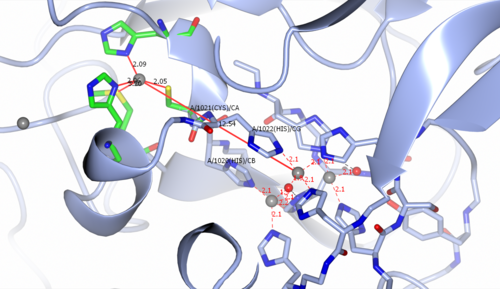
CP の多銅活性部位には、タイプ I (T1) 単核銅[ 12 ]部位と、約 12-13 Å 離れた三核銅中心が含まれています (図 2 を参照)。三核銅中心は、2 つのタイプ III (T3) 銅と 1 つのタイプ II (T2) 銅イオンで構成されています。2 つの T3 銅イオンは水酸化物リガンドによって架橋され、もう 1 つの水酸化物リガンドは T2 銅イオンをタンパク質に結合します。T1 中心は、2 つのヒスチジン(His1020、His1022) 残基と 1 つのCys (1021) 残基によって三銅中心に架橋されています。基質は T1 中心の近くに結合し、T1 Cu 2+イオンによって酸化されて還元された Cu +酸化状態を形成します。基質から銅中心に4つの電子が移動した後、O2が三銅中心に結合し、4電子還元を受けて2つの水分子を形成する。[ 12 ]
規制
GAITエレメントと呼ばれるシス調節エレメントは、セロプラスミン転写産物の選択的翻訳サイレンシングに関与している。[ 13 ] このサイレンシングには、IFN-γ活性化翻訳阻害剤(GAIT)と呼ばれる細胞質阻害複合体がGAITエレメントに結合することが必要である。[ 14 ]
臨床的意義
他の血漿タンパク質と同様に、肝疾患患者では合成能力の低下によりレベルが低下します。
セルロプラスミン値が低下するメカニズム:
- 遺伝子発現が遺伝的に低い(無セルロプラスミン血症)
- 銅のレベルは全体的に低い
- 銅はATP7A欠乏症(メンケス病および後頭角症候群)により腸管バリアを通過できない
- 肝細胞ではATP7Bが欠損しているため、ER-ゴルジ体ネットワークの内腔への銅の送達が欠損している(ウィルソン病)
銅の利用可能性は新生タンパク質の翻訳に影響を与えません。しかし、銅を含まないアポ酵素は不安定です。アポセルロプラスミンは肝細胞内で大部分が分解され、放出される少量のアポセルロプラスミンの循環半減期は5時間と短く、ホロセルロプラスミンの5.5日と比較して短いです。
セルロプラスミンは血液検査で測定できます。[ 15 ]免疫測定法を用いて測定できます。検体は遠心分離し、4℃前後で3日間保存します。この検査はウィルソン病の兆候があるかどうかを判定するためのものです。他に実施できる検査として尿中銅濃度検査がありますが、これは血液検査よりも精度が低いことが分かっています。肝組織検査も実施可能です。
セルロプラスミン遺伝子(CP)の変異は非常に稀ですが、鉄過剰を伴う高フェリチン血症を特徴とする遺伝性疾患、無セルロプラスミン血症を引き起こす可能性があります。脳においては、この鉄過剰により、小脳性運動失調、進行性認知症、錐体外路症状といった特徴的な神経学的徴候や症状が現れることがあります。また、過剰な鉄は肝臓、膵臓、網膜に沈着し、それぞれ肝硬変、内分泌異常、視力喪失 を引き起こすこともあります。
欠乏
セルロプラスミン値が正常値より低い場合は、次のことが考えられます。
- ウィルソン病(まれな銅蓄積症[英国での発生率2/100,000])。[ 16 ]
- メンケス病(メンケス縮毛症候群) (まれ - 英国での発生率 1/100,000)
- 銅欠乏症
- 無セルロプラスミン血症[ 17 ]
- 亜鉛毒性
過剰
セルロプラスミン値が正常範囲を超える場合、以下の症状が現れることがあります。
- 銅中毒/亜鉛欠乏症
- 妊娠
- 経口避妊薬の使用[ 18 ]
- リンパ腫
- 急性および慢性炎症(急性期反応物質である)
- 関節リウマチ
- 狭心症[ 19 ]
- アルツハイマー病[ 20 ]
- 統合失調症[ 21 ]
- 強迫性障害[ 22 ]
基準範囲
ヒトの血中セルロプラスミンの正常濃度は20~50 mg/dLです。

参考文献
- ^ a b c GRCh38: Ensemblリリース89: ENSG00000047457 – Ensembl、2017年5月
- ^ a b c GRCm38: Ensemblリリース89: ENSMUSG00000003617 – Ensembl、2017年5月
- ^ 「ヒトPubMedリファレンス:」。米国国立医学図書館、国立生物工学情報センター。
- ^ 「マウスPubMedリファレンス:」。米国国立医学図書館、国立生物工学情報センター。
- ^ Takahashi N, Ortel TL, Putnam FW (1984年1月). 「ヒトセルロプラスミンの単鎖構造:分子全体の完全なアミノ酸配列」 . Proceedings of the National Academy of Sciences of the United States of America . 81 ( 2 ): 390–4 . Bibcode : 1984PNAS...81..390T . doi : 10.1073/pnas.81.2.390 . PMC 344682. PMID 6582496 .
- ^ Koschinsky ML , Funk WD, van Oost BA, MacGillivray RT (1986年7月). 「ヒトプレセルロプラスミンの完全cDNA配列」 . Proceedings of the National Academy of Sciences of the United States of America . 83 (14): 5086–90 . Bibcode : 1986PNAS...83.5086K . doi : 10.1073 / pnas.83.14.5086 . PMC 323895. PMID 2873574 .
- ^ Royle NJ, Irwin DM, Koschinsky ML, MacGillivray RT, Hamerton JL (1987年5月). 「ヒトのプロトロンビンおよびセルロプラスミンをコードする遺伝子は、それぞれ11p11-q12および3q21-24にマッピングされる」.体細胞および分子遺伝学. 13 (3): 285–92 . doi : 10.1007/BF01535211 . PMID 3474786. S2CID 45686258 .
- ^ Holmberg CG, Laurell CB (1948). 「血清中の銅に関する研究 II. 銅含有タンパク質の単離とその特性の説明」 Acta Chem Scand . 2 : 550–56 . doi : 10.3891/acta.chem.scand.02-0550 .
- ^ O'Brien PJ, Bruce WR (2009). 『内因性毒素:疾患治療・予防のターゲット』全2巻セット. John Wiley & Sons. pp. 405–6 . ISBN 978-3-527-32363-0。
- ^ Hellman NE, Gitlin JD (2002). 「セルロプラスミンの代謝と機能」. Annual Review of Nutrition . 22 : 439–58 . doi : 10.1146/annurev.nutr.22.012502.114457 . PMID 12055353 .
- ^ Song D, Dunaief JL (2013). 「健康と疾患における網膜鉄恒常性」 . Frontiers in Aging Neuroscience . 5 : 24. doi : 10.3389/fnagi.2013.00024 . PMC 3695389. PMID 23825457 .
- ^ a b c Bertini I (2007).生物無機化学. カリフォルニア州, 米国: University Science Books. pp. 426– 442. ISBN 978-1-891389-43-6。
- ^ Sampath P, Mazumder B, Seshadri V, Fox PL (2003年3月). 「γインターフェロンによる転写選択的翻訳サイレンシングは、セルロプラスミンmRNA 3'非翻訳領域における新規構造要素によって制御される」 . Molecular and Cellular Biology . 23 (5): 1509–19 . doi : 10.1128/MCB.23.5.1509-1519.2003 . PMC 151701. PMID 12588972 .
- ^ Mazumder B, Sampath P, Fox PL (2005年10月). 「マクロファージセルロプラスミン遺伝子発現の制御:3'-UTRを介した翻訳制御の一つのパラダイム」 . Molecules and Cells . 20 (2): 167–72 . doi : 10.1016/S1016-8478(23)13213-4 . PMID 16267389 .
- ^ 「セルロプラスミン検査:MedlinePlus医療検査」 medlineplus.gov 2021年12月10日閲覧。
- ^ Scheinberg IH, Gitlin D (1952年10月). 「肝レンズ核変性症(ウィルソン病)患者におけるセルロプラスミン欠乏症」. Science . 116 (3018): 484–5 . Bibcode : 1952Sci...116..484S . doi : 10.1126/science.116.3018.484 . PMID 12994898 .
- ^ Gitlin JD (1998年9月). 「アセルロプラスミン血症」 .小児研究. 44 (3): 271–6 . doi : 10.1203/00006450-199809000-00001 . PMID 9727700 .
- ^ Elkassabany NM, Meny GM, Doria RR, Marcucci C (2008年4月). 「グリーンプラズマの再考」 .麻酔学. 108 (4): 764–5 . doi : 10.1097/ALN.0b013e3181672668 . PMID 18362615 .
- ^ジアカス A、ガブリリディス S、ソウリウ E、ジャンノグロウ G、スティリアディス I、カルヴォニス H、エフティミアディス G、モクラス S、ヴァヨナ MA、ハッツィトリオス A、サヴォプロス C、ピドニア I、パラハリディス G (2009)。 「重度の不安定狭心症患者において、セルロプラスミンはフィブリノーゲン、CRP、IL-6と比較して長期予後をより良く予測します。」血管学。60 (1): 50–9 .土井: 10.1177/0003319708314249。PMID 18388036。S2CID 843454。
- ^ Lutsenko S, Gupta A, Burkhead JL, Zuzel V (2008年8月). 「細胞のマルチタスク:補因子送達と細胞内銅バランスにおけるヒトCu-ATPaseの二重の役割」 .生化学・生物理学アーカイブ. 476 (1): 22– 32. doi : 10.1016/j.abb.2008.05.005 . PMC 2556376. PMID 18534184 .
- ^ Wolf TL, Kotun J, Meador-Woodruff JH (2006年9月). 「統合失調症における血漿中の銅、鉄、セルロプラスミン、およびフェロキシダーゼ活性」. 統合失調症研究. 86 ( 1–3 ): 167–71 . doi : 10.1016/j.schres.2006.05.027 . PMID 16842975. S2CID 38267889 .
- ^ Virit O, Selek S, Bulut M, Savas HA, Celik H, Erel O, Herken H (2008). 「高セルロプラスミン値は強迫性障害と関連する:症例対照研究」 .行動と脳機能. 4 52. doi : 10.1186/1744-9081-4-52 . PMC 2596773. PMID 19017404 .
さらに読む
- Hellman NE, Gitlin JD (2002). 「セルロプラスミンの代謝と機能」. Annual Review of Nutrition . 22 : 439–58 . doi : 10.1146/annurev.nutr.22.012502.114457 . PMID 12055353 .
- Mazumder B, Seshadri V, Fox PL (2003年2月). 「3'-UTRによる翻訳制御:目的が手段を特定する」. Trends in Biochemical Sciences . 28 (2): 91–8 . doi : 10.1016/S0968-0004(03)00002-1 . PMID 12575997 .
- Giurgea N、Constantinesc MI、Stanciu R、Suciu S、Muresan A (2005 年 2 月)。 「セルロプラスミン - 急性期反応物か、それとも内因性抗酸化物質か?心血管疾患の場合」。医療科学モニター。11 (2):RA48-51。PMID 15668644。
- Kingston IB, Kingston BL, Putnam FW (1977年12月). 「タンパク質分解による切断がヒトセルロプラスミン標本に存在する不均一性の原因であるという化学的証拠」 .米国科学アカデミー紀要. 74 (12): 5377–81 . Bibcode : 1977PNAS...74.5377K . doi : 10.1073/pnas.74.12.5377 . PMC 431726. PMID 146197 .
- Polosatov MV, Klimov PK, Masevich CG, Samartsev MA, Wünsch E (1979年4月). 「合成ヒトビッグガストリンとヒトおよび動物の血液タンパク質との相互作用」. Acta Hepato-Gastroenterologica . 26 (2): 154–9 . PMID 463490 .
- シルスキー ML、ストッカート RJ、ポラード JW (1992 年 12 月)。「ヒト子宮によるセルロプラスミン生合成」。生化学ジャーナル。288 (2): 657–61 .土井: 10.1042/bj2880657。PMC 1132061。PMID 1463466。
- Walker FJ, Fay PJ (1990年2月). 「プロテインCとセルロプラスミンの相互作用の特性評価」 . The Journal of Biological Chemistry . 265 (4): 1834–6 . doi : 10.1016/S0021-9258(19)39903-X . PMID 2105310 .
- Fleming RE, Gitlin JD (1990年5月). 「ラットセルロプラスミンの一次構造と発生過程における組織特異的遺伝子発現の解析」 . The Journal of Biological Chemistry . 265 (13): 7701–7 . doi : 10.1016/S0021-9258(19)39171-9 . PMID 2332446 .
- Yang FM, Friedrichs WE, Cupples RL, Bonifacio MJ, Sanford JA, Horton WA, Bowman BH (1990年6月). 「ヒトセルロプラスミン.選択的スプライシングによって産生される転写産物の組織特異的発現」 . The Journal of Biological Chemistry . 265 (18): 10780–5 . doi : 10.1016/S0021-9258(18)87015-6 . PMID 2355023 .
- Yang F, Naylor SL, Lum JB, Cutshaw S, McCombs JL, Naberhaus KH, McGill JR, Adrian GS, Moore CM, Barnett DR (1986年5月). 「ヒトセルロプラスミン遺伝子の特性評価、マッピング、および発現」 .米国科学アカデミー紀要. 83 (10): 3257–61 . Bibcode : 1986PNAS...83.3257Y . doi : 10.1073 / pnas.83.10.3257 . PMC 323492. PMID 3486416 .
- Mercer JF, Grimes A (1986年7月). 「N末端リーダー配列を含むヒトセルロプラスミンcDNAクローンの単離」. FEBS Letters . 203 (2): 185–90 . Bibcode : 1986FEBSL.203..185M . doi : 10.1016/0014-5793(86)80739-6 . PMID: 3755405. S2CID : 23472934 .
- Rask L, Valtersson C, Anundi H, Kvist S, Eriksson U, Dallner G, Peterson PA (1983年1月). 「正常およびビタミンA欠乏ラット肝臓におけるビタミンA血清輸送タンパク質、アルブミン、セルロプラスミン、クラスI主要組織適合抗原の細胞内局在」. Experimental Cell Research . 143 (1): 91– 102. doi : 10.1016/0014-4827(83)90112-X . PMID 6337857 .
- Kressner MS, Stockert RJ, Morell AG, Sternlieb I (1984). 「胆汁中銅の起源」.肝臓学. 4 (5): 867–70 . doi : 10.1002/hep.1840040512 . PMID 6479854. S2CID 43824397 .
- 高橋 暢, Bauman RA, Ortel TL, Dwulet FE, Wang CC, Putnam FW (1983年1月). 「ヒトセルロプラスミンの構造における内部三重化」 .米国科学アカデミー紀要. 80 (1): 115–9 . Bibcode : 1983PNAS...80..115T . doi : 10.1073 / pnas.80.1.115 . PMC 393320. PMID 6571985 .
- Dwulet FE, Putnam FW (1981年2月). 「ヒトセルロプラスミンの50,000ダルトン断片の完全アミノ酸配列」 .米国科学アカデミー紀要. 78 (2): 790–4 . Bibcode : 1981PNAS...78..790D . doi : 10.1073/ pnas.78.2.790 . PMC 319888. PMID 6940148 .
- Kingston IB, Kingston BL, Putnam FW (1980年4月). 「ヒトセルロプラスミンのヒスチジンに富むタンパク質分解断片の一次構造.I. 臭化シアンペプチドのアミノ酸配列」 . The Journal of Biological Chemistry . 255 (7): 2878–85 . doi : 10.1016/S0021-9258(19)85822-2 . PMID 6987229 .
外部リンク
- GeneReviews/NCBI/NIH/UWの無セルロプラスミン血症に関するエントリ
- アセルロプラスミン血症に関する OMIM エントリ
- PDBe-KBのUniProt : P00450 (ヒトセルロプラスミン)のPDBで利用可能なすべての構造情報の概要。