VDAC1
| VDAC1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 識別子 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| エイリアス | VDAC1、ポリン、VDAC-1、電圧依存性アニオンチャネル1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 外部ID | オミム: 604492 ; MGI : 106919 ;ホモロジーン: 107244 ;ジーンカード: VDAC1 ; OMA : VDAC1 - オルソログ | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| ウィキデータ | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
電圧依存性陰イオン選択性チャネル1(VDAC-1)は、ヒトでは5番染色体に位置するVDAC1遺伝子によってコードされるβバレルタンパク質である。[ 4 ] [ 5 ]これは、ミトコンドリア外膜(OMM)および細胞外膜にイオンチャネルを形成する。OMMでは、ATPがミトコンドリアから細胞質へ拡散することを可能にする。細胞膜では、容積調節に関与する。すべての真核細胞において、ミトコンドリアは細胞の生存に必要なATPをはじめとする代謝物の合成を担っている。したがって、VDAC1はミトコンドリアと細胞間のコミュニケーションを可能にし、細胞代謝と細胞死のバランスを仲介する。代謝透過に加えて、VDAC1はヘキソキナーゼなどのタンパク質の足場としても機能し、代謝を調節する。[ 6 ]
このタンパク質は電圧依存性アニオンチャネルであり、細胞代謝、ミトコンドリアのアポトーシス、精子形成の調節に関与する他の VDAC アイソフォーム(VDAC2およびVDAC3 )と高い構造相同性を共有しています。 [ 7 ] [ 8 ] [ 9 ] [ 10 ]この細孔の過剰発現と誤調節は、細胞内でアポトーシスを引き起こし、体内でさまざまな疾患を引き起こす可能性があります。特に、 VDAC1 は主要なカルシウムイオン輸送チャネルであるため、その機能不全は癌、パーキンソン病(PD)、およびアルツハイマー病に関連しています。[ 11 ] [ 12 ] [ 13 ]さらに、最近の研究では、 VDAC1 タンパク質内の過剰発現が 2 型糖尿病に関連していることが示されています。 ルンド大学は、 VDAC1 過剰発現を阻害すると 2 型糖尿病の蔓延を防ぐことができることを実証した研究を発表しました。[ 14 ]

構造

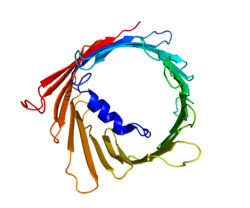
3 つの VDAC アイソフォーム (VDAC1、VDAC2、および VDAC3) は、DNA 配列が高度に保存されているだけでなく、幅広い β バレル構造を形成する 3D 構造を持ち、その内部にアルファヘリックス N 末端セグメントが存在して部分的に細孔を閉じています。[ 15 ] VDAC1 の構造は、3 つの独立した研究室によってX 線結晶構造解析、核磁気共鳴 (NMR) 分光法、またはその両方の組み合わせによって解明されました。これらの構造研究のうち 2 つはヒト VDAC1 (hVDAC1) の構造を決定するために使用され、X 線結晶構造解析は hVDAC1 とわずか 2 残基しか異なるマウス VDAC1 (mVDAC1) の構造を解明するために使用されました。[ 16 ] [ 17 ] [ 18 ]これらの決定された構造は、アルファヘリックスおよび β ストランドドメインの存在を予測した以前の円二色性研究と一致していました。[ 19 ]
mVDAC1の構造を構造解析したところ、19本の両親媒性βストランドから構成される樽状のチャネルを形成し、N末端とC末端はともにミトコンドリアの膜間スペースに面していることが示された。[ 20 ] [ 21 ] βストランドはループで接続され、βストランド1と19は平行であるものの、それ以外は反平行パターンで配置されている。[ 18 ]細孔の高さは40 Ẳで、開口部で27 Ẳ x 20 Ẳの距離に広がり、開状態のN末端αヘリックス部分で20 Ẳ x 14 Ẳまで細くなる。[ 22 ]閉状態の構造はまだ分離されておらず、決定されていない。さらに、N末端にはαヘリックスセグメントがあり、βシート8-18上の残基との疎水性相互作用によって細孔の内壁に保持されている。[ 18 ]このN末端は、イオンの移動やタンパク質の付着のための足場として機能する。その一例は、HK1結合のドッキング部位であることが知られている。[ 6 ]注目すべき重要な残基は、アミノ酸鎖の73番目の残基(E73)に位置するグルタミン酸である。この残基はVDAC1とVDAC2には存在するが、VDAC3には存在しない。この荷電残基の側鎖はリン脂質二重層に向いており、通常は反発力が生じる。しかし、E73はVDAC1の機能と相互作用に関与していることが示唆されている。[ 23 ]
関数
VDAC1はミトコンドリアポリンファミリーに属し、他のVDACアイソフォームと同様の生物学的機能を有することが期待されています。[ 24 ] 3つのアイソフォームのうち、VDAC1はミトコンドリアにおける主要なカルシウムイオン輸送チャネルであり、最も多く転写されています。[ 12 ] [ 25 ] VDAC1は、ミトコンドリア外膜(OMM)を介してATPやその他の小さな代謝物を輸送することで細胞代謝に関与し、TCAサイクルの調節、ひいては活性酸素種(ROS)産生の制御を可能にします。[ 11 ]酵母細胞では、酸化ストレス条件下でROSが蓄積し、ミトコンドリア機能の障害と「プチ」表現型を引き起こします。しかし、プチ酵母細胞は野生型細胞よりも寿命が長く、老化などの同様の状況においてVDAC1による保護機能が示唆されています。[ 6 ] [ 25 ]
電圧ゲーティング
VDAC1は、ミトコンドリアへの分子の出入りを司ります。その透過性は、電圧によって決定されるVDAC1の構造状態に依存します。低電圧(10mV)では、細孔は「開」状態にあり、チャネルは弱陰イオン選択性を示し、代謝物の流量が増加します。大きな細孔サイズのため、飽和ATP条件下での代謝ゲーティングでは、毎秒200万ATP、生理学的条件下では毎秒1万ATPの輸送が可能であることが示されています。[ 26 ]正または負方向のより高い電圧(>30mV)では、細孔は「閉」状態にあり、弱陽イオン選択性を示し、輸送される代謝物の量は減少します。[ 18 ]代謝物の流量はごくわずかです。この状態変化は、未だ解明されていないタンパク質の構造変化によって媒介されます。 αヘリックスN末端セグメントは細孔の中心に位置しているため、代謝ゲーティングに理想的な位置にあります。このことから、研究者たちはαヘリックスがコンフォメーション状態を決定する上で重要な役割を果たしていると考えていました。しかし、最近の研究では、N末端は適切な電位ゲーティングには不要であることが示されており、柔軟なβバレルがコンフォメーション変化のメカニズムであることが示唆されています。[ 22 ]
オリゴマー化
原子間力顕微鏡(AFM)により、VDAC1モノマーだけでなく、ダイマーやより大きなオリゴマーの存在が明らかになり、細孔同士の相互作用が示されていますが、ダイマーの方が頻繁に見られます。[ 27 ]特にhVDAC1はダイマーを平行に形成して細孔の透過性を高めることが示されています。[ 16 ] VDAC1の73番目の位置にあるグルタミン酸も、カルシウム存在下でオリゴマー化に関与することが示されています。[ 23 ] VDACはオリゴマー化してミトコンドリア膜透過性遷移孔(MPTP)の一部を形成し、シトクロムCの放出を促進してアポトーシスを誘導することもできます。VDACは、Bcl-2ファミリータンパク質やキナーゼなどのアポトーシス促進タンパク質や抗アポトーシスタンパク質と相互作用することも観察されているため、MPTPとは独立してアポトーシスに寄与している可能性があります。[ 24 ]
臨床的意義
電圧依存性アニオンチャネルは、それぞれ生理学的役割が異なりますが、いずれもイオンおよび代謝物の輸送に関与しています。その役割ゆえに、チャネルの機能不全は様々な疾患につながる可能性があります。VDAC1は、抗アポトーシスファミリータンパク質であるBcl-2タンパク質、特に癌において過剰発現するBcl-xlおよびMcl-1との相互作用を通じて、癌への関与が示唆されています。これら2つのBcl-2タンパク質はVDAC1と相互作用し、OMMを介したカルシウムイオン輸送、ひいてはROS産生を制御します。高レベルのROSは細胞死を誘導しますが、致死的ではないレベルのROSはシグナル伝達経路を阻害し、癌細胞における細胞増殖、遊走、浸潤を促進します。[ 11 ]さらに、VDAC1の過剰発現は、アポトーシス応答の増加、抗癌剤および治療効果の増加と関連しており、VDAC1が癌治療における治療標的であることをさらに裏付けています。[ 11 ] [ 28 ]
VDAC1のカルシウムイオン輸送機能は、神経変性疾患にも関連付けられています。パーキンソン病(PD)では、VDAC1がミトコンドリア内のカルシウムイオン濃度を上昇させ、ミトコンドリア透過性の増加、ミトコンドリア膜電位の異常、活性酸素種(ROS)産生の増加、細胞死、神経変性を引き起こします。[ 12 ] VDAC1はアミロイドβ(Aβ)と相互作用し、チャネルの伝導性を高め、最終的には細胞のアポトーシスを引き起こすことが示されています。[ 13 ]ハンチントン病の実験モデルでは、VDACを標的とする化合物であるオレソキシムによる治療により、カルシウム恒常性とカルシウム依存性カルパインプロテアーゼの活性を調節することで、疾患関連表現型が改善されました。 [ 29 ] [ 30 ] [ 31 ]
相互作用
VDAC1 は多くのタンパク質の足場として機能し、また細孔内の相互作用を通じてイオンや代謝物の流動を可能にします。
このチャネルを通過する主要な代謝物はATPです。この分子の高速輸送に用いられる低親和性結合部位は、マルコフ状態モデリングアプローチによって発見されました。ATPは細孔内の複数の塩基残基に順次結合し、本質的にチャネルを通過することが示されました。[ 32 ]
VDAC1 は以下とも相互作用することが示されています。
参照
参考文献
- ^ a b c GRCm38: Ensemblリリース89: ENSMUSG00000020402 – Ensembl、2017年5月
- ^ 「ヒトPubMedリファレンス:」。米国国立医学図書館、国立生物工学情報センター。
- ^ 「マウスPubMedリファレンス:」米国国立医学図書館、国立生物工学情報センター。
- ^ Blachly-Dyson E, Baldini A, Litt M, McCabe ER, Forte M (1994年3月). 「ミトコンドリア外膜の電圧依存性アニオンチャネル(VDAC)をコードするヒト遺伝子:2つの新規アイソフォームのマッピングと同定」. Genomics . 20 (1): 62– 67. doi : 10.1006/geno.1994.1127 . PMID 7517385 .
- ^ 「Entrez Gene:VDAC1 電圧依存性アニオンチャネル 1」。
- ^ a b c d Reina S, Palermo V, Guarnera A, Guarino F, Messina A, Mazzoni C, et al. (2010年7月). 「VDAC1のN末端をVDAC3と交換することで、チャネルの活性が完全に回復し、細胞に抗老化特性が付与される」. FEBS Letters . 584 (13): 2837– 2844. Bibcode : 2010FEBSL.584.2837R . doi : 10.1016/ j.febslet.2010.04.066 . hdl : 11573/126366 . PMID 20434446. S2CID 22130291 .
- ^ Subedi KP, Kim JC, Kang M, Son MJ, Kim YS, Woo SH (2011年2月). 「心筋細胞において、電圧依存性アニオンチャネル2は安静時Ca²+スパークを調節するが、活動電位誘導性Ca²+シグナル伝達は調節しない」. Cell Calcium . 49 (2): 136– 143. doi : 10.1016/j.ceca.2010.12.004 . PMID 21241999 .
- ^ a b Alvira CM, Umesh A, Husted C, Ying L, Hou Y, Lyu SC, 他 (2012年11月). 「電圧依存性アニオンチャネル2と一酸化窒素合成酵素の相互作用は肺動脈内皮細胞の一酸化窒素産生を促進する」 . American Journal of Respiratory Cell and Molecular Biology . 47 (5): 669– 678. doi : 10.1165 /rcmb.2011-0436OC . PMC 3547107. PMID 22842492 .
- ^ Cheng EH, Sheiko TV, Fisher JK, Craigen WJ, Korsmeyer SJ (2003年7月). 「VDAC2はBAK活性化とミトコンドリアアポトーシスを阻害する」. Science . 301 ( 5632): 513– 517. Bibcode : 2003Sci...301..513C . doi : 10.1126/science.1083995 . PMID 12881569. S2CID 37099525 .
- ^ Li Z, Wang Y, Xue Y, Li X, Cao H, Zheng SJ (2012年2月). 「感染性ファブリキウス嚢病ウイルスによる宿主細胞へのアポトーシス誘導における電圧依存性アニオンチャネル2の重要な役割は、VP5との相互作用を介して発現する」 . Journal of Virology . 86 (3): 1328– 1338. doi : 10.1128/JVI.06104-11 . PMC 3264341. PMID 22114330 .
- ^ a b c d e Huang H, Shah K, Bradbury NA, Li C, White C (2014年10月). 「Mcl-1はVDACと直接相互作用し、ミトコンドリアCa2+の取り込みと活性酸素種の生成を増加させることで、肺癌細胞の遊走を促進する」 . Cell Death & Disease . 5 (10 ) : e1482. doi : 10.1038/cddis.2014.419 . PMC 4237246. PMID 25341036 .
- ^ a b c Chu Y, Goldman JG, Kelly L, He Y, Waliczek T, Kordower JH (2014年9月). 「異常なα-シヌクレインは、散発性および実験的パーキンソン病における黒質の電圧依存性アニオンチャネル1を減少させる」. Neurobiology of Disease . 69 : 1– 14. doi : 10.1016/j.nbd.2014.05.003 . PMID 24825319. S2CID 22722682 .
- ^ a b Smilansky A, Dangoor L, Nakdimon I, Ben-Hail D, Mizrachi D, Shoshan-Barmatz V (2015年12月). 「電圧依存性アニオンチャネル1はアミロイドβ毒性を媒介し、アルツハイマー病治療の潜在的標的となる」 . The Journal of Biological Chemistry . 290 (52): 30670– 30683. doi : 10.1074/ jbc.M115.691493 . PMC 4692199. PMID 26542804 .
- ^ Zhang E, Mohammed Al-Amily I, Mohammed S, Luan C, Asplund O, Ahmed M, et al. (2019年1月). 「β細胞におけるVDAC1の過剰発現と表面転座を阻害することで糖尿病におけるインスリン分泌を維持する」 . Cell Metabolism . 29 (1): 64–77.e6. doi : 10.1016/j.cmet.2018.09.008 . PMC 6331340. PMID 30293774 .
- ^ Amodeo GF, Scorciapino MA, Messina A, De Pinto V, Ceccarelli M (2014). 「荷電残基分布は、電圧依存性陰イオン選択性チャネルのヒトアイソフォームの開状態の選択性を調節する」 . PLOS ONE . 9 (8) e103879. Bibcode : 2014PLoSO...9j3879A . doi : 10.1371/journal.pone.0103879 . PMC 4146382. PMID 25084457 .
- ^ a b Bayrhuber M, Meins T, Habeck M, Becker S, Giller K, Villinger S, 他 (2008年10月). 「ヒト電圧依存性アニオンチャネルの構造」 .米国科学アカデミー紀要. 105 (40): 15370– 15375. Bibcode : 2008PNAS..10515370B . doi : 10.1073 / pnas.0808115105 . PMC 2557026. PMID 18832158 .
- ^ Hiller S, Garces RG, Malia TJ, Orekhov VY, Colombini M, Wagner G (2008年8月). 「洗剤ミセル中のヒト膜タンパク質VDAC-1の溶液構造」 . Science . 321 ( 5893): 1206– 1210. Bibcode : 2008Sci...321.1206H . doi : 10.1126/science.11 61302. PMC 2579273. PMID 18755977 .
- ^ a b c d Ujwal R, Cascio D, Colletier JP, Faham S, Zhang J, Toro L, et al. (2008年11月). 「マウスVDAC1の2.3Å分解能における結晶構造は、代謝物ゲーティングのメカニズムに関する知見を明らかにする」 . Proceedings of the National Academy of Sciences of the United States of America . 105 (46): 17742– 17747. Bibcode : 2008PNAS..10517742U . doi : 10.1073/pnas.0809634105 . PMC 2584669. PMID 18988731 .
- ^ Shanmugavadivu B, Apell HJ, Meins T, Zeth K, Kleinschmidt JH (2007年4月). 「ヒト膜タンパク質VDACのβバレルの正しいフォールディングには脂質二重層が必要」 . Journal of Molecular Biology . 368 (1): 66– 78. doi : 10.1016/j.jmb.2007.01.066 . PMID 17336328 .
- ^マコミス KS、ベインズ CP (2012 年 6 月)。「細胞死における VDAC の役割: 敵か味方か?」。Biochimica et Biophysica Acta (BBA) - 生体膜。1818 (6): 1444–1450。doi : 10.1016 / j.bbamem.2011.10.025。PMC 3288473。PMID 22062421。
- ^ Tomasello MF, Guarino F, Reina S, Messina A, De Pinto V (2013年12月). 「ミトコンドリア外膜における電圧依存性陰イオン選択チャネル1(VDAC1)のトポグラフィー(無傷細胞で検出) 」 . PLOS ONE . 8 (12) e81522. Bibcode : 2013PLoSO...881522T . doi : 10.1371/journal.pone.0081522 . PMC 3855671. PMID 24324700 .
- ^ a b Teijido O, Ujwal R, Hillerdal CO, Kullman L, Rostovtseva TK, Abramson J (2012年3月). 「電圧依存性アニオンチャネルの壁にN末端αヘリックスを固定しても、その電位ゲーティングは妨げられない」 . The Journal of Biological Chemistry . 287 (14): 11437– 11445. doi : 10.1074 / jbc.M111.314229 . PMC 3322836. PMID 22275367 .
- ^ a bケイナン N、パヒマ H、ベン=ヘイル D、ショシャン=バルマッツ V (2013 年 7 月)。「VDAC1 オリゴマー化とミトコンドリア媒介アポトーシスにおけるカルシウムの役割」。Biochimica et Biophysica Acta (BBA) - 分子細胞研究。1833 (7): 1745–1754。doi : 10.1016 / j.bbamcr.2013.03.017。PMID 23542128。
- ^ a b Lee MJ, Kim JY, Suk K, Park JH (2004年5月). 「ミトコンドリアアポトーシス経路におけるメディエーターとしての低酸素誘導因子1α応答性HGTD-P遺伝子の同定」 . Molecular and Cellular Biology . 24 (9): 3918– 3927. doi : 10.1128/ mcb.24.9.3918-3927.2004 . PMC 387743. PMID 15082785 .
- ^ a bデ・ピント V、グアリーノ F、グアルネラ A、メッシーナ A、レイナ S、トマセロ FM、他。 (2010年)。「ヒト VDAC アイソフォームの特徴付け: VDAC3 の特有の機能?」。Biochimica et Biophysica Acta (BBA) - 生体エネルギー学。1797 ( 6–7 ): 1268–1275 . doi : 10.1016/j.bbabio.2010.01.031。PMID 20138821。
- ^ Rostovtseva T, Colombini M (1997年5月). 「VDACチャネルはATPの流れを媒介し、制御する:ミトコンドリア機能の調節への影響」 . Biophysical Journal . 72 (5): 1954– 1962. Bibcode : 1997BpJ....72.1954R . doi : 10.1016/ s0006-3495 (97)78841-6 . PMC 1184392. PMID 9129800 .
- ^ Hoogenboom BW, Suda K, Engel A, Fotiadis D (2007年7月). 「天然膜における電圧依存性アニオンチャネルの超分子集合体」. Journal of Molecular Biology . 370 (2): 246– 255. doi : 10.1016/j.jmb.2007.04.073 . PMID 17524423 .
- ^ a bワイスタル S、ケイナン N、ベン=ヘイル D、アリフ T、ショシャン=バルマッツ V (2014 年 10 月)。 「VDAC1 発現レベルの Ca(2+) 媒介制御は細胞死誘導に関連しています。」Biochimica et Biophysica Acta (BBA) - 分子細胞研究。1843 (10): 2270–2281。doi : 10.1016 / j.bbamcr.2014.03.021。PMID 24704533。
- ^ Weber JJ, Ortiz Rios MM, Riess O, Clemens LE, Nguyen HP (2016-01-01). 「ハンチントン病におけるオレソキシムのカルパイン抑制効果」 . Rare Diseases . 4 (1) e1153778. doi : 10.1080/21675511.2016.1153778 . PMC 4838320. PMID 27141414 .
- ^ Weber JJ, Clemensson LE, Schiöth HB, Nguyen HP (2019年10月). 「神経変性疾患におけるオレソキシム:有望な薬剤候補の精査」.生化学薬理学. 168 : 305–318 . doi : 10.1016/j.bcp.2019.07.002 . PMID 31283931 .
- ^ Clemens LE, Weber JJ, Wlodkowski TT, Yu-Taeger L, Michaud M, Calaminus C, et al. (2015年12月). 「オレソキシムはBACHDラットにおけるカルパイン活性化および変異ハンチンチンの断片化を抑制する」Brain . 138 (Pt 12): 3632– 3653. doi : 10.1093/brain/awv290 . PMID 26490331 .
- ^ Choudhary OP, Paz A, Adelman JL, Colletier JP, Abramson J, Grabe M (2014年7月). 「構造誘導シミュレーションがVDAC1を介したATP輸送のメカニズムを解明」 . Nature Structural & Molecular Biology . 21 (7): 626– 632. doi : 10.1038/nsmb.2841 . PMC 4157756. PMID 24908397 .
- ^ a b Weng C, Li Y, Xu D, Shi Y, Tang H (2005年3月). 「腫瘍壊死因子関連アポトーシス誘導リガンド(TRAIL)誘導性アポトーシスにおけるカスパーゼ3によるMcl-1の特異的切断」 . The Journal of Biological Chemistry . 280 (11): 10491– 10500. doi : 10.1074/jbc.M412819200 . PMID 15637055 .
- ^ a b Shi Y, Chen J, Weng C, Chen R, Zheng Y, Chen Q, et al. (2003年6月). 「ヒトVDAC1とBcl-2ファミリータンパク質のタンパク質間接触部位および相互作用モードの同定」.生化学および生物理学的研究通信. 305 (4): 989– 996. Bibcode : 2003BBRC..305..989S . doi : 10.1016/s0006-291x(03)00871-4 . PMID 12767928 .
- ^清水 誠・小西 明・児玉 剛・辻本 雄三 (2000年3月). 「抗アポトーシス性Bcl-2ファミリーメンバーのBH4ドメインは電圧依存性アニオンチャネルを閉鎖し、ミトコンドリアのアポトーシス性変化および細胞死を阻害する」.米国科学アカデミー紀要. 97 (7): 3100– 3105. Bibcode : 2000PNAS...97.3100S . doi : 10.1073/pnas.97.7.3100 . PMC 16199. PMID 10737788 .
- ^清水 誠・成田 正・辻本 雄一 (1999年6月). 「Bcl-2ファミリータンパク質はミトコンドリアチャネルVDACによるアポトーシス誘導性シトクロムcの放出を制御する」Nature . 399 (6735): 483– 487. Bibcode : 1999Natur.399..483S . doi : 10.1038/20959 . PMID 10365962 . S2CID 4423304 .
- ^ Schwarzer C, Barnikol-Watanabe S, Thinnes FP, Hilschmann N (2002年9月). 「電圧依存性陰イオン選択チャネル(VDAC)はダイニン軽鎖Tctex1および熱ショックタンパク質PBP74と相互作用する」. The International Journal of Biochemistry & Cell Biology . 34 (9): 1059– 1070. doi : 10.1016/s1357-2725(02) 00026-2 . PMID 12009301. S2CID 11632830 .
- ^草野 秀一、清水 聡、幸谷 RC、藤田 秀一、鎌田 聡、葛巻 暢一、他 (2000年10月). 「ヒトゲルゾリンはVDACを閉鎖することでミトコンドリアのアポトーシス変化を阻害し、アポトーシスを抑制する」. Oncogene . 19 ( 42): 4807– 4814. doi : 10.1038/sj.onc.1203868 . PMID 11039896. S2CID 22482896 .
- ^ Baines CP, Song CX, Zheng YT, Wang GW, Zhang J, Wang OL, 他 (2003年5月). 「タンパク質キナーゼCepsilonは心臓ミトコンドリアの膜透過性遷移孔と相互作用し、その機能を阻害する」 . Circulation Research . 92 (8): 873– 880. doi : 10.1161/01.RES.0000069215.36389.8D . PMC 3691672. PMID 12663490 .
- ^ Sun Y, Vashisht AA, Tchieu J, Wohlschlegel JA, Dreier L (2012年11月). 「電圧依存性アニオンチャネル(VDAC)はパーキンを欠陥ミトコンドリアに誘導し、ミトコンドリアオートファジーを促進する」 . The Journal of Biological Chemistry . 287 (48): 40652– 40660. doi : 10.1074/jbc.M112.419721 . PMC 3504778. PMID 23060438 .
- ^ Noskov SY, Rostovtseva TK, Bezrukov SM (2013年12月). 「平衡および非平衡MDシミュレーションによるVDACおよびVDAC-チューブリン複合体を介したATP輸送の解明」.生化学. 52 ( 51): 9246– 9256. doi : 10.1021/bi4011495 . PMC 7259721. PMID 24245503 .
- ^ Martel C, Allouche M, Esposti DD, Fanelli E, Boursier C, Henry C, et al. (2013年1月). 「グリコーゲン合成酵素キナーゼ3を介した電圧依存性陰イオンチャネルのリン酸化は、脂質蓄積時のミトコンドリア外膜透過性を制御する」 . Hepatology . 57 (1): 93– 102. doi : 10.1002/hep.25967 . PMID 22814966. S2CID 21809602 .
さらに読む
- Verrier F, Mignotte B, Jan G, Brenner C (2003年12月). 「ウイルスタンパク質標的の同定に向けたアポトーシス中のPTPC組成の研究」 ( PDF) . Annals of the New York Academy of Sciences . 1010 (1): 126– 142. Bibcode : 2003NYASA1010..126V . doi : 10.1196/annals.1299.022 . PMID 15033708. S2CID 22660199 .
- McEnery MW, Snowman AM, Trifiletti RR, Snyder SH (1992年4月). 「ミトコンドリアベンゾジアゼピン受容体の単離:電位依存性アニオンチャネルおよびアデニンヌクレオチドキャリアとの関連」 .米国科学アカデミー紀要. 89 (8): 3170–3174 . Bibcode : 1992PNAS...89.3170M . doi : 10.1073 / pnas.89.8.3170 . PMC 48827. PMID 1373486 .
- Dawson SJ, White LA (1992年5月). 「シプロフロキサシンによるヘモフィルス・アフロフィルス心内膜炎の治療」. The Journal of Infection . 24 (3): 317– 320. doi : 10.1016/S0163-4453(05)80037-4 . PMID 1602151 .
- Jürgens L, Ilsemann P, Kratzin HD, Hesse D, Eckart K, Thinnes FP, et al. (1991年7月). 「ヒトポリンに関する研究 IV. ヒト骨格筋膜から精製された「ポリン31HM」とヒトBリンパ球膜由来の「ポリン31HL」の一次構造は同一である」. Biological Chemistry Hoppe-Seyler . 372 (7): 455– 463. doi : 10.1515/bchm3.1991.372.2.455 . PMID 1657034 .
- Kayser H, Kratzin HD, Thinnes FP, Götz H, Schmidt WE, Eckart K, et al. (1989年12月). 「ヒトポリンの同定. II. ヒトBリンパ球由来の31-lDaポリン(ポリン31HL)の特性解析と一次構造」. Biological Chemistry Hoppe-Seyler . 370 (12): 1265– 1278. PMID 2559745 .
- Brdiczka D, Kaldis P, Wallimann T (1994年11月). 「ミトコンドリアクレアチンキナーゼ八量体とポリン間のin vitro複合体形成」 . The Journal of Biological Chemistry . 269 (44): 27640– 27644. doi : 10.1016/S0021-9258(18)47033-0 . PMID 7525559 .
- Yu WH, Wolfgang W, Forte M (1995年6月). 「ヒト電圧依存性アニオンチャネルアイソフォームの細胞内局在」 . The Journal of Biological Chemistry . 270 (23): 13998–14006 . doi : 10.1074/jbc.270.23.13998 . PMID 7539795 .
- Thomas L, Blachly-Dyson E, Colombini M, Forte M (1993年6月). 「電圧依存性陰イオン選択性チャネルの電圧センサーを形成する残基のマッピング」 .米国科学アカデミー紀要. 90 (12): 5446– 5449. Bibcode : 1993PNAS...90.5446T . doi : 10.1073 / pnas.90.12.5446 . PMC 46737. PMID 7685903 .
- Blachly-Dyson E, Zambronicz EB, Yu WH, Adams V, McCabe ER, Adelman J, et al. (1993年1月). 「ミトコンドリア外膜チャネル(電圧依存性アニオンチャネル)の2つのヒトアイソフォームのクローニングと酵母における機能発現」 . The Journal of Biological Chemistry . 268 (3): 1835– 1841. doi : 10.1016/S0021-9258(18)53930-2 . PMID 8420959 .
- Schleiff E, Shore GC, Goping IS (1997年3月). 「ヒトミトコンドリア輸入受容体Tom20p. グルタチオンを用いたTom20-グルタチオンS-トランスフェラーゼとミトコンドリア前駆タンパク質間の特異的相互作用の解明」 . FEBS Letters . 404 ( 2–3 ): 314–318 . Bibcode : 1997FEBSL.404..314S . doi : 10.1016/S0014-5793(97)00145-2 . PMID 9119086. S2CID 29177508 .
- Reymann S, Haase W, Krick W, Burckhardt G, Thinnes FP (1998年8月). 「エンドソーム:ミトコンドリア外におけるタイプ1ポリン/電位依存性陰イオン選択性チャネルのもう一つの局在」. Pflügers Archiv . 436 (3): 478– 480. doi : 10.1007/s004240050659 . PMID 9644232. S2CID 670898 .
- 成田 正之、清水 聡、伊藤 毅、チッテンデン 徹、ルッツ RJ、松田 秀、他 (1998年12月). 「Baxは膜透過性遷移孔と相互作用し、単離ミトコンドリアにおける膜透過性遷移とシトクロムcの放出を誘導する」 .米国科学アカデミー紀要. 95 (25): 14681–14686 . Bibcode : 1998PNAS...9514681N . doi : 10.1073/pnas.95.25.14681 . PMC 24509. PMID 9843949 .
- Crompton M, Virji S, Ward JM (1998年12月). 「シクロフィリンDは電圧依存性アニオンチャネルとアデニンヌクレオチドトランスロカーゼの複合体に強く結合し、透過性遷移孔を形成する」 . European Journal of Biochemistry . 258 (2): 729– 735. doi : 10.1046/j.1432-1327.1998.2580729.x . PMID 9874241 .
- メッシーナ A、オリバ M、ロザート C、ホイジング M、ルイテンベーク W、ファン デン フーベル LP、他(1999年2月)。 「ヒトの電圧依存性陰イオンチャネルアイソフォーム 1 および 2 のマッピングが再検討されました」。生化学および生物物理学研究コミュニケーション。255 (3): 707–710。Bibcode : 1999BBRC..255..707M。土井:10.1006/bbrc.1998.0136。PMID 10049775。
- 清水 誠、成田 正治、辻本 雄一 (1999年6月). 「Bcl-2ファミリータンパク質はミトコンドリアチャネルVDACによるアポトーシス誘導性シトクロムcの放出を制御する」. Nature . 399 ( 6735): 483– 487. Bibcode : 1999Natur.399..483S . doi : 10.1038/20959 . PMID 10365962. S2CID 4423304 .
- Decker WK, Bowles KR, Schatte EC, Towbin JA, Craigen WJ (1999年10月). 「放射線ハイブリッド解析によるヒト電圧依存性アニオンチャネル遺伝子座の改訂詳細マッピング」. Mammalian Genome . 10 (10): 1041–1042 . doi : 10.1007/s003359901158 . PMID 10501981. S2CID 27663120 .
- Jacotot E, Ravagnan L, Loeffler M, Ferri KF, Vieira HL, Zamzami N, 他 (2000年1月). 「HIV-1ウイルスタンパク質Rはミトコンドリア膜透過性遷移孔への直接的な作用を介してアポトーシスを誘導する」 . The Journal of Experimental Medicine . 191 (1): 33– 46. doi : 10.1084 / jem.191.1.33 . PMC 2195797. PMID 10620603 .
- 清水 誠・辻本 雄一 (2000年1月). 「プロアポトーシス誘導性BH3-only Bcl-2ファミリーメンバーはシトクロムCの放出を誘導するが、ミトコンドリア膜電位の低下は誘導せず、また、電位依存性アニオンチャネル活性を直接調節しない」.米国科学アカデミー紀要. 97 (2): 577– 582. Bibcode : 2000PNAS...97..577S . doi : 10.1073/pnas.97.2.577 . PMC 15372. PMID 10639121 .
- Stadtmüller U, Eben-Brunnen J, Schmid A, Hesse D, Klebert S, Kratzin HD, et al. (1999年12月). 「ミトコンドリア由来およびミトコンドリア外ヒト1型ポリンは、アミノ酸配列決定および電気生理学的特性解析により同一であることが明らかにされた」. Biological Chemistry . 380 (12): 1461– 1466. doi : 10.1515/BC.1999.189 . PMID 10661876. S2CID 1566781 .