植物の発育
植物の発生において重要な構造は、芽、新芽、根、葉、花です。植物は、器官の先端または成熟組織の間に位置する分裂組織[ 1 ]から、生涯を通じてこれらの組織と構造を生成します。したがって、生きている植物は常に胚組織を持っています。対照的に、動物の胚は非常に早い段階で、生涯にわたって持つことになる体のすべての部分を生成します。動物が生まれたとき(または卵から孵ったとき)には、体のすべての部分が揃っており、その時点から大きく成熟していきます。しかし、植物と動物はどちらも、独立して進化した系統型段階[ 2 ]を通過し、それが形態の多様化を制限する発生上の制約を引き起こします。[ 3 ] [ 4 ] [ 5 ] [ 6 ]
植物生理学者A・カール・レオポルドによれば、植物に見られる組織特性は、個々の部分の総和を超えた創発特性である。「これらの組織と機能が統合された多細胞生物へと組み合わさることで、個々の部分やプロセスの特性だけでなく、個々の部分のみの観察では予測できなかった全く新しい特性群が生み出される。」[ 7 ]
成長
維管束植物は、卵細胞と精細胞が受精して形成される単細胞の接合子から始まります。この時点から、胚発生の過程を経て分裂を開始し、植物胚を形成します。この過程で、生じた細胞は、一方の端が最初の根となり、もう一方の端が茎の先端となるように組織化されます。種子植物では、胚は1枚または複数の「子葉」(子葉)を発達させます。胚発生の終わりまでに、若い植物は生命活動を開始するために必要なすべての部分を備えています。
植物器官形成
胚が種子または親植物から発芽すると、器官形成の過程を経て追加の器官(葉、茎、根)を作り始める。新しい根は根の先端にある根分裂組織から成長し、新しい茎と葉はシュートの先端にあるシュート分裂組織から成長する。 [ 8 ]分岐は、分裂組織によって残され、まだ細胞分化して特殊な組織を形成する前の小さな細胞塊が、新しい根やシュートの先端として成長し始めるときに起こる。根やシュートの先端にあるこのような分裂組織からの成長は一次成長と呼ばれ、その根やシュートが長くなる。二次成長は、形成層の細胞分裂から根やシュートが広がることにつながる。[ 9 ]
直接的な器官形成
直接器官形成は、カルス形成段階を経ずに、根やシュートなどの器官を分裂組織細胞または非分裂組織細胞から直接発生させる植物組織培養法である。このプロセスは、内部または外部から適用された植物成長調整物質の影響を受けて、シュートおよび根の頂端分裂組織または腋芽が活性化されることによって起こる。その結果、特定の細胞型が分化して、植物全体に成長できる植物構造を形成する。この技術は、野菜、果物、木本植物、薬用植物など、さまざまな植物種の繁殖によく使用される。このプロセスでは、シュートの先端と節部分が通常、組織片として使用される。場合によっては、特定の条件下で体細胞組織から不定構造が発生し、自然には発生しない領域でシュートや根の再生が可能になる。このアプローチは特に草本植物において効果的であり、不定再生はシュート形成率の向上につながるものの、腋芽増殖は効率性と実用性からミクロプロパゲーションにおいて依然として最も広く用いられている方法である。このプロセスにおける器官発達の一般的な順序は、一次組織片 → 分裂組織 → 器官原基というパターンに従う。
間接的な器官形成
間接器官形成は、植物細胞が脱分化を経て、分化した状態から新たな発生経路へと移行する発生過程です。この過程は中間カルス段階を特徴とします。この段階では、細胞は本来のアイデンティティを失い、形態的に適応可能となり、器官形成の基盤となります。間接器官形成の進行にはいくつかの重要な段階があり、まず脱分化が起こり、細胞はコンピテンスを獲得します。その後、誘導段階を経て、完全に決定された状態へと至ります。決定が達成されると、細胞は形態変化を起こし、最終的に機能的なシュートまたは根を形成します。この過程は、一次組織片 → カルス → 分裂組織 → 器官原基という構造化された発生順序に従い、植物器官の組織的な形成を確実にします。
器官形成に影響を与える要因
摘出
植物の再生を成功させるには、適切な組織片を選択することが重要です。組織片の選択は、植物種や品種によって異なります。直接的な器官形成においては、シュートの先端、側芽、葉、葉柄、根、花序といった分裂組織から採取した組織片が、新しい器官へと急速に発達する能力があるため、しばしば好まれます。これらの組織は、高い生存率、速い成長、そしてin vitroにおける強力な再生能を有しています。分裂組織、シュートの先端、腋芽、未熟な葉、そして胚は、幅広い植物種において再生を促進する上で特に効果的です。
さらに、葉、茎、根、葉柄、花節などの成熟した植物部位は、適切な条件下では器官形成のための生存可能な外植片として機能します。植物の再生は、後に新しい器官を形成する未分化細胞塊であるカルスの形成によって起こります。カルス形成は、子葉、胚軸、茎、葉、茎頂、根、花序、花器など、様々な外植片から、制御された条件下で培養することで誘導できます。
一般的に、活発に分裂する細胞を含む組織片は、細胞の再プログラミング能力が高いため、カルスの形成に効果的です。未熟な組織は、成熟した組織に比べて発達の可塑性が高いため、再生への適応性が高い傾向があります。組織片の大きさと形状も培養の成功に影響を与えます。より大きく、より構造的に好ましい組織片は、生存と成長の可能性を高める可能性があります。カルスの形成は主に、傷害と植物ホルモンの存在によって引き起こされます。植物ホルモンは組織中に自然に存在する場合もあれば、細胞活動と器官形成を刺激するために培地に添加される場合もあります。
培地、植物成長調整剤、ゲル化剤
多様な植物種の要求に応えるため、培地の組成はミネラル元素とビタミン含有量において大きく異なります。ムラシゲ・スクーグ(MS)培地は、アンモニウム態窒素含有量が高いことが特徴で、これは他の培地には見られない特徴です。ショ糖は、様々な培地タイプにおいて主要な炭水化物源として一般的に利用されています。
オーキシンとサイトカイニンが器官形成を制御する相互作用はよく知られていますが、その反応は種によって異なります。タバコのように、外因性成長調節因子なしでも自発的にシュート芽を形成できる植物もありますが、Scurrula pulverulenta(キク科) 、Lactuca sativa(レタス科) 、Brassica juncea (アブラナ科)のように、ホルモン補充が厳密に必要な植物もあります。Brassica junceaの子葉培養では、ベンジルアミノプリン(BAP)単独で葉柄組織からシュート形成が誘導されます。これは、ラジアータマツでサイトカイニンのみでシュート誘導が可能であるのと同様です。
研究によると、器官分化は外因性ホルモンの施用量ではなく、内因性ホルモン濃度によって最終的に決定されることが示されています。シュート誘導に使用される様々なサイトカイニン(2iP、BAP、チジアズロン、カイネチン、ゼアチン)の中で、BAPは優れた効果を示し、広く利用されています。オーキシンも同様に器官形成経路に影響を与え、2,4-Dは穀類のカルス誘導によく使用されますが、器官形成には通常、IAAまたはNAAを含む培地、あるいは2,4-Dを全く含まない培地への移植が必要です。オーキシンとサイトカイニンの比率は、どの器官が発達するかを大きく左右します。
ジベレリン酸(GA3)は細胞の伸長と分裂組織形成に寄与する一方、トリヨード安息香酸(TIBA)、アブシジン酸(ABA)、カナマイシン、オーキシン阻害剤といった従来とは異なる化合物は、扱いにくい植物種に有効であることが証明されています。高麗人参粉末などの天然添加物は、特定の培養において再生頻度を高めることができます。エチレンは一般的にシュート分化を抑制するため、アミノエトキシビニルグリシン(AVG)や硝酸銀(AgNO 3)などのエチレン合成阻害剤は、器官形成を促進するためにしばしば用いられ、小麦、タバコ、ヒマワリの培養において効果が実証されています。
寒天は培地に必須の成分ではありませんが、その質と量は器官形成における役割を決定する重要な要素です。市販の寒天には不純物が含まれている可能性があります。寒天濃度が高いと栄養培地が硬くなり、成長中の組織への栄養素の拡散が妨げられます。これは、不定根、基部の不要なカルス、または葉の老化を生成して、器官形成プロセスに影響を与えます。pH も器官形成経路に影響を与える重要な要因です。培地の pH は、滅菌前に 5.6 ~ 5.8 に調整されます。培地 pH によって培地中の栄養素の利用が促進または阻害されます。たとえば、in vitro でのアンモニウムの取り込みは、安定した pH 5.5 で起こります (Thorpe et al., 2008)。
その他の要因
季節
組織培養システムにおける再生能力には、組織片採取の時期が大きな影響を与え、季節的な変動が器官形成の成功に極めて重要な役割を果たします。この現象はユリ(Lilium speciosum)において明確に実証されており、球根の鱗片は採取時期によって異なる再生反応を示します。春と秋に採取した組織片はin vitroで容易に球根を形成しますが、夏や冬に採取した組織片は、培養条件が同じにもかかわらず、球根を形成しません。
同様の季節依存性は、薬用植物として貴重なChlorophytum borivillianumにも観察されています。Chlorophytum borivillianumは、モンスーン期には他の時期と比較して、試験管内での塊茎形成が著しく促進されます。この形態形成能の季節変動は、内因性ホルモンレベル、炭水化物貯蔵量、そして年間成長周期を通して変動する代謝活性など、原料植物の生理学的状態の違いを反映していると考えられます。
酸素勾配
組織培養において酸素は重要な役割を果たし、器官形成に影響を与えます。培養によっては、培養容器内の酸素勾配が低下すると芽形成が起こり、一方、根の誘導には高い酸素勾配が必要です。
ライト
光条件(強度とスペクトルの質の両方を含む)は、植物組織培養システムにおいて重要な形態形成シグナルとして機能します。スペクトル構成に関する研究により、波長依存的に明確な反応が明らかになっており、青色光は一般的にシュートの器官形成を促進し、赤色光の波長は一般的に根の誘導を促進することが明らかになっています。青色光の後に赤色光を照射する連続光周期照射は、特定の種において特定の器官形成経路を効果的に刺激することが報告されています。
異なる波長による制御効果は、光の質が形態形成の結果を選択的に制御できることを実証しています。人工蛍光灯は種によって反応が異なり、ある栽培では根の形成を促進する一方で、他の栽培では阻害します。エンドウ(Pisum sativum)のように、一部の種は特殊な光要求性を示します。エンドウでは、芽芽形成は暗闇の中で最適に起こり、その後光への曝露によってさらなる発達が促進されます。
ほとんどの組織培養アプリケーションにおいて、標準的な照明プロトコルでは、通常、16時間の日長で約2,000~3,000ルクスの照度が推奨されています。しかし、一部の植物種では例外的な光強度要件が示され、例えばNicotiana tabacum(タバコ)のカルス培養では、シュート芽形成や体細胞胚形成を誘導するために、10,000~15,000ルクスというはるかに高い光強度が必要となります。
温度
植物組織培養システムにおいて、温度は重要な環境要因であり、最適な培養温度は、それぞれの自然生息地の条件に応じて種によって大きく異なります。多くの植物種において、in vitro実験では25℃が標準的な培養温度ですが、器官形成能を最大限に高めるには、種固有の温度適応を考慮する必要があります。
温帯地域の地生植物種は、通常、標準的なプロトコルよりも低い温度条件を必要とします。注目すべき例としては、スノードロップ(スノードロップ)などの球根植物が挙げられ、約15℃で最適な生育を示します。また、スイセン(スイセン)やアリウム(観賞用タマネギ)の特定の品種は、約18℃で再生効率が向上します。
逆に、熱帯起源の種は、培養において最適な成長と器官形成のために、一般的に高温を必要とします。ナツメヤシの培養は27℃でよく育ち、モンステラ・デリシオーサ(スイスチーズプラント)は30℃で再生能力がピークに達します。これらの温度要件は、植物本来の環境条件への進化的適応を反映しています。
倍数性レベル
植物細胞培養における染色体数の変動、すなわち異数性や倍数性などは、過去にも十分に報告されています。細胞の染色体不安定性は、カルス組織の形態形成能を徐々に低下させます。したがって、カルス組織の器官形成能と染色体の安定性を維持するためには、継代培養の時期と頻度を定期的に管理することが推奨されます。
文化の時代
培養期間の長さは、器官形成を成功させる鍵となることがよくあります。若い培養物や継代培養したばかりの材料は、古いものよりも器官を頻繁に形成することがあります。これは、おそらく古い培養物では器官形成能が低下したり失われたりするためです。しかし、一部の植物では、植物体再生能力が長年にわたって無期限に保持されることがあります。
発達過程
脱分化
細胞が器官形成を行う能力は、植物成長調整剤(PGR)の適用に大きく依存し、PGRは組織の発達方向に影響を与えます。オーキシンとサイトカイニンのバランスは、シュートが形成されるか根が形成されるかを決定する上で重要な役割を果たします。オーキシンとサイトカイニンの比率が低いとシュートの再生が促進され、オーキシン濃度が高いと根の形成が促進されます。例えば、Medicago sativa(アルファルファ)の培養では、カイネチン濃度が高く、合成オーキシンである2,4-Dの濃度が低いとシュートが発達しますが、2,4-D濃度が高く、カイネチン濃度が低いと根の形成が促進されます。しかし、器官形成の成功はPGR処理だけに依存するわけではありません。カルスまたは発達中の組織の物理的サイズは、適切な器官形成をサポートするために特定の閾値に達する必要があり、これは発達プロセスの調整における細胞間シグナル伝達の重要性を強調しています。
誘導
器官形成における誘導期は、組織が分化能を獲得してから原基形成を開始する準備が完全に整うまでの移行期を表します。この段階では、統合された遺伝子経路が形態分化が起こる前に発生過程を誘導します。研究によると、特定の化学的および物理的要因が遺伝的にプログラムされた発生経路に干渉し、形態形成の結果を変化させる可能性があることが示唆されています。ヒルガオ(Convolvulus arvensis)の場合、これらの外的影響はシュート形成を阻害し、代わりにカルス形成につながることが分かりました。
誘導期の終了は、細胞または細胞群がシュートまたは根の形成を決定した時点で示されます。この決定は、成長調節因子を添加した培地から、必須ミネラル、ビタミン、炭素源を含み、植物成長調節因子を含まない基本培地に組織を移すことで確認されます。この段階で、組織は誘導プロセスを完了し、その発生の運命を完全に決定します。
このプロセスにおける重要な概念は、カナリゼーション(canalisation)です。これは、遺伝的または環境的変動の可能性にもかかわらず、発生経路が一貫して標準的な表現型を生み出す能力を指します。完全なカナリゼーションが起こる前に組織片をシュート誘導培地から除去すると、シュート形成が著しく減少し、根の発達が優勢になります。この現象は、in vitroにおける植物組織の形態形成可塑性を強調し、外部条件や発生シグナルへの適応能力を示しています。
差別化
この段階では、形態分化のプロセスが始まり、新生器官の形成と発達へとつながります。器官形成の開始は、明確な極性の変化を特徴とし、続いて放射状対称性の確立と、新たに定義された軸に沿った成長が続き、最終的に器官形成の開始を示す構造的な隆起が形成されます。
器官形成の連続的な発達は、 Pinus oocarpa Schiedeなどの種で観察されます。これらの種では、直接器官形成によって子葉から直接シュート芽が再生されます。しかし、in vitroで生育する植物種によって、具体的な発達パターンは異なる場合があります。器官形成の進行には、明確な形態変化が伴います。まず、表面の質感の変化、分裂組織の発生、分裂組織領域の垂直方向または水平方向の拡大が見られます。続いて、分裂組織領域が表皮層を超えて突出し、葉原基が視認できる構造化された分裂組織が形成され、最終的に不定芽が完全に発達します。
in vitro器官形成培養の注目すべき特徴は、単一の組織片上に、分化度の異なる複数の分裂組織が同時に形成されることです。同一の組織片内には、初期の分化段階から完全に発達した構造まで、様々な発育段階の芽が存在する可能性があります。伸長したシュートが1cmを超えると、in vitroまたはex vitro発根培地に移植され、植物体再生が完了し、完全に形成された植物体が形成されます。
利点と制限
直接器官形成の過程では、腋芽はシュートの先端と節にある既存の分裂組織から直接生成されるため、高い増殖率が得られます。この方法の主な利点の一つは、組織化されたシュート分裂組織における突然変異の発生率が低いため、結果として得られる植物の遺伝的一貫性が維持されることです。この技術は、単一の組織片から複数のシュートを効率的に生成し、繁殖した植物全体の均一性を維持するため、経済的および環境的に重要な植物の生産と保全に特に有用です。さらに、直接器官形成によって生産されたすべての植物は、元の植物の遺伝的クローンであるという意味で、原型に忠実です。
しかし、器官形成にはいくつかの限界があります。望ましくない遺伝的多様性をもたらす可能性のあるソマクローナル変異は、特に間接的な器官形成過程において潜在的な問題となります。さらに、この技術は、in vitro培養や再生プロトコルにうまく反応しない難治性植物種には適さない可能性があります。これらの限界は、植物の繁殖と保全におけるこれらの課題を克服するために、様々な植物種に適した手法の継続的な研究と最適化の必要性を浮き彫りにしています。
細胞の伸長
植物は細胞分裂による成長に加えて、細胞の伸長によっても成長します。これは、個々の細胞または細胞群が長くなるときに起こります。すべての植物細胞が同じ長さに成長するわけではありません。茎の片側の細胞が反対側の細胞よりも長く速く成長すると、結果として茎は成長の遅い細胞の側に曲がります。この方向性のある成長は、光(光屈性)、重力(重力屈性)、水(水屈性)、物理的接触(接触屈性)などの特定の刺激に対する植物の反応によって起こります。


植物の成長と発育は、特定の植物ホルモンと植物成長調整物質(PGR)によって媒介されます(Ross et al. 1983)。 [ 10 ]内因性ホルモンのレベルは、植物の年齢、耐寒性、休眠期間、その他の代謝条件、光周期、湿度、温度、その他の外部環境条件、および外部から適用されるPGRや根圏起源などの外因性PGR源によって影響を受けます。
成長中の形態学的変化
植物は、形態と構造において自然な変異を示します。すべての生物は個体ごとに異なりますが、植物はさらに別の種類の変異を示します。単一の個体内において、他の類似した部分とは形態や構造が異なる部位が繰り返されることがあります。この変異は植物の葉で最もよく見られますが、茎や花などの他の器官にも同様の変異が見られることがあります。この変異には、位置による影響、環境による影響、そして幼若性という3つの主な原因があります。

成熟した植物の各部位には、器官が生成される相対的な位置によって生じる変異が見られます。例えば、新しい枝に沿って葉は枝に沿って一定のパターンで変化することがあります。枝の基部付近で生成される葉の形状は、植物の先端で生成される葉の形状とは異なり、この違いは特定の植物、特定の種において、枝ごとに一貫して見られます。
新しい構造が生成される際に成熟する方法は、植物の生育段階における発達開始時期や、その構造がさらされる環境によって影響を受ける可能性があります。温度は、植物の大きさや状態、温度や曝露期間など、様々な要因に応じて、植物に多様な影響を及ぼします。植物が小さく、多肉質であるほど、高すぎる温度や低すぎる温度による損傷や枯死の影響を受けやすくなります。温度は生化学的および生理学的プロセスの速度に影響を与え、一般的に(一定の範囲内で)温度とともに速度が増加します。
幼若性または異芽性とは、実生などの若い植物が作り出す器官や組織が、同じ植物が成長したときに作り出すものと異なることが多い状態です。たとえば、若い木は、完全に成長した木として生み出す枝よりも、上向きに伸びるより長く細い枝を生み出します。さらに、成長初期に生成される葉は、成体の葉よりも大きく、薄く、不規則になる傾向があります。幼植物の標本は、同種の成体植物とは全く異なる外観をしているため、産卵昆虫はそれを幼虫の餌として認識しません。初期成長形態から後期成長形態への移行は、栄養相変化と呼ばれることがあります。[ 11 ]
不定構造
根、芽、新芽など、通常とは異なる場所で発達する植物構造は、不定植物と呼ばれます。
不定根と不定芽は通常、既存の維管束組織の近くで発達し、道管と師管に接続することができます。しかし、正確な位置は大きく異なります。若い茎では、不定根は維管束間の柔組織から形成されることがよくあります。二次成長中の茎では、不定根は維管束形成層近くの師管柔組織から発生することがよくあります。茎の挿し木では、切断面に形成されるカルス細胞から不定根が発生することもあります。クラッスラ属の葉挿しは表皮に不定根を形成します。[ 12 ]
芽と新芽
不定芽は、茎の先端にある茎頂分裂組織、または茎頂節、葉腋以外の場所から発生し、一次成長の間は芽はそこに残されます。不定芽は根や葉、あるいは新芽として茎頂分裂組織に発生することがあります。茎頂分裂組織は、各節に1つまたは複数の腋芽または側芽を形成します。茎が二次成長を著しく進めると、腋芽は破壊されることがあります。そして、二次成長が進む茎に不定芽が発生することがあります。
不定芽は、幹が傷ついたり剪定されたりした後に形成されることが多い。不定芽は、失われた枝を補う役割を果たす。周囲の木々が伐採されたことで、日陰になっていた幹が明るい日光にさらされると、成熟した幹にも不定芽や新芽が成長することがある。セコイア(Sequoia sempervirens)は、幹の下部に多くの不定芽を形成することが多い。主幹が枯れると、不定芽の一つから新しい幹が芽生えることがよくある。セコイアの幹の小片は、レッドウッドバールと呼ばれ、土産物として販売されている。これを水を入れた鍋に入れると、不定芽が芽を出し、新芽を形成する。
一部の植物は、通常、根に不定芽を形成し、植物体からかなりの距離まで伸びることがあります。根の不定芽から発生するシュートは、シュートと呼ばれます。シュートは、多くのイネ科植物、ヤマナラシ、カナダアザミなど、多くの種における自然な栄養繁殖の一種です。パンドヤマナラシは、単一の根系における不定芽形成によって、1本の幹から47,000本の幹にまで成長しました。
一部の葉は不定芽を発達させ、それが栄養繁殖の一環として不定根を形成します。例えば、ピギーバックプラント(Tolmiea menziesii)やカランコエ(Kalanchoe daigremontiana)などが挙げられます。その後、不定芽は親植物から分離し、親植物の独立したクローンとして発達します。
コピシングとは、不定芽の急速な成長を促すために、樹木の幹を地面まで刈り取る作業です。伝統的に、支柱、柵の材料、薪の生産に用いられています。また、ポプラやヤナギなど、燃料用に栽培されるバイオマス作物にも用いられます。
ルーツ

一部の種では、不定根形成は低酸素症[ 13 ]や栄養欠乏などの環境要因によって引き起こされるストレス回避のための順応である可能性がある。不定根形成のもう一つの生態学的に重要な機能は、河岸地帯におけるヤナギやセコイアなどの樹木の栄養繁殖である[ 14 ] 。
植物の茎が不定根を形成する能力は、挿し木による商業繁殖に利用されています。不定根形成の生理学的メカニズムの理解により、合成オーキシンを発根粉末として利用したり、選択的な基部損傷を利用したりすることで、挿し木の発根を改善する上で一定の進歩が遂げられてきました。[ 15 ]今後、他の制御メカニズムの研究を商業繁殖に適用し、「発根しにくい」種と「発根しやすい」種における不定根形成の分子生物学的・生理生態学的制御の比較分析を行うことで、さらなる進歩が期待されます。
挿し木、取り木、組織培養で植物を増やす場合、不定根と芽は非常に重要です。オーキシンと呼ばれる植物ホルモンは、不定根の形成を促進するために、多くの場合、茎、芽、葉の挿し木に使用されます。例:アフリカバイオレットとセダムの葉、およびポインセチアとコリウスの芽。 挿し木による繁殖では、不定芽の形成が必要です。例:西洋わさびとリンゴ。 取り木では、新しい植物を作るために茎の一部を取り除かれる前に、不定根が空中茎に形成されます。 大型の観葉植物は、空中取り木で増やされることがよくあります。 植物の組織培養繁殖では、不定根と芽が発達する必要があります。
修正されたフォーム
- 塊根には明確な形がありません。例:サツマイモ。
- 束根(塊根)は茎の基部に集まって生じます。例:アスパラガス、ダリア。
- 根粒菌の根は先端近くが膨らみます。例:ウコン。
- 支柱根は茎の最初の数節から発生し、土壌に斜めに伸びて植物を支えます。例:トウモロコシ、サトウキビ。
- 支柱根は空中枝に機械的な支持を与えます。側枝は土壌に向かって垂直に伸び、支柱として機能します。例:ガジュマル。
- 節から発生する登り根は何らかの支持物に付着し、それを乗り越えて登ります。例: Epipremnum aureum。
- 数珠状またはビーズ状の根。肉質の根はビーズのような外観を呈します。例:ゴーヤ、スベリヒユ。
葉の発達
Arabidopsis thalianaの葉の形状発達の遺伝学は、葉原基の形成、背腹性の確立、および辺縁分裂組織の発達という3つの段階に分けられています。葉原基の形成は、クラス I KNOXファミリーの遺伝子とタンパク質( SHOOT APICAL MERISTEMLESSなど) の抑制によって開始されます。これらのクラス I KNOX タンパク質は、葉原基におけるジベレリン生合成を直接抑制します。葉原基におけるこれらの遺伝子の抑制には、多くの遺伝因子 ( ASYMMETRIC LEAVES1、BLADE-ON-PETIOLE1、SAWTOOTH1など) が関与していることが判明しています。したがって、この抑制によってジベレリンのレベルが上昇し、葉原基が成長を開始します。
花の発達

花の発達とは、被子植物が分裂組織において遺伝子発現のパターンを作り出し、有性生殖を目的とした器官である花を出現させる過程である。この過程が起こるためには、3つの生理学的発達が起こる必要がある。第1に、植物は性的に未熟な状態から性的に成熟した状態(すなわち、開花への移行)に移行する必要がある。第2に、頂端分裂組織の機能が栄養分裂組織から花分裂組織または花序に変換される必要がある。そして最後に、花の個々の器官が成長する必要がある。この最後の段階は、分子遺伝学および発生遺伝学の観点からプロセスの生物学的基礎を説明するABCモデルを使用してモデル化されている。
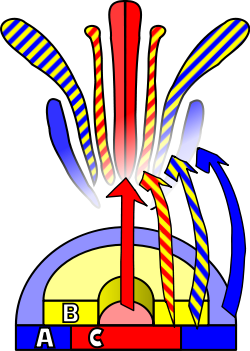
分裂組織から花の分裂組織への分化を誘発するには、外部からの刺激が必要です。この刺激は分裂組織、特に新しい原基が形成される側面における有糸分裂を活性化します。この同じ刺激によって、分裂組織は栄養分裂組織ではなく花の分裂組織の成長につながる発達パターンに従います。これら 2 種類の分裂組織の主な違いは、目的の器官の明らかな相違は別として、輪生葉序、つまり原基の連続する輪生または輪生の間で茎が伸長しないことです。これらの輪生は頂花序状に発達し、萼片、花弁、雄しべ、心皮になります。栄養分裂組織とのもう一つの違いは、花分裂組織は「決定的」であるという点です。つまり、一度分化すると、その細胞はそれ以上分裂しなくなります。[ 16 ]
4つの花被片に存在する器官の同一性は、それぞれ異なる機能を持つ少なくとも3種類の遺伝子産物の相互作用の結果である。ABCモデルによれば、機能Aと機能Cは、それぞれ花被片と生殖片の同一性を決定するために必要である。これらの機能は排他的であり、どちらか一方が欠如すると、もう一方の機能がすべての花被片の同一性を決定する。機能Bは、二次花被片における花弁と萼片の分化、および三次花被片における雄蕊と心皮の分化を可能にする。
フローラルな香り
植物は、花の形、花、そして香りを利用して、様々な昆虫を誘引し、受粉を促します。放出される香りに含まれる特定の化合物は、特定の花粉媒介者を惹きつけます。ペチュニア・ハイブリダでは、揮発性のベンゼノイドが生成され、花の香りを放ちます。ベンゼノイド生合成経路の構成要素は既知ですが、その経路を構成する酵素、そしてそれらの酵素の制御機構は未だ解明されていません。[ 17 ]
経路制御を決定するために、P. hybrida Mitchell の花を花弁特異的マイクロアレイで使用して、香りを出そうとしている花と、揮発性ベンゼノイドをほとんど生成しないP. hybrida栽培品種 W138 の花を比較しました。両方の植物の遺伝子の cDNA を配列決定しました。結果は、Mitchell の花で上方制御されている転写因子があるが、花の芳香を欠く W138 の花では上方制御されていないことを実証しました。この遺伝子は ODORANT1 (ODO1) と名付けられました。一日を通しての ODO1 の発現を決定するために、RNA ゲルブロット分析を行いました。ゲルは、ODO1 転写レベルが 13:00 から 16:00 の間に増加し始め、22:00 にピークに達し、10:00 に最低になることを示しました。これらの ODO1 転写レベルは、揮発性ベンゼノイド放出のタイムラインに直接対応しています。さらに、ゲルは、W138無香花のODO1転写産物レベルがミッチェル花の10分の1に過ぎないという以前の知見を裏付けました。したがって、ODO1の産生量は揮発性ベンゼノイドの放出量に対応しており、ODO1がベンゼノイドの生合成を制御していることを示唆しています。[ 17 ]
主要な芳香化合物の生合成に寄与する追加の遺伝子は、OOMT1とOOMT2です。OOMT1とOOMT2は、DMT経路の最後の2つのステップを触媒して3,5-ジメトキシトルエン(DMT)を生成するオルシノールO-メチルトランスフェラーゼ(OOMT)の合成を促進します。DMTは多くの異なるバラによって生成される芳香化合物ですが、Rosa gallicaやダマスクローズRosa damasceneなど、一部のバラの品種はDMTを生成しません。これらの品種はOOMT遺伝子を持たないためDMTを生成しないと考えられてきました。しかし、免疫局在実験の後、OOMTは花弁の表皮で発見されました。これをさらに研究するため、バラの花びらを超遠心分離にかけました。上清とペレットをウエスタンブロットで検査しました。 150,000gで上清およびペレット中にOOMTタンパク質が検出されたことから、研究者らはOOMTタンパク質が花弁表皮膜と密接に関連していると結論付けました。このような実験により、OOMT遺伝子はRosa gallicaおよびダマスクローズ(Rosa damascene)の品種に存在するものの、DMTが生成される花組織ではOOMT遺伝子は発現していないことが判明しました。[ 18 ]
参考文献
- ^ Bäurle, I; Laux, T (2003). 「頂端分裂組織:植物の若返りの泉」. BioEssays . 25 (10): 961–70 . doi : 10.1002/bies.10341 . PMID 14505363 .レビュー。
- ^ Drost, Hajk-Georg; Janitza, Philipp; Grosse, Ivo; Quint, Marcel (2017). 「発生的砂時計の界間比較」 . Current Opinion in Genetics & Development . 45 : 69–75 . doi : 10.1016/j.gde.2017.03.003 . PMID 28347942 .
- ^入江直樹、倉谷茂 (2011-03-22). 「比較トランスクリプトーム解析により、器官形成期における脊椎動物の系統発生期が明らかになる」 . Nature Communications . 2 248. Bibcode : 2011NatCo...2..248I . doi : 10.1038/ncomms1248 . ISSN 2041-1723 . PMC 3109953. PMID 21427719 .
- ^ Domazet-Lošo, Tomislav; Tautz, Diethard (2010-12-09). 「系統発生学的トランスクリプトーム年齢指標は個体発生的分岐パターンを反映する」. Nature . 468 ( 7325): 815– 818. Bibcode : 2010Natur.468..815D . doi : 10.1038/nature09632 . ISSN 0028-0836 . PMID 21150997. S2CID 1417664 .
- ^クイント、マルセル;ドロスト、ハイク・ゲオルク。ゲイベル、アレクサンダー。ウルリッヒ、クリスチャン・カルステン。ボン、マルクス。グロッセ、イーヴォ (2012-10-04)。 「植物の胚形成におけるトランスクリプトームの砂時計」。自然。490 (7418): 98–101。ビブコード: 2012Natur.490...98Q。土井:10.1038/nature11394。ISSN 0028-0836。PMID 22951968。S2CID 4404460。
- ^ Drost, Hajk-Georg; Gabel, Alexander; Grosse, Ivo; Quint, Marcel (2015-05-01). 「動物および植物の胚発生における系統的トランスクリプトミクス砂時計パターンの能動的な維持の証拠」 . Molecular Biology and Evolution . 32 (5): 1221– 1231. doi : 10.1093/molbev / msv012 . ISSN 0737-4038 . PMC 4408408. PMID 25631928 .
- ^レオポルド、A.カール(1964年)。「動物とそこにいる若いもの」マグロウヒル。183ページ。
- ^ Brand, U; Hobe, M; Simon, R (2001). 「植物シュート分裂組織における機能ドメイン」. BioEssays . 23 ( 2): 134– 41. doi : 10.1002/1521-1878(200102)23:2<134::AID-BIES1020>3.0.CO;2-3 . PMID 11169586. S2CID 5833219 . レビュー。
- ^ Barlow, P (2005). 「植物組織におけるパターン化された細胞決定:樹木の二次師管」. BioEssays . 27 (5): 533–41 . doi : 10.1002/bies.20214 . PMID 15832381 .
- ^ Ross, SD; Pharis, RP; Binder, WD 1983. 成長調整剤と針葉樹:その生理学と林業における潜在的用途。p. 35–78、 Nickell, LG (編)『植物成長調整化学物質』第2巻、CRC Press、フロリダ州ボカラトン。
- ^ジョーンズ、シンシア・S. (1999年11月1日). 「種子植物における若齢性、相変化、および異胚性に関する考察」.国際植物科学ジャーナル. 160 (S6): 105–S111. Bibcode : 1999IJPlS.160S.105J . doi : 10.1086 / 314215 . ISSN 1058-5893 . PMID 10572025. S2CID 21757481 .
- ^ McVeigh, I. 1938. Crassula multicavaの再生. American Journal of Botany 25: 7-11. [1]
- ^ Drew, MC; Jackson, MB; Giffard, S. (1979). 「エチレン促進による不定発根と根の皮質気孔(通気組織)の発達は、トウモロコシ(Zea mays L.)における浸水への適応反応である可能性がある」 . Planta . 147 ( 1): 83– 88. Bibcode : 1979Plant.147...83D . doi : 10.1007/BF00384595 . PMID 24310899. S2CID 7232582 .
- ^ネイマン, ロバート・J.; デカンプス, アンリ (1997). 「境界面の生態学:河岸地帯」 . Annual Review of Ecology and Systematics . 28 (1): 621– 658. Bibcode : 1997AnRES..28..621N . doi : 10.1146 / annurev.ecolsys.28.1.621 . JSTOR 2952507. S2CID 86570563 .
- ^ De Klerk, Geert-Jan; Van Der Krieken, Wim; De Jong, Joke C. (1999). 「不定根の形成に関する考察:新たな概念、新たな可能性」 . In Vitro Cellular & Developmental Biology - Plant . 35 (3): 189– 199. Bibcode : 1999IVCDB..35..189D . doi : 10.1007/s11627-999-0076-z . S2CID 44027145 .
- ^アスコン=ビエト;他。 (2000年)。Fundamentos de fisiología vegetal。マグロウヒル/インターアメリカーナ・デ・エスパーニャ、SAU。ISBN 84-486-0258-7。
- ^ a b Schuurink, Robert C.; Haring, Michel A.; Clark, David G. (2006). 「ペチュニアの花における揮発性ベンゼン類の生合成制御」. Trends in Plant Science . 11 (1): 20– 25. doi : 10.1016/j.tplants.2005.09.009 . PMID 16226052 .
- ^ Scalliet, Gabriel; et al. (2006-01-01). 「バラの香りの進化における花弁特異的オルシノールO-メチルトランスフェラーゼの役割」 . Plant Physiology . 140 (1): 18– 29. doi : 10.1104/pp.105.070961 . ISSN 1532-2548 . PMC 1326028. PMID 16361520 .