仮想コロニー数(VCC )は、もともとディフェンシンの活性を測定するために開発された、96ウェルの動態学的微生物学的 アッセイです。[1] その後、LL-37などの他の抗菌ペプチドにも適用されています。[2] これは、細菌のバッチ培養が閾値光学密度に達するのにかかる時間を一連の較正曲線の時間と比較する、定量的増殖速度論と呼ばれる細菌を列挙する方法を利用します。 VCC という名称は、細胞培養感染モデルで細菌を列挙するために定量的増殖速度論の適用を説明するためにも使用されています。[3] 抗菌薬感受性試験(AST)は、細菌を接種したブロスでさまざまな濃度の抗菌剤を希釈し、増殖が起こらない最小発育阻止濃度を測定することにより、96ウェルプレートで行うことができます。 ただし、これらの方法は、ブロス自体によって阻害される一部の膜活性抗菌ペプチドの研究には使用できません。仮想コロニーカウント法では、この事実を利用し、まず細菌細胞を低塩緩衝液中の活性抗菌剤に2時間曝露し、次に培養液を加えることで抗菌活性を阻害すると同時に指数関数的な増殖を誘導します。生存細胞の増殖速度は、温度制御プレートリーダーを用いてモニタリングできます。各増殖曲線が光学密度の閾値変化に達するまでの時間を仮想生存値に変換し、抗菌活性の指標として用います。
抗菌薬感受性試験
抗菌剤の抗菌活性を試験する方法は、何十年も前から存在しています。[4] [5] 通常、これらの方法では、細菌が旺盛に増殖できる栄養素の存在下で、細菌を抗菌剤にさらします。実験は、固体支持体として寒天を含むプレート上、または寒天を含まない液体培地で行うことができます。[6] 多くの低分子抗生物質がこれらの方法を使用して開発されました。ただし、一部の抗菌ペプチドの抗菌活性を調べたい場合、寒天プレートで供給されても培地に含まれていても、それらのペプチドは栄養培地によって阻害されるため、複雑な問題が発生しました。たとえば、ディフェンシンは、ヒトを含む多くの生物の自然免疫システムの一部である抗菌ペプチドです。ジスルフィド結合のパターンに基づいて、アルファ、ベータ、シータなど、いくつかの構造クラスに分類されます。好中球顆粒には4種類のヒトαディフェンシンが存在し、これらはヒト好中球ペプチド(HNP)1-4として知られています。ディフェンシン研究の初期段階で、HNPは生理的塩濃度によって強く阻害されることが発見されました。HNPの抗菌活性を測定するには、まず低塩濃度緩衝液中で細胞とインキュベートし、その後、生存細胞を数えられるよう栄養培地を加えるという、別の初期ステップが必要でした。HNP1のようなディフェンシンペプチドを生理学的に適切な塩濃度下で測定する方法はないため、HNP1活性を測定するアッセイは、体内に存在する条件とは異なる条件下で行われます。
伝統的なコロニーカウント
液体中の抗菌活性を測定するために一般的に用いられる方法の一つは、例えば2時間などの培養時間中に抗菌剤を細胞に曝露し、その後、混合物を希釈し、液体の一部を栄養培地を含む寒天培地プレートに塗布することによって生存細胞を数えることである。[2]培養工程は通常96ウェルプレート上で行われる。塗布後、寒天培地プレートを一晩培養し、翌日にコロニー形成単位(CFU)の数を数える。これらの方法には、希釈工程で不正確さが生じることや、プレートあたり許容できる数のコロニーを生成するために多数の寒天培地プレートが必要になる可能性があることなど、いくつかの欠点がある。[7] ディフェンシンなどの抗菌剤の抗菌活性を測定するために、2時間の培養工程は10 mMリン酸ナトリウム pH 7.4などの低塩緩衝液中で行われることに留意されたい。
最小発育阻止濃度
液体中の抗菌活性を測定するために一般的に用いられるもう一つの方法は、96ウェルプレート内のミュラーヒントン培地(MHB)などの濃厚培地中の細胞に抗菌剤の希釈系列を曝露し、96ウェルプレートを37℃で一晩培養する方法です。各ウェルは細菌の増殖により濁るか、透明のままになります。最小発育阻止濃度(MIC)は、ウェルが透明になり、増殖を阻害する最低濃度として報告されます。[8] MHBを用いた標準化されたMIC法は、ディフェンシンなどの抗菌剤には適用できません。なぜなら、ディフェンシンの活性を測定するには、濃厚培地ではなく、低塩緩衝液で培養する必要があるからです。
仮想コロニー数
従来のコロニーカウント法は、低塩緩衝液で2時間培養した後、等量の2倍濃縮培養液を添加するだけで、ウェルをサンプリングして生存細胞を寒天培地に塗布することなく、96ウェルプレート内の抗菌活性を測定できるように改良することができます。バッチ培養では、培養期間終了時に生存している細胞数を決定する方法が必要です。幸いにも、指数関数的増殖の数学がまさにそれを実現する方法を提供しています。96ウェルプレート内のバッチ培養の濁度、つまり光学密度をリアルタイムでモニタリングし、ウェルが閾値に達するまでの時間を記録し、指数関数的に増殖する細胞の倍加時間がわかれば、接種物に元々存在していた細胞数を計算できます。この開始時の細胞数は、抗菌剤を添加した2時間の培養終了時に生存している細胞数に等しくなります。この手順は実際のコロニー形成やコロニー計数を必要としないため、「仮想コロニー計数」と呼ばれています。これまで、VCC法は抗菌ペプチドに限定されていました。しかし、2倍濃縮のミュラーヒントンブロスが抗菌活性を不活化する限り、他の抗菌剤にも適用できる可能性があります。VCC法は殺菌活性と静菌活性の両方を検出できますが、両者を区別することはできません。ただし、静菌活性は、「入力」コントロールと「出力」コントロールの閾値時間の差を測定することで定量化できます(下記参照)。
VCCアッセイで使用するための一般的な実験手順
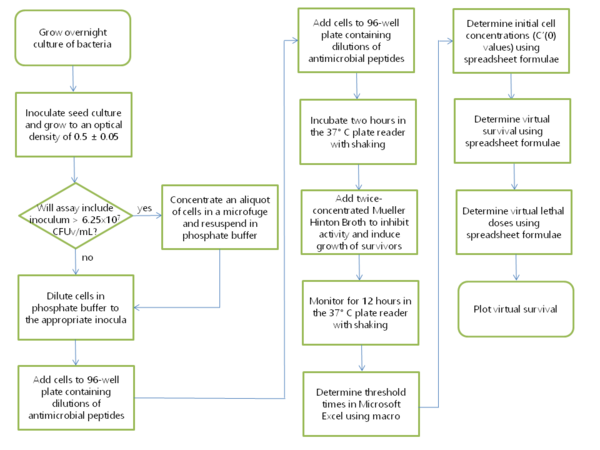
2 mLの細菌培養物を単一コロニーから接種し、リン酸ミュラーヒントン培地(PMH)またはリン酸ミュラーヒントントリプティックソイブロス(PMHT)培地で一晩培養します。PMHは、ミュラーヒントンブロスと10 mMリン酸ナトリウム(pH 7.4)の1:1混合物です。陽イオン調整済みまたは非陽イオン調整済みのMHBを使用できます。一部の実験では、2時間のインキュベーション中にディフェンシン活性を高めるために、リン酸緩衝液に1%トリプティックソイブロス(TSB)が含まれていました。この場合、緩衝液とブロスの類似の1:1混合物には0.5% TSBが含まれており、PMHTと呼ばれます。この培養物250 μlを、125 mL使い捨てフィルターフラスコ内の25 mLのPMHに移します。この培養物を、37 °C で 250 rpm で振盪しながら、通常 2~3 時間、650 nm での培養物の光学密度が 0.45 ~ 0.55 になるまで増殖させます。その間に、抗菌ペプチドを 96 ウェル プレート (Costar 3595、組織培養処理済み) で 10 mM リン酸ナトリウム pH 7.4 に希釈し、最終容量が 90 マイクロリットルになるようにします。仮想コロニー形成単位 (CFUv) は、VCC の元の出版物[1]で定義されており、その定義をここで繰り返します。CFUv は、各実験での濁度、つまり細胞膜の量がほぼ同じになるように、テストした 6 つの株間で一定に保たれました。CFUv はEscherichia coli ATCC 25922の CFU に標準化されているため、この株については CFUv ではなく CFU を報告できます。アッセイの実験部分では、細胞を10 mMリン酸ナトリウム(pH 7.4)で希釈し、10 µLあたりの最終細胞濃度が500万CFUv/mLとなるようにする。この細胞懸濁液10 µLを、抗菌ペプチド溶液90 µLの下にピペットで分注し、細胞を抗菌ペプチドに曝露している間の標準接種濃度5 x 10 5 CFUv/mLの細胞懸濁液を調製する。96ウェルプレートのいくつかのウェルは、抗菌剤に曝露されていない対照として用いる。これらは「出力」対照と呼ばれる。その後、96ウェルプレートをプレートリーダーで2時間インキュベートし、振盪設定と5分ごとの読み取りを行った。このインキュベーション時間中、種培養物は氷上に保持した。検量線を作成するために、2時間インキュベーション後、種培養物1 mLをPMH 1.5 mLに加え、10 8 CFUv/mLの懸濁液を調製した。この懸濁液を10倍希釈系列とし、10 7~ 10 0 CFUv/mlの範囲で、96ウェルプレートの8つのウェルに200μlのPMHを充填した。この時、氷上に保持した培養液から、抗菌剤に曝露されていない細胞をプレートのいくつかのウェルに添加した。これらは2時間の培養開始時に存在する細胞数を示すため、「インプット」コントロールと呼ばれる。最初に発表されたVCC実験[1]では、12 時間のインキュベーション中に蒸発によって端のウェルの容積が変わってしまったため、プレートの内側の 60 ウェルだけが使用されました。ただし、プレートの端を長さ 6 マス、幅 1/2 マスのパラフィルム M で包んでおけば、96 ウェル プレートの 96 ウェルすべてを実験に使用できます。ガス透過性パラフィルムは蒸発を遅らせる一方で細胞呼吸を可能にし、プレート リーダー内の 96 ウェル プレートに粒子状物質が吹き込まれるのを防ぎます。プレートをパラフィルムで包んだら、バイオ セーフティ キャビネットからプレート リーダーに移します。暖かい部屋に保管した Molecular Devices Vmax、Molecular Devices Spectramax、Tecan Infinite M1000 など、温度制御プレート リーダーのいくつかのモデルが VCC アッセイでうまく使用されています。プレート リーダーは、12 時間にわたって 5 分ごとに 650 nm で光学密度を読み取るように設定され、各読み取りの前に振盪されます。生データは Microsoft Excel にインポートされ、マクロ VCC Calculate が実行されて、各成長曲線が 0.02 の閾値光学密度に到達するのに必要な時間が決定されます。
定量的成長速度

VCCで用いられる生存細胞数の計数法[9]は、定量的増殖速度論(QGK)と呼ばれています。これは、96ウェルマイクロプレートのウェルにおける細菌バッチ培養の濁度が閾値差に達するまでの速度論的時間を、10倍希釈系列の検量線増殖曲線と関連付けるものです。
生細胞数の定量化は、定量的リアルタイムポリメラーゼ連鎖反応(QPCR)と数学的に同一のプロセスを用いて行われます。ただし、QGK細胞はPCR産物のコピーではなく、指数関数的に増殖します。閾値に達するまでの時間は「閾値時間」T tと呼ばれ、 QPCR値の「サイクル時間」C tに相当します。
VCC アッセイの閾値時間の遅延を引き起こすプロセスは少なくとも 5 つあります。
- 接着により細胞がマイクロプレートに付着し、バイオフィルムを形成する可能性があります。これらの細胞が光路に直接位置しない限り、その増殖は光学密度の測定値に影響を与えません。
- 凝集は、二分裂中の個々の細胞の均一な懸濁液ではなく、様々な大きさの塊に細胞を凝集させる。凝集はT tの不正確さと変動を引き起こす可能性がある。凝集塊は接着性も有する可能性があり、凝集による不正確さと接着による不正確さ(T t の上昇)の両方につながる。
- 静菌作用により、細胞は死滅していないにもかかわらず、指数関数的増殖を阻害します。一時的な静菌作用は遅延時間を引き起こし、T tを延長させる可能性があります。
- 細菌増殖における代謝遅延期。低塩緩衝液中の抗菌ペプチドへの初期曝露時には細胞が緩慢に増殖するか、全く増殖しない状態が、2倍濃度の濃厚培地の添加により指数関数的な増殖へと移行するため、本試験ではこのような遅延期が発生することが予想される。抗菌ペプチドの存在下でこの代謝遅延期が延長する場合、上記カテゴリー3の一過性細菌静止活性の一形態とみなされる可能性があるが、細胞壁や細胞膜などの損傷した細胞構造の修復に必要な時間による遅延など、他の一過性細菌静止活性の原因も考えられる。
- 殺菌活性、つまり殺菌。生存細胞数が少ないと、生存細胞が指数関数的な増殖によって同じ量の濁度を生成するのに時間がかかるため、 T tが遅延します。T tの上昇を引き起こす他のすべてのプロセスが無視できる場合、VCCアッセイは殺菌アッセイとなり、T tはQGKによる生菌数の計数に使用できます。この簡略化されたケースでは、VCCの「仮想生存」結果は、従来のコロニーカウント殺菌アッセイの「生存」結果と同等です。
細菌
VCCは当初、大腸菌、黄色ブドウ球菌、セレウス菌、エンテロバクター・アエロゲネスの6株に対するペプチドの抗菌活性を定量化するために採用されました。[1] 一般的には、標準的なグラム陰性株とグラム陽性株の 品質管理株が比較されます。 大腸菌 ATCC 25922と黄色ブドウ球菌ATCC 29213は、それぞれ標準的なグラム陰性株とグラム陽性株として使用されています。VCCは炭疽病の原因菌である炭疽菌にも適用されています。[10] さらに、VCCはサルモネラ・エンテリカ血清型チフス菌[11]とアシネトバクター・バウマニにも適用されています。[12]
抗菌ペプチド
最初のバーチャルコロニーカウント研究では、6種類のヒトアルファディフェンシン(HNP1、HNP2、HNP3、HNP4、HD5、HD6)の活性を同じ96ウェルプレートで同時に測定した。[1] その後、これら6種類のディフェンシンのうちいくつかの変異体がVCCで研究された。HNP2のベータバルジ内の保存されたグリシンが一連のD-アミノ酸に置換された結果、VCCの活性は側鎖の疎水性と電荷に比例するようになった。[13] VCCは、N末端がアセチル化および/またはC末端がアミド化されたHNP2の活性は静電荷に比例することを示した。[14] VCCの結果は、一連の塩橋破壊変異体に対しても電荷に比例し、塩橋はHNP2の機能には必要ないことを示唆している。[15] VCCは、プロペプチドHNP1 のN末端天然および人工プロセグメントの重要性を測定し、大腸菌および黄色ブドウ球菌に対する活性を劇的に変化させた。[16] [17]完全にD-アミノ酸で構成されるHNP1、HNP4、HD5、およびベータディフェンシン2のエナンチオマー形態は、グラム陽性菌およびグラム陰性菌に対するディフェンシン活性の異なるメカニズムを示唆した。[18] VCCの結果は、HNP1の二量体化障害のあるモノマーおよび連結された二量体形態から、二量体化 の重要性が実証された。[19] 保存されたグリシンをL-アラニンに置き換えると、VCCに微妙な違いが生じた。[20] HNP1 [21] [22]およびHD5 [23]の 包括的なアラニンスキャン変異誘発により、かさ高い疎水性残基の重要性が実証された。 HD5のジスルフィド還元はVCC活性を低下させたが、3種類のグラム陰性菌株に対するリポ多糖結合活性を増強した。[11] ジスルフィド結合を1つまたは全く持たないHD5変異体はA. baumanniiに対するVCC活性が大幅に低下したが、ジスルフィド還元とアルギニン導入によって構築されたHD5の単純化誘導体は、 A. baumanniiの多剤耐性菌株に対して強力な活性を示した。[12]これらの研究は、追加のベータデフェンシン を含めるように拡張されている。 、シータデフェンシン[10]、ヒトカテリシジンLL-37および関連ペプチド[2]。 マウスクリプトジンの研究における仮想コロニーカウントの結果は、クリプトジンによる大腸菌の殺菌は、 S.aureusの殺菌に重要な三次構造および四次構造とは一般に無関係であることを示しており、これは2つの異なる作用機序を示唆している。[24]
接種効果
多くの抗菌剤について、細菌をアッセイに追加すると薬剤の効果が低下するという接種効果は以前から説明されている。[25] この効果は、ベータラクタマーゼ産生細菌に対してアッセイを行った場合、ベータラクタムでよく観察される。接種効果は、従来のコロニーカウントとVCCを並行して行ったHNP1、プロLL-37、LL-37の研究に関連している可能性がある。[2]そのレポートでは、従来のコロニーカウント生存値は、テストされたすべてのペプチドと株の仮想生存値よりも低いことがわかった。細菌の接種量は、使用された標準化された従来のコロニーカウントプロトコルと比較してVCCアッセイで20倍多かったため、この差は接種効果によるものであった可能性があるが、接種量が多いほど活性が高まったため、この効果は他の抗菌剤で通常見られる接種効果とは逆であったと思われる。この可能性は、主にデフェンシンHNP1と大腸菌、黄色ブドウ球菌、セレウス菌を対象とした一連のVCC実験で調査された。6つの実験の結果、HNP1は大腸菌に対して顕著な接種効果を示した。[26]
定量的な成長速度を分析するアルゴリズム
仮想生存率と仮想致死量の計算に使用される複雑なMicrosoft Excelスプレッドシートと、閾値時間を計算するために使用されるVisual Basicマクロが公開されている。[26]
安全で効果的なピペッティング技術
VCC ユーザーは、10 マイクロリットルなどの小容量の細胞を 90 マイクロリットルなどの大容量の細胞の下に移すように注意が必要です。これは、上に示した QGK 検量線や最初の VCC 出版物で報告された検量線に似ていますが[1]、同じ論文でディフェンシン活性をテストするために使用された実験手順とは異なります。改良されたピペッティング手法は、2011 年にバイオ セーフティレベル 3 (BSL-3)病原体である 炭疽菌の研究で説明されました[10]。2005 年に発表された最初の方法では、50 マイクロリットルの細胞懸濁液を 50 マイクロリットルの液体に移す必要があり、これにより泡や気泡、濁度が生成され、細胞をリン酸緩衝液の下のウェルの底に直接移す場合の濁度測定法とは互換性がありません。この問題を回避するために、上から液滴として細胞懸濁液を追加すると、エアロゾルが発生して交差汚染につながる可能性があります。[27]危険な細菌の バイオエアロゾルも安全上のリスクをもたらす可能性があるが、バイオセーフティキャビネット内で実験を行うことでリスクを軽減できる。
参考文献
 この記事は2019年にWikiJournal of Scienceに外部学術査読のために提出されました(査読者レポート)。更新されたコンテンツは、CC-BY-SA-3.0ライセンス( 2021年)に基づきWikipediaページに再統合されました。査読後の正式版は、Bryan Ericksen; et al. (16 February 2020). "Virtual colony count" (PDF) . WikiJournal of Science . 3 (1): 3. doi : 10.15347/WJS/2020.003 . ISSN 2470-6345. Wikidata Q86161728. です。
この記事は2019年にWikiJournal of Scienceに外部学術査読のために提出されました(査読者レポート)。更新されたコンテンツは、CC-BY-SA-3.0ライセンス( 2021年)に基づきWikipediaページに再統合されました。査読後の正式版は、Bryan Ericksen; et al. (16 February 2020). "Virtual colony count" (PDF) . WikiJournal of Science . 3 (1): 3. doi : 10.15347/WJS/2020.003 . ISSN 2470-6345. Wikidata Q86161728. です。
- ^ abcdef Ericksen B, Wu Z, Lu W, Lehrer RI (2005). 「6種類のヒトα-ディフェンシンの抗菌活性と特異性」. Antimicrob. Agents Chemother . 49 (1): 269– 75. doi :10.1128/AAC.49.1.269-275.2005. PMC 538877. PMID 15616305 .
- ^ abcd Pazgier M, Ericksen B, Ling M, Toth EA, Shi J, Li X, Galliher-Beckley A, Lan L, Zou G, Zhan C, Yuan W, Pozharski E, Lu W (2013). 「ヒトカテリシジンLL-37のプロドメインの構造および機能解析」.生化学. 52 (9): 1547– 58. doi :10.1021/bi301008r. PMC 3634326. PMID 23406372 .
- ^ Hoffmann S, Walter S, Blume AK, Fuchs S, Schmidt C, Scholz A, Gerlach RG (2018). 「仮想コロニーカウントを用いた細菌-細胞相互作用のハイスループット定量化」. Front Cell Infect Microbiol . 8 (43): 43. doi : 10.3389/fcimb.2018.00043 . PMC 5818393. PMID 29497603 .
- ^ Jenkins SG, Schuetz AN (2012). 「抗菌療法の指針となる臨床検査の最新概念」. Mayo Clin Proc . 87 (3): 290– 308. doi :10.1016/j.mayocp.2012.01.007. PMC 3496983. PMID 22386185 .
- ^ Jorgensen JH, Ferraro MJ (2009). 「抗菌薬感受性試験:一般原則と現代的実践のレビュー」. Clin Infect Dis . 49 (11): 1749–55 . doi : 10.1086/647952 . PMID 19857164.
- ^ Jeannot K, Plésiat P (2014). 「希釈法による薬剤感受性試験」. Pseudomonas Methods and Protocols . Methods Mol Biol. Vol. 1149. pp. 49– 58. doi :10.1007/978-1-4939-0473-0_6. ISBN 978-1-4939-0472-3. PMID 24818896。
- ^ Breed RS, Dotterrer WD (1916). 「適切な寒天培地上で許容されるコロニー数」. J Bacteriol . 1 (3): 321–31 . doi :10.1128/JB.1.3.321-331.1916. PMC 378655. PMID 16558698 .
- ^ M07 好気性細菌の希釈抗菌薬感受性試験法(PDF)臨床検査標準研究所 2018年
- ^ Brewster, JD. (2003). 「細菌数え上げのための簡易マイクログロースアッセイ」J Microbiol Methods 53 ( 1): 77– 86. doi :10.1016/S0167-7012(02)00226-9. PMID 12609726.
- ^ abc Welkos S, Cote CK, Hahn U, Shastak O, Jedermann J, Bozue J, Jung G, Ruchala P, Pratikhya P, Tang T, Lehrer RI, Beyer W (2011). 「ヒト化シータデフェンシン(レトロサイクリン)はマクロファージの機能を高め、マウスを実験的炭疽菌感染から保護する」. Antimicrob. Agents Chemother . 55 (9): 4238–50 . doi :10.1128/AAC.00267-11. PMC 3165295. PMID 21768520 .
- ^ ab ワン、チェン;シェン、ミン強。張、内新。王、宋。徐、楊。チェン、シーレイ。チェン、ファン;楊、柯。彼、ティン。王、愛平。スー・ヨンピン。チェン、ティアンミン。趙景紅。王俊平(2016)。 「還元は抗菌活性を損なうが、ヒト腸溶性ディフェンシン 5 の LPS 中和能力には利益をもたらします。」科学的報告書。6 22875。Bibcode :2016NatSR...622875W。土井:10.1038/srep22875。PMC 4785407。PMID 26960718。
- ^ ab Wang C, Zhao G, Wang S, Chen Y, Gong Y, Chen S, Xu Y, Hu M, Wang X, Zeng H, Wang A, Liu D, Su Y, Cheng T, Chen F, Wang J (2011). 「多剤耐性アシネトバクター・バウマニに対する強力かつ効率的な活性を有するヒトデフェンシン5の簡略化誘導体」. Antimicrob. Agents Chemother . 62 (2): e01504-17. Bibcode :2016NatSR...622875W. doi :10.1038/srep22875. PMC 5786806. PMID 29158275 .
- ^ Xie C, Prahl A, Ericksen B, Wu Z, Zeng P, Li X, Lu WY, Lubkowski J, Lu W (2005). 「D-アミノ酸を用いた哺乳類ディフェンシンにおける保存されたβバルジの再構築」J Biol Chem . 280 (38): 32921–9 . doi : 10.1074/jbc.M503084200 . PMID 15894545.
- ^ Xie C, Zeng P, Ericksen B, Wu Z, Lu WY, Lu W (2005). 「ヒト好中球α-デフェンシン2の末端電荷が殺菌活性および膜活性に及ぼす影響」.ペプチド. 26 (12): 2377–83 . doi :10.1016/j.peptides.2005.06.002. PMID 16009464. S2CID 8613489.
- ^ Wu Z, Li X, de Leeuw E, Ericksen B, Lu W (2005). 「なぜ哺乳類α-ディフェンシンにおいてArg5-Glu13塩橋は保存されているのか?」J Biol Chem . 280 (52): 43039– 47. doi : 10.1074/jbc.M510562200 . PMID 16246847.
- ^ Wu Z, Li X, Ericksen B, de Leeuw E, Zou G, Zeng P, Xie C, Li C, Lubkowski J, Lu WY, Lu W (2007). 「プロセグメントがヒト好中球αデフェンシンのフォールディングと機能に与える影響」J Mol Biol . 368 (2): 537– 49. doi :10.1016/j.jmb.2007.02.040. PMC 2754399. PMID 17355880 .
- ^ Zou G, de Leeuw E, Lubkowski J, Lu W (2008). 「ヒト好中球αデフェンシン1とそのプロペプチドとの相互作用を決定する分子因子」J Mol Biol . 381 (5): 1281–91 . doi :10.1016/j.jmb.2008.06.066. PMC 2754386. PMID 18616948 .
- ^ Wei G, de Leeuw E, Pazgier M, Yuan W, Zou G, Wang J, Ericksen B, Lu WY, Lehrer RI, Lu W (2009). 「鏡を通して見る:エナンチオマーヒトデフェンシンからのメカニズム的洞察」J Biol Chem . 284 (42): 29180–92 . doi : 10.1074/jbc.M109.018085 . PMC 2781462 . PMID 19640840.
- ^ Pazgier M, Wei G, Ericksen B, Jung G, Wu Z, de Leeuw E, Yuan W, Szmacinski H, Lu WY, Lubkowski J, Lehrer RI, Lu W (2012). 「Sometimes it takes two to tango: contributions of dimerization to functions of human α-defensin HNP1 peptide. J Biol Chem . 287 (12): 8944–53 . doi : 10.1074/jbc.M111.332205 . PMC 3308808. PMID 22270360 .
- ^ Zhao L, Ericksen B, Wu X, Zhan C, Yuan W, Li X, Pazgier M, Lu W (2012). 「不変グリシン残基はα-ディフェンシンのフォールディング、二量体化、および機能に重要である:ヒト好中球α-ディフェンシンHNP1の事例研究」J Biol Chem . 287 (23): 18900–12 . doi : 10.1074/jbc.M112.355255 . PMC 3365925 . PMID 22496447.
- ^ Wei G、Pazgier M、de Leeuw E、Rajabi M、Li J、Zou G、Jung G、Yuan W、Lu WY、Lehrer RI、Lu W (2010)。 「Trp-26はヒトαディフェンシンHNP1に機能的多様性を与える」。Jバイオルケム.285 (21): 16275–85 .土井: 10.1074/jbc.M110.102749。PMC 2871495。PMID 20220136。
- ^ Zhao L, Tolbert WD, Ericksen B, Zhan C, Wu X, Yuan W, Li X, Pazgier M, Lu W (2013). 「オリゴマー界面における1、2、4重アラニン置換が、ヒト好中球αデフェンシンHNP1の機能決定における重要な因子として疎水性を同定する」. PLOS ONE . 8 (11) e78937. Bibcode :2013PLoSO...878937Z. doi : 10.1371/journal.pone.0078937 . PMC 3827289. PMID 24236072 .
- ^ Rajabi M、Ericksen B、Wu X、de Leeuw E、Zhao L、Pazgier M、Lu W (2012). 「ヒト腸溶性αディフェンシンHD5の機能的決定因子:二量体界面における疎水性に対する重要な役割」。Jバイオルケム.287 (26): 21615–27 .土井: 10.1074/jbc.M112.367995。PMC 3381126。PMID 22573326。
- ^ Wang Q, Yang Y, Luo G, Zhou Y, Tolbert WD, Pazgier M, Liao C, Lu W (2023). 「マウスα-デフェンシン:単一小腸陰窩から同定された17種のクリプトジンアイソフォームの構造および機能解析」. Infect Immun . 91 (1): e0036122. doi : 10.1128/iai.00361-22 . PMC 9872612. PMID 36472443 .
- ^ Brook I (1989). 「接種効果」Rev Infect Dis . 11 (3): 361–8 . doi :10.1093/clinids/11.3.361. PMID 2664999.
- ^ ab Ericksen B, et al. (2020). 「仮想コロニーカウント」. WikiJournal of Science . 3 (1): 3. doi : 10.15347/wjs/2020.003 .
- ^ Ericksen B (2014). 「エアロゾルを避けるために接着性および凝集性大腸菌細胞をマイクロプレートに移す方法の安全性、有効性および有用性」F1000Res . 3 : 267. doi : 10.12688/f1000research.5659.2 . PMC 4309163 . PMID 25671086.
外部リンク
- 疾病管理予防センター 微生物学および生物医学研究室におけるバイオセーフティ(BMBL)第6版