カッパ-ブンガロトキシン
κ-ブンガロトキシン(カッパ-ブンガロトキシン)は、ブンガロトキシン科に属する神経毒です。この神経毒は、ナミヘビ(Bungarus multicinctus )の毒に含まれています。[ 1 ]このヘビは、中国、ミャンマー、ラオス、北ベトナム、タイに生息しています。[ 2 ]この毒素は、神経細胞のニコチン性アセチルコリン受容体を攻撃し、神経伝達を阻害します。この種のヘビによる咬傷はまれですが、致死率は7%から50%です。Bungarus multicinctusに咬まれた場合、6時間から30時間で死亡する可能性があります。[ 3 ]

歴史
この神経毒は、1983年に研究者らがヘビ毒の神経筋伝達への影響を研究していた際に報告されました。それ以来、κ-ブンガロトキシンはシナプス伝達、コリン作動性シナプス、そしてニコチン性アセチルコリン受容体(nAChR)に関する知識の発展に貢献してきました。[ 4 ] κ-ブンガロトキシンは、様々なnAChRに対する特異性から、現在でも広く研究に利用されています。
この毒素の「カッパ」という名称は、ラテン語の「キリアリス」に由来する。キリアリスは「目に関係する」という意味で、毛様体神経節の名前の由来にもなっている。[ 5 ] κ-ブンガロトキシンと同様に、「毒素F」と「ブンガロトキシン2.1」と名付けられた2つの毒素がタンパク質配列によって同定された。[ 6 ]
化学情報ボックス
| プロパティ | |
|---|---|
| 写真 | 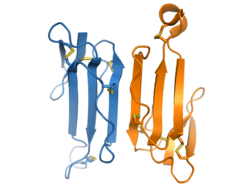 κ-ブンガロトキシンの構造 κ-ブンガロトキシンの構造 |
| 別名 | カッパbgt κ-ブンガロトキシン カッパ-1-ブンガロトキシン |
| 生物名 | Bungarus multicinctus(ナミアオアシガメ) |
| 表現の場 | 毒腺 |
| 毒素ファミリー | 3本指毒素(3FTx)[22] |
| 分子式 | C 303 H 475 N 91 O 97 S 10 |
| 分子量 | 7313日 |
| 順序 | RTCLISPSSTPQTCPNGQDICFLKAQCDKFCSIRGPVIEQGCVATCPQFRSNYRSLLCCT TDNCNH-OH |
| 外観 | 典型的には結晶性または凍結乾燥されたタンパク質粉末として精製される |
| 臭い | 精製された状態では無臭 |
| 溶解度 | 水に溶ける |
| 主な危険 | 有毒 |
| ピクトグラム |  急性毒性に関する世界調和シンボル 急性毒性に関する世界調和シンボル |
構造と反応性
κ-ブンガロトキシンは、66個のアミノ酸からなる単一のポリペプチド鎖を有する。この鎖の総重量は7313DAである。2つの単一のポリペプチド鎖は結合して二量体を形成する。二量体のサブユニットは3つの主鎖ループから構成され、これらのループは178.6度回転する。[ 8 ]
κ-ブンガロトキシンは全体として10本のβストランドを有し、6本鎖の反平行βシート構造を形成します[8]。これは、二量体を構成する各サブユニットの5本のβストランドのうち3本によって形成されます[ 9 ]。Arg34は各サブユニットの中央ループの頂点に位置します[ 9 ] 。ループIIIの外側のストランドは反平行構造を形成します。
κ-ブンガロトキシン二量体は、ジスルフィド結合、水素結合、ファンデルワールス結合を形成できます。
- 水素結合:6つの主鎖水素結合と3つの側鎖水素結合が形成される[ 9 ]
- ファンデルワールス相互作用: Phe 49 と Leu 57 は二量体を越えてファンデルワールス相互作用を形成できます[ 10 ]
- ジスルフィド結合:ポリペプチド鎖には10個のシステイン残基があり、5つのジスルフィド結合を形成できる[ 11 ]
この毒素はシナプス後膜のニコチン性アセチルコリン受容体(nAChR)に対して高い親和性を示し、IC 50が100 nM未満のα3受容体に多く作用する。[ 10 ]これは、非常に低濃度でもニコチン性伝達を阻害することを意味する。ループIIはnAChRへの結合に最も重要である。[ 12 ] 2つの結合表面は、どちらも受容体サブユニットのN末端細胞外領域である。これらは51-70残基と183-201残基である。α3受容体への結合において最も重要なのは、位置36のArg-34である。しかし、κ-ブンガロトキシンは神経筋受容体への親和性が低い。[ 9 ] [ 10 ]
利用可能なフォーム
κ-ブンガロトキシンは、ブンガラス・ムルティシンクトゥ(Bungarus multicinctu)の毒腺に天然に存在する[11] 。このポリペプチドは66個のアミノ酸から構成され、5つのジスルフィド結合によって架橋されている。これは、ラティカウダ・セミファシアタ(Laticauda semifasciata)から精製された毒であるLS-IIIと類似している[12]。
κ-ブンガロトキシンはヘテロ二量体を形成し、κ-2-ブンガロトキシンとκ-3-ブンガロトキシンを生成します。これらの違いは世界的に観察されています。κ-2-ブンガロトキシンはBungarus multicinctus毒に由来しますが、これらは中国広東省で蔓延しているのに対し、κ-ブンガロトキシンは台湾のB. multicinctusに見られます。[ 13 ]これらの形態は、それぞれの特定の地域において進化上の利点を持っている可能性があります。
κ-ブンガロトキシンの別の形態はα-ブンガロトキシンである。κ-ブンガロトキシンはα-ブンガロトキシンと47%の構造相同性を示すが、LS-IIIよりもさらに短いCOOH末端を有する。α-ブンガロトキシンもアミノ酸トリプタノフィルから構成されるが、これはκ-ブンガロトキシンには存在しない。α-ブンガロトキシンはκ-ブンガロトキシンよりも200倍強い親和性でニコチン受容体に結合する。[ 14 ]
最後に、β-ブンガロトキシンもブンガロトキシンファミリーに類似しています。β-ブンガロトキシンは、シナプス前終末におけるコリン輸送系の強力な阻害剤です。[ 15 ] β-ブンガロトキシンは受容体に結合せず、酵素的に結合するという点でブンガロトキシンと異なります。β-ブンガロトキシンは電位依存性カリウムチャネルに結合し、その後、神経内でホスホリパーゼA2を介した膜リン脂質の破壊が起こります。[ 16 ]
合成
κ-ブンガロトキシンの合成方法はいくつかあります。
- κ-ブンガロトキシンは、ブンガルス・ムルティシンタス(Bungarus multicinctus)の毒腺から抽出できます。抽出後、κ-ブンガロトキシンは分離・精製して利用する必要があります。[ 13 ]
- κ-ブンガロトキシンを生成するもう一つの方法は、毒素をコードする遺伝子を化学合成することです。この遺伝子を大腸菌に移植しても安定 した産物は得られません。しかし、この毒素をラット腸内脂肪酸と融合させたところ、融合タンパク質は切断部位のみが異なることが分かりました。これにより、κ-ブンガロトキシンは単離・精製することが可能になりました。[ 17 ]
- さらなる研究により、活性酵母であるピキア・パストリスが、生物学的に活性なκ-ブンガロトキシンを産生できることが発見されました。このプロセスでは、遺伝子やタンパク質の追加操作は必要ありません。さらに、産生量は大腸菌が産生するκ-ブンガロトキシンの5倍です。 [ 18 ]
メカニズムと毒性
κ-ブンガロトキシンはシナプス後神経毒として作用する。[ 14 ]シナプス後神経毒は、神経細胞のニコチン性アセチルコリン受容体(nAChR)の長期的で潜在的に不可逆的な競合的拮抗薬である。[ 14 ] α-ブンガロトキシンは筋肉のnAChRに特異的に結合するが、κ-ブンガロトキシンは中枢神経系および自律神経系、特に鳥類の毛様体神経節のnAChRのα3およびα4サブユニット(ただしα4はより少ない程度)を標的とする。これはnAChRのα3サブユニットが主要な神経節型であるためである。[ 19 ] [ 20 ]カッパブンガロトキシンの標的部位の1つはアルファブンガロトキシンの標的部位と同じであるが、ニコチン受容体の2番目の標的部位はκブンガロトキシンによってのみ結合される。[ 5 ]これは、神経細胞のnAChRには筋肉のnAChRよりも多様なサブユニットが含まれているためである。[ 21 ]
カッパブンガロトキシンは、神経細胞のnAChRのアセチルコリン結合部位に高い親和性で結合し、最終的にアセチルコリンが結合するためのこれらの受容体をブロックします。[ 14 ]通常、アセチルコリンによる神経細胞のnAChRの活性化は、いくつかの神経伝達物質を放出し、内向きのイオン流入を発生させ、活動電位を作り出します。[ 21 ] [ 22 ]しかし、カッパブンガロトキシンが神経細胞のnAChRに結合すると、75 nMで脱分極を阻害し、シナプス伝達を阻害します。[ 5 ]この遮断は、中枢神経系と神経節における神経伝達の破壊につながり、κ-ブンガロトキシンへの長期曝露で神経筋麻痺と呼吸不全を引き起こします。[ 13 ]
生体変換
ブンガロツキガメに咬まれると、毒は血流に入り、循環系に入り、最終的に中枢神経系と末梢神経系に到達します。κ-ブンガロトキシンはnAChRに高い親和性を持つため、毒はnAChRが豊富な組織を標的とします。[ 14 ] κ-ブンガロトキシンは長時間にわたり、不可逆的な結合を繰り返すため、血流中にはほとんど存在しませんが、中枢神経系と神経節に局在します。[ 14 ]結合していないnAChRは、これらの受容体のde novo合成 によってのみ利用可能となります。
κ-ブンガロトキシンの生体内変換は十分に研究されていないが、長鎖3フィンガー毒素(3FTx)ファミリーのメンバーはシナプス後膜のイオンチャネルを阻害する。[ 21 ] [ 23 ]そのため、この毒素は細胞外で作用し、シトクロムP450酵素によって生体内変換されないことが示唆されている。κ-ブンガロトキシンはタンパク質であるため、ペプチダーゼやリソソームなどの酵素によって徐々に分解される。その結果、内因性化合物の合成に利用可能な小さなペプチドやアミノ酸が得られる。しかし、κ-ブンガロトキシンの神経細胞nAChRに対する親和性は非常に高いため、リガンド-受容体複合体が形成される前にタンパク質の大部分は分解されない。[ 14 ]
動物毒性
κ-ブンガロトキシンは神経細胞のnAChRに選択的に結合し、神経伝達を阻害または遮断します。この毒素は様々な動物において異なる作用を示します。例えば、昆虫においては、κ-ブンガロトキシンは末梢腹部神経節の機械感覚ニューロンと介在ニューロン間のコリン作動性シナプスにおける伝達を遮断します。[ 24 ]また、ゴキブリの中胸神経節の運動ニューロンのnAChRも遮断します。[ 25 ]
線虫の筋肉中のnAChRは、α型ブンガロトキシンよりもκ型ブンガロトキシンに対して高い感受性を示した。他の毒素と比較して、筋肉受容体を阻害するために必要な濃度は100nMではなく10nMであった。これはまた、線虫は昆虫よりもκ型ブンガロトキシンに対して感受性が高いことから、動物種によって毒素の作用が異なることを意味している。[ 24 ]
ヒナにおいて、κ-ブンガロトキシンは骨格筋ニコチン性受容体に低い親和性で結合すると考えられる[12]。ヒナへの影響は報告されていないが、その作用機序から、低濃度のκ-ブンガロトキシンでは筋麻痺は全く起こらないか、あるいは軽度であると予想される。しかし、この毒素は自律神経節の神経ニコチン性受容体に高い親和性で結合し、低濃度でもシナプス伝達を阻害する可能性がある[ 26 ] 。これは呼吸不全などの影響を引き起こす可能性がある。
ヒトへの悪影響
咬まれた直後は、咬まれた部位にほとんど痛みを感じません。しかし、しばらくすると、言葉が不明瞭になり、嚥下が困難になり、めまいを感じることがあります。さらにしばらくすると、顔面から手足にかけて筋力低下が広がり、筋肉が軽度麻痺することもあります。この段階では、息切れなどの呼吸不全も起こることがあります。毒に侵されてから6~30時間後、被害者は動けなくなったり呼吸ができなくなったりすることがあります。酸素不足による心停止で死亡することもあります。台湾では、患者の約27.3%が全身の疼痛症状または呼吸不全を経験しました。[ 27 ]
台湾では特定の抗毒素が入手可能であるが、呼吸不全や痛みを効果的に予防できない可能性がある。[ 27 ]患者は中毒後最初の数時間以内に麻痺や呼吸困難の兆候がないか注意深く監視されなければならない。
参考文献
- ^ Grant, Gregory A.; Chiappinelli, Vincent A. (1985). 「.κ-ブンガロトキシン:神経ニコチン性受容体プローブの完全なアミノ酸配列」.生化学. 24 (6): 1532– 1537. doi : 10.1021/bi00327a036 .
- ^ 「爬虫類データベース」。
- ^マオ、ヤンチャオ;リュウ、ポーユ。蔣、廖春。リャオ、シューチェン。スー、フンユアン。シェ、スーイン。ヤン・チェンチャン (2017) 「台湾におけるBungarus multicinctus multicinctus ヘビ咬傷」。アメリカ熱帯医学衛生協会。96 (6): 1497–1504。土井: 10.4269/ajtmh.17-0005。PMC 5462592。PMID 28719273。
- ^ Chiappinelli, Vincent A.; Weaver, William R.; McLane, Katya E.; Conti-Fine, Bianca M.; Fiordalisi, James J.; Grant, Gregory A. (1996). 「ニコチン性アセチルコリン受容体への天然κ神経毒素および部位特異的変異体の結合」. Toxicon . 34 ( 11–12 ): 1243–1256 . Bibcode : 1996Txcn...34.1243C . doi : 10.1016/s0041-0101(96)00110-9 .
- ^ a b c Chiappinelli, VA (1983). κ-ブンガロトキシン:鳥類毛様体神経節における神経ニコチン受容体のプローブ. Brain Research, 277(1), 9-22
- ^ローリング, RH, アンドリュース, D., レーン, W., ジグモンド, RE (1986). 神経ニコチン受容体を阻害するヘビ毒毒素Fのアミノ酸配列. ブレイン・リサーチ, 385(1), 30-37
- ^アロモネ研究所。 (2025年1月8日)。 Κ-ブンガロトキシン | B-300 |アロモネ研究所https://www.alomone.com/p/%ce%ba-bungarotoxin/B-300
- ^ Dewan, John C.; Grant, Gregory A.; Sacchettini, James C. (1994). 「κ-ブンガロトキシンの2.3Å分解能における結晶構造」.生化学. 33 (44): 13147– 13154. doi : 10.1021/bi00248a026 . PMID 7947721 .
- ^ a b c d Dewan, John C.; Grant, Gregory A.; Sacchettini, James C. (1994). 「κ-ブンガロトキシンの2.3Å分解能における結晶構造」.生化学. 33 (44): 13147– 13154. doi : 10.1021/bi00248a026 . PMID 7947721 .
- ^ a b c Chiappinelli, Vincent A.; Weaver, William R.; McLane, Katya E.; Conti-Fine, Bianca M.; Fiordalisi, James J.; Grant, Gregory A. (1996). 「ニコチン性アセチルコリン受容体への天然κ神経毒素および部位特異的変異体の結合」. Toxicon . 34 ( 11– 12): 1243– 1256. Bibcode : 1996Txcn...34.1243C . doi : 10.1016/s0041-0101(96)00110-9 .
- ^ Grant, Gregory A.; Chiappinelli, Vincent A. (1985). 「.κ-ブンガロトキシン:神経ニコチン性受容体プローブの完全なアミノ酸配列」.生化学. 24 (6): 1532– 1537. doi : 10.1021/bi00327a036 .
- ^ Fiordalisi, JJ, Al-Rabiee, R., Grant, GA, & Chiappinelli, VA (1994). κ-ブンガロトキシンの部位特異的変異誘発:神経受容体特異性への影響. 生化学, 33(13), 3872-3877
- ^ a b c Chiappinelli, VA, Wolf, KM, Grant, GA, & Chen, SJ (1990). κ2-ブンガロトキシンとκ3-ブンガロトキシン:ブンガラス・ムルティシンタスの毒から単離された2つの新しい神経ニコチン受容体拮抗薬. Brain Research, 509(2), 237-248
- ^ a b c d e f g Wolf, Kathleen M.; Ciarleglio, Anita; Chiappinelli, Vincent A. (1988). 「κ-ブンガロトキシン:ニワトリ視葉および骨格筋への神経ニコチン受容体拮抗薬の結合」. Brain Research . 439 ( 1– 2): 249– 258. doi : 10.1016/0006-8993(88)91481-3 . PMID 3359187 .
- ^ Sen, I., Grantham, PA, & Cooper, JR (1976). シナプトソーム標本に対するβ-ブンガロトキシンの作用機序.米国科学アカデミー紀要,73(8), 2664-2668
- ^ Rowan, EG (2001). β-ブンガロトキシンは神経筋接合部でどのような作用を示すのか? Toxicon, 39(1), 107-118
- ^ Fiordalisi, JJ, Fetter, CH, TenHarmsel, A., Gigowski, R., Chiappinelli, VA, & Grant, GA (1991). κ-ブンガロトキシン遺伝子の大腸菌における合成と発現.生化学, 30 (42), 10337-10343
- ^ Fiordalisi, JJ, James, PL, Zhang, Y., & Grant, GA (1996). 酵母における天然型κ-ブンガロトキシンの容易な生産:神経細胞ニコチン性アセチルコリン受容体プローブ生産のための強化システム. Toxicon , 34 (2), 213-224
- ^ Changeux, JP, Devillers-Thiéry, A., Chemouilli, P. (1984). アセチルコリン受容体:アロステリックタンパク質. Science , 225 (4668), 1335-1345
- ^ Oh, AMF, Tan, KY, Tan, NH, & Tan, CH (2021). Bungarus multicinctus (Many-banded Krait) 毒のプロテオミクスと中和:中国と台湾の標本間の種内比較. Comparison Biochemistry and Physiology Part C: Toxicology & Pharmacology , 247 , 109063
- ^ a b c Tassonyi, E., Charpantier, E., Muller, D., Dumont, L., & Bertrand, D. (2002). 麻酔メカニズムにおけるニコチン性アセチルコリン受容体の役割. Brain Research Bulletin , 57 (2), 133-150
- ^ Wonnacott, S. (1997). シナプス前ニコチン性ACh受容体. Trends in Neurosciences , 20 (2), 92-98
- ^ alukdar, A., Maddhesiya, P., Namsa, ND, & Doley, R. (2023). 中枢神経系を標的とするヘビ毒毒素. Toxin Reviews, 42(1), 382-406
- ^ a b Tornøe, C.; Bai, D.; Holden-Dye, L.; Abramson, SN; Sattelle, DB (1995). 「神経毒(ブンガロトキシン、ネオスルガトキシン、ロフォトキシン)の昆虫および線虫ニコチン性アセチルコリン受容体に対する作用」. Toxicon . 33 (4): 411– 424. Bibcode : 1995Txcn...33..411T . doi : 10.1016/0041-0101(94)00163-3 . PMID 7570627 .
- ^ Pinnock et al: Sattelle, DB, Pinnock, RD and Lummis, SCR (1989) N-メチルリカコニチンによる神経ニコチン性アセチルコリン受容体の電圧非依存性遮断.J. exp. Biol. 142, 215-225
- ^ Chiappinelli, VA, & Lee, JC (1985). κ-ブンガロトキシン. 神経細胞ニコチン受容体プローブの自己会合. Journal of Biological Chemistry, 260(10), 6182-6186
- ^ a bマオ、ヤンチャオ;リュウ、ポーユ。蔣、廖春。リャオ、シューチェン。スー、フンユアン。シェ、スーイン。ヤン・チェンチャン (2017) 「台湾におけるBungarus multicinctus multicinctus ヘビ咬傷」。アメリカ熱帯医学衛生協会。96 (6): 1497–1504。土井: 10.4269/ajtmh.17-0005。PMC 5462592。PMID 28719273。