アデノシン二リン酸(ADP)受容体阻害剤は抗血小板薬の一種で、急性冠症候群(ACS)の治療や、血栓塞栓症、心筋梗塞、脳卒中のリスクがある患者の予防治療に。これらの薬剤はP2Y 12血小板受容体に拮抗し、ADPがP2Y 12受容体に結合するのを阻害します。その結果、血小板凝集が減少し、血栓形成が抑制されます。P2Y 12受容体は血小板表面に結合したタンパク質で、 Gタンパク質共役プリン受容体(GPCR)に属し、ADPの化学受容体です。 [1]
このクラスで最初に導入された薬剤はチクロピジンでしたが、副作用のため現在はあまり使用されていません。チクロピジン、クロピドグレル、プラスグレル(エフィエント)はいずれもチエノピリジン系であり、P2Y 12受容体を不可逆的に阻害します。これらはすべてプロドラッグであり、 P2Y 12 受容体を阻害するには、生体内で活性代謝物に変換される必要があります。一方、チカグレロル(ブリリンタ®)やカングレロール(ケングレキサール®)といった新規薬剤は非チエノピリジン系であり、P2Y 12 を可逆的に阻害します。つまり、代謝活性化を必要とせず受容体に直接作用し、作用の発現と消失が速いということです。[1] [2] [3] [4]
これらの薬剤は、特にACS患者や経皮的冠動脈形成術(PCI)を受ける患者において、血小板阻害を高めるためにアスピリン(アセチルサリチル酸)と併用されることが多い。[5]
歴史
ADP阻害薬が登場する以前は、抗血栓性イベントを治療する抗血小板薬はアスピリンのみでした。しかし、高リスク患者における虚血性イベントの再発が報告されたため、他の重要なシグナル伝達経路を標的とした抗血小板薬の開発基盤が築かれました。[5] [6]
ADP阻害剤の歴史は1972年に始まりました。当時研究者たちは、その2年前に発表された抗炎症作用と鎮痛作用を持つチエノピリジン系の抗炎症剤チノリジンに似た薬を探していました。 [7]チエノピリジンの化学に関する知識に基づき、数多くのチエノピリジン誘導体が合成されました。これらの誘導体はマウスとラットを用いて生体内および生体外試験が行われました。その結果、抗炎症作用や鎮痛作用は全く示されず、代わりに予想外の抗血小板作用と抗血栓作用が示されました。当時は、血小板凝集、血栓症、心血管イベントの関係が議論の的となっていたため、新しい抗血小板剤をスクリーニングすることは非常に稀でした。しかし、最も活性の高い誘導体であるチクロピジンがさらなる開発のために選ばれました。[7]チクロピジンは、血小板阻害作用を強化した第一世代のチエノピリジンであり、冠動脈症候群やその他の心血管疾患の治療に使用されました。チクロピジンには重篤な副作用が報告されたため、第二世代、第三世代のチエノピリジンであるクロピドグレルとプラスグレルが開発されました。[5]
チクロピジンとクロピドグレルが初めて市場に投入された当時(チクロジピンは1978年、クロピドグレルは1998年)、これら2つの主要な抗血栓薬の作用機序は完全には解明されていませんでした。ADP誘導性血小板凝集に対する強力な阻害剤であることは示されていましたが、P2Y 12受容体は特定されていませんでした。さらに、チクロピジンとクロピドグレルはプロドラッグであることは明らかでした。つまり、in vitroでは不活性であり、in vivoで活性化するには代謝を必要とするということです。これらの薬剤の活性代謝物が単離され、その特性が明らかになったのは2000年になってからでした。約1年後、ADPに対するP2Y 12血小板受容体が特定されました。これらの発見に続き、活性代謝物とその生成に関与する酵素が徐々に特定されました。こうして、チクロピジンの発見から30年以上、そしてクロピドグレルの発見から10年以上経って、これら2つの薬剤の作用機序が解明されたのである。[7]
発達
チエノピリジン
チクロピジン
最初のP2Y 12阻害剤はチエノピリジン系でした。これらは間接的な拮抗薬であり、ADP誘導性の血小板凝集と活性化を阻害します。このクラスの最初の薬剤はチクロピジンで、1972年にポルコール社(現サノフィ社)で発見されました。チノリジンをベースとした新しい抗炎症薬のスクリーニング中に発見されました。表現型スクリーニング手法を用いてスクリーニングされ、in vivoおよびex vivoの げっ歯類モデルで試験されました。高い抗血小板活性を示しました。[1]
チクロピジンは有望視され、臨床試験の対象に選ばれました。[1] 1978年にフランスで販売され、1991年には脳卒中の一次予防および二次予防を目的とした米国市場への参入により世界に広まりました。 [ 7] [1]
チクロピジンが前臨床試験に入るとすぐに、動物実験においてより優れた活性/毒性比を有するチエノピリジン類似体の探索が開始されました。チクロピジンによる重篤な血液疾患の患者が報告された後、新たな類似体の開発が急務となりました。 [7]
クロピドグレル
第二世代チエノピリジンであるクロピドグレルは、1987年に前臨床試験が開始され、1998年に世界市場に上市されました。その作用機序とその前駆物質であるチクロピジンについては、当時まだ解明されていませんでした。唯一分かっていたのは、試験管内で活性を示さないプロドラッグであること、作用持続時間が長いため血小板に不可逆的な影響を与えること、そして活性代謝物が化学的にも生物学的にも不安定であることでした。活性代謝物が発見されたのは2000年になってからであり、その血小板標的であるADPのP2Y 12受容体は、その1年後に発見されました。[7]
クロピドグレルはチクロピジンよりも優れた活性毒性比を有していたものの、患者の30%がクロピドグレル耐性を示すなど、その活性には依然として問題がありました。クロピドグレル耐性の主な要因はCYP2C19遺伝子の多型であり、これは患者の30~55%に認められます。この多型により酵素機能が喪失し、クロピドグレルから活性代謝物への変換が阻害されました。[1]代謝物自体は非常に不安定であるため、化学ライブラリの一部として保存することはできません。[7]この結果、CYPを介した代謝への依存度が低い化合物、プラスグレルが開発されました。[1]
プラスグレル
第三世代チエノピリジンであるプラスグレルは、2009年に第一三共とイーライリリーという製薬会社によって市場に投入されました。[1]プラスグレルは、その前駆体と同様にプロドラッグですが、代謝は腸管で始まり、エステラーゼによってチオラクトンへと代謝されます。この不活性中間体は、主にCYP3A4とCYP2B6によってCYPを介した開環反応を受け、活性代謝物となります。そのため、プラスグレルはクロピドグレル耐性の影響を受けません。[8] [1]
新世代ADP受容体阻害剤
チカグレロル
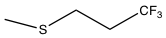
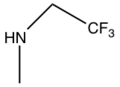
焦点は、代謝物ではなく、作用発現が速いP2Y 12阻害剤の発見に移った。ATPはADP誘導性血小板凝集を競合的に阻害することが知られていたが、ATPは非常に不安定であった。そこで、より効力と安定性の高いATP類似体の創出に着目した。これらの類似体は、三リン酸基が保持されるため半減期が非常に短く、静脈内投与が必要であった。これらの類似体の改良により、選択的かつ安定な非リン酸P2Y 12受容体拮抗薬であるチカグレロルが発見された。[9]チカグレロルは、シクロペンチルトリアゾロピリミジン(CPTP)のクラスに属する。[10]チカグレロルは、欧州では2010年に、 [11]米国では2011年に発売された。[12]
カングレロール
カングレロールはチカグレロールと同様にATP類似体であり、酵素分解に対して安定です。チエノピリジンのような活性代謝物に分解されないため、作用発現が速いです。[13] アストラゼネカは2003年12月にカングレロールの独占的ライセンスを取得しました。2009年、カングレロールとプラセボを比較していた第3相試験のスポンサーが撤退しました。中間解析評価委員会(IARC)が、この試験では規制当局の承認に必要な「説得力のある」臨床効果が示されないと判断したことを受け、スポンサーが撤退したため、カングレロールの開発は一時的に中断されました。[14]しかし、チャンピオン・フェニックス試験(バイオ医薬品企業ザ・メディシンズ・カンパニーがスポンサー)では、緊急または待機的PCIを受ける11,145人の患者をPCI前にカングレロールまたはクロピドグレルに無作為に割り付けた二重盲検プラセボ対照試験において、カングレロールがPCI中の虚血性イベント発生率を有意に低下させたことが示されました。カングレロールはクロピドグレルよりもステント血栓症の発症率を低下させました。これらの結果は2013年に発表されました。[15]カングレロールは、2015年6月に静脈内投与用の抗血小板薬としてFDAの承認を取得しました。 [16]
作用機序
ADP受容体阻害剤の活性代謝物の分子標的はP2Y 12受容体である。[17] P2Y 12受容体はG共役受容体であり、アデノシン二リン酸によって活性化される。ADPはP2Y 12受容体に結合し、アデニルシクラーゼの阻害を引き起こし、細胞内のcAMP濃度を低下させる。このcAMPの減少は血管拡張刺激リン酸化タンパク質のリン酸化を減少させ、糖タンパク質IIb/IIIa受容体の活性化を引き起こす。[18]糖タンパク質IIb/IIIa受容体の活性化はトロンボキサン産生 を増加させ、血小板凝集を延長させる。[19]チクロピジン、クロピドグレル、プラスグレルはチエノピリジン系プロドラッグであり、P2Y 12受容体の不可逆的な血小板阻害剤である。カングレロールとチカグレロールは直接作用型のP2Y 12阻害剤であり、P2Y 12受容体の構造を変化させることで、受容体に対する可逆的な血小板阻害を引き起こします。チエノピリジンは肝臓および腸管で代謝され、活性代謝物となります。[20]

代謝
チクロピジンはプロドラッグであり、少なくとも5つの主要代謝経路によって代謝されます。抗血小板作用を有することが同定され、示されている活性代謝物が1つあります。この活性代謝物はCYP依存性経路によって生成されます。CYP2C19およびCYP2B6は、肝臓においてチクロピジンからチオラクトン中間体である2-オキソチクロピジンへの代謝変換に寄与すると示唆されている酵素です。チオラクトン中間体はその後、CYP酸化によってチクロピジン活性代謝物に変換され、そこで酸化活性化が起こります。しかし、この経路に関与するCYP酵素は不明です。 [20]活性代謝物の生成において、ジヒドロチエノピリジニウム(M5)およびチエノジヒドロピリジニウム代謝物(M6)という追加の代謝物が同定されています。これらの代謝物がチクロピジンの毒性副作用の原因となっている可能性があります。[18]

クロピドグレルは2つの経路で代謝されるプロドラッグである。1つの経路では、クロピドグレルの投与量の大部分(85%)がエステラーゼによって不活性カルボン酸誘導体に加水分解され、グルコリドン化を経て腎排泄に速やかに吸収される。もう1つの経路では、肝臓でのCYP450代謝活性化を2段階必要とし、P2Y 12受容体を阻害する活性代謝物を生成する。CYP1A2、CYP3A4、CYP3A5、およびCYP2C19が、クロピドグレルの代謝に関与する主要な酵素と考えられている。[19]まず、クロピドグレルは2-オキソ-クロピドグレルに代謝され、これがチオールである活性代謝物に加水分解される。チオールはP2Y 12受容体のシステインにジスルフィド結合を形成し、P2Y 12受容体に不可逆的に結合する。クロピドグレルはP2Y 12受容体のCYS17またはCYS270に共有結合し、アゴニストの結合を阻害すると考えられている。[18]クロピドグレルを使用する人の中には、CYP2C19活性に欠陥があり、そのためCYP2C19代謝が不良で、クロピドグレルの活性が低下するリスクがある。これは、プロドラッグが活性薬物に代謝されないためである。CYP2C19阻害剤はクロピドグレルと相互作用し、クロピドグレルの活性を低下させる可能性がある。ラベプラゾールとパントプラゾールを除くすべてのプロトンポンプ阻害剤は、肝臓のCYP450酵素によって代謝されるため、クロピドグレルの代謝と相互作用する可能性がある。オメプラゾールはCYP2C19阻害剤であるため、他のタンパク質ポンプ阻害剤よりも薬物間相互作用の可能性が高いと考えられています。[17]
プラスグレルは第三世代チエノピリジンであり、プロドラッグである。チクロピジンやクロピドグレルとは異なり、プラスグレルの活性化は中間体チオラクトンへの加水分解を伴い、その後、CYP依存的な単一ステップで活性代謝物に変換される。活性代謝物であるR-138727(チオール中間体)は、P2Y 12受容体に不可逆的に結合するか、代謝メチル化されて不活性代謝物となる。R-138727はS-メチル化によって代謝的に不活性化される。プラスグレルはクロピドグレルのようにCYP2C19によって代謝されず、遺伝的CYP変異はプラスグレルの活性代謝物に大きな影響を与えない。プラスグレルはクロピドグレルよりも作用発現が速く、活性代謝物による受容体遮断効果も強い。[18]
チカグレロールは、経口投与後に活性を示す、P2Y 12受容体に対する最初の可逆的阻害剤でした。チカグレロールは、代謝活性化を必要とせずに経口投与で活性を示します。チカグレロールは速やかに吸収され、酵素分解を受けて少なくとも1つの活性代謝物を生成しますが、その活性代謝物は親化合物とほぼ同等の効力を有します。チカグレロールは、ACS治療薬として現在入手可能なものと比較して、薬物動態および薬力学的プロファイルが優れています。さらに、クロピドグレルの効果に影響を与えることが知られているCYP2C19遺伝子型は、チカグレロールの効果に影響を与えませんでした。[19]
カングレロールは、静脈内投与が可能で、効果発現と消失が非常に速い、初めての可逆性P2Y 12阻害剤です。これは既存の薬剤に勝る利点であり、経口P2Y 12阻害剤の限界を克服できる可能性があります。そのため、カングレロールは抗血小板療法の魅力的な選択肢となり、特に経口薬を服用できない患者(意識不明、嘔吐、鎮静状態など)にとって魅力的です。チカグレロールと同様に、活性発現に代謝変換を必要としないため、P2Y 12受容体を直接阻害することができます。[21]
医薬品設計
構造活性相関(SAR)
プラスグレルは代謝を考慮して開発されました。これは、エステル基を代謝的に安定なケトン(R1基)に置換することによって行われました。また、チオフェン2位へのエステル基の付加(R2基)により、活性化の第一段階がCYP2C19からエステラーゼへと移行したため、プラスグレルはクロピドグレルのようにCYP2C19によって代謝されません。[22]

| 化合物 | R1 | R2 | R3 |
| クロピドグレル |  |
C | 塩素 |
| プラスグレル |  |
 |
F |
カングレロールとチカグレロールは、チエノピリジンの安全性 (出血) の問題と非反応者をターゲットに開発された新しいクラスの可逆的 P2Y 12受容体です。アデノシン三リン酸( ATP ) などの天然リガンドは、血小板凝集を阻害することが示されており、弱い拮抗薬として特定されています。カングレロールとチカグレロールは、アデノシン三リン酸 (ATP) に類似した化学構造を持つヌクレオチド類似体です。[21] ATP は心血管組織で凝集促進性の ADP、AMP またはアデノシンに代謝されます。リン β (Pβ) とリン γ (Pγ) の間の無水酸素をジクロロメチレンまたはジフルオロメチレンに置換すると、ATP と等効力で同様のpKaを持つ化合物になります。この置換により、 ATP の凝集促進性への代謝を回避できます。鎖長にS-プロピル基を付加することで、活性に大きな影響が見られました。アデノシンのC4位にモノ置換アルキルアミンを付加すると、活性は10倍に増加し、アルキルアミン置換基の長さと効果の相殺効果は相関していました。C4位にメチルスルファニルエチルアミノ基を、鎖長にトリフルオロプロピルスルファニル基を付加することで、活性が増強された薬剤カングレロールが合成されました。カングレロールは、ラットにおけるADP誘発血小板凝集において、20分後に平均78%の回収率を示しましたが、化合物1Cでは回収率が10%未満でした。[22]

| 化合物 | pIC50 | R1 | R2 | R3 |
|---|---|---|---|---|
| ATP | 3.6 | お | C | C-NH2 |
| 1A | 3.5 |  |
C | C-NH2 |
| 1B | 8.6 |  |
 |
C-NH2 |
| 1C | 9.1 |  |
 |
 |
| カングレロール | 9.4 |  |
 |
 |
可逆的な経口薬チカグレロルのニーズを満たすため、カングレロールのリン酸鎖をアスパラギン酸に置き換えたところ、効力が 300 倍低下しました。プリンをトリアゾロピリミジンに置き換えることで、チカグレロルの効力はカングレロールと同レベルに戻りました。糖リボース単位も、グリコシド結合の不安定性を回避するため、シクロペンチル基に置き換えました。構造の左側の基は、側鎖 R1 に置き換えました。中性側鎖 R1 = CONH 2および R1 = CH 2 OH は、わずかな親和性の低下で受け入れられ、代謝が胆汁代謝から肝臓代謝に移行しました。このため、in vitro肝ミクロソームアッセイを使用でき、薬物動態特性の最適化が簡素化されました。5 位にフェニルシクロプロピルアミン置換基を追加すると、高い親和性が得られました。この結果から、最初の化合物はラットにおいて測定可能な経口バイオアベイラビリティを有することがわかった(R1 =CH 2 OH)。R2の変化は親和性にわずかな影響を与え、例えばR1 = OCH 2 CH 2 OHのように、薬物動態特性を改善する基を導入することが可能になった。フェニル環とチオエーテルアルキル鎖末端にフッ素を導入することで、代謝安定性がさらに向上する。チオエーテルアルキル鎖のフッ素をS-プロピル基に戻すことで、チカグレロルが製剤化される。[22]

臨床使用
血小板の活性化とそれに続く凝集は、正常な止血を維持する上で重要な役割を果たします。このシステムの障害は、脳血管疾患、心血管疾患、末梢血管疾患につながり、脳卒中、不安定狭心症、心筋梗塞などを引き起こす可能性があります。血管が損傷すると、損傷した細胞と活性化血小板からADPが放出され、さらなる血小板凝集が誘発されます。[23] [24]
チクロピジン
第一世代のチエノピリジン系P2Y 12受容体遮断薬であるチクロピジンは、血栓性血小板減少性紫斑病、再生不良性貧血、好中球減少症などの副作用の発生率が高いことから、臨床使用から撤退した。[25]この薬剤の臨床使用は、クロピドグレルの方が胃腸副作用が少なく、血液学的安全性が優れていたため、すぐにクロピドグレルに取って代わられた。 [26]
クロピドグレル
第二世代チエノピリジン系P2Y 12受容体拮抗薬であるクロピドグレルは、虚血性脳血管障害、心筋梗塞、末梢動脈疾患の治療に有効な抗血小板薬である。[27]他のチエノピリジン系薬剤と同様に、臨床使用においてはアスピリンとの併用がよく用いられた。[23]クロピドグレルの臨床的に承認された投与量は、経口投与で300mgの初回投与量 と経口投与で1日75mgの維持量である。[28]
長年にわたり、シクロオキシゲナーゼ-1(COX-1)阻害剤であるアスピリンとクロピドグレルの併用療法は日常的な治療法であり、血栓症の予防における主要な抗血小板剤として機能してきました。これは、血栓症において中心的な役割を果たす血小板生物学的機能を強力に制御する能力を有するためです。しかし、これらの薬剤の使用には、出血リスクの増加など、依然として多くの重要な制約があり、クロピドグレルの投与期間と投与量が極めて重要になります。さらに、クロピドグレルに対する反応性は一様ではなく、反応性が低いと重大な心血管イベントにつながる可能性があります。[29] [30]
新しい世代
新世代のP2Y 12阻害剤はこれらの問題に対処し、患者の転帰改善を期待しています。最近開発されたこれらのP2Y 12阻害剤(チカグレロル、カングレロル、プラスグレル、エリノグレル)は、P2Y 12受容体をより効率的に阻害することで、より一貫性があり強力な血小板阻害効果をもたらします。しかし、この強力な血小板阻害効果は、出血リスクの上昇を伴います。[31] [29]
第三世代チエノピリジンであるプラスグレルは、クロピドグレルやチクロピジンよりも体内で効率的に代謝されるため、血小板活性化をより効果的に抑制します。研究では、プラスグレルはクロピドグレルよりもステント血栓症および心筋梗塞のリスクをはるかに低減することが示されています。[26]プラスグレルの臨床的に承認された用量は、経口投与で60mgの初回負荷量と経口投与で1日10mgの維持量です。[28]
チカグレロルはクロピドグレルよりもはるかに強力な血小板凝集阻害薬ですが、呼吸困難発作の増加と関連しています。これらの発作の重症度は軽度から中等度まで様々です。承認されているチカグレロルの臨床用量は、180mgの経口投与の負荷量と90mgの1日1回投与の維持量です。[32]
臨床使用されているP2Y12受容体を標的とする唯一の親薬はカングレロールである。[33]
相互作用
CYP2C19酵素は、クロピドグレルだけでなくプロトンポンプ阻害剤(PPI)も代謝します。クロピドグレルとオメプラゾールの間には、薬物相互作用があることが様々な報告で示されています。いくつかの研究では、プロトンポンプ阻害剤(PPI)であるオメプラゾールを投与された患者において、クロピドグレルの血小板に対する作用が著しく阻害されることが示されています。 [34] [35]別の研究では、ランソプラゾールがクロピドグレルの作用を阻害することが示されています。[36]しかし、他の研究では、PPIであるパントプラゾールまたはエソメプラゾールの摂取がクロピドグレルへの反応低下と関連していないことが示されています。[35] [37]
2009年、米国食品医薬品局(FDA)と欧州医薬品庁(EMA)は、初期コホート研究における当時の観察に基づき、クロピドグレルとPPI、特にオメプラゾールの併用を推奨しませんでした。しかし、その後の後ろ向きコホート研究では、クロピドグレル とPPIの相互作用による有害な心血管イベントは示されていません。したがって、薬物相互作用が死亡率に及ぼす影響に関する明確なエビデンスは存在しません。[38]
消化管出血のリスクが高い患者の場合、そのリスクは心血管系への有害作用の可能性を上回ります。したがって、これらの患者には、クロピドグレルとパントプラゾールなどのCYP2C19阻害能の低いPPIとの併用が推奨されます。[38]
クロピドグレル耐性
クロピドグレル耐性は長年にわたり出現しており、ACS患者またはPCIを受ける患者の治療において大きな懸念事項となっています。クロピドグレル耐性は、人口や民族によって4~44%の範囲で変動すると報告されています。クロピドグレル耐性に曝露された患者は、クロピドグレルの活性代謝物レベルの低下により、血小板阻害活性が低下します。その結果、虚血性合併症や血栓塞栓性合併症など、一連の臨床的事象が発生します。これらの患者は、反応不良患者または非反応患者として認識されています。[39] [40]
クロピドグレルは、活性代謝物となるまでに酵素の助けを借りた2段階の代謝を必要とするプロドラッグです。クロピドグレルの代謝において重要な酵素の一つであるCYP2C19は、生体内変換の両段階に関与しています。CYP2C19の多型はクロピドグレルに対する反応に影響を与え、酵素活性を低下させ、結果としてクロピドグレルの活性代謝物を減少させます。[40]
クロピドグレル耐性の主な問題は、他の薬剤、特にプロトンポンプ阻害薬オメプラゾールとの相互作用である。オメプラゾールとクロピドグレルは同じCYP代謝経路で代謝される。そのため、オメプラゾールとの併用によるクロピドグレルの低反応性は、CYP2C19酵素における両薬剤間の競合に起因すると示唆されている。[40]
クロピドグレル耐性を克服するための臨床的アプローチとしては、クロピドグレルの高用量投与、ホスホジエステラーゼ阻害剤 シロスタゾールとの併用、あるいはプラスグレルやチカグレロルといった新しい抗血小板薬への切り替えなどが挙げられます。しかしながら、これらの方法には出血リスクの増加という大きな懸念があります。そのため、作用発現が速く、個人差が少なく、安全性プロファイルが改善された新しい抗血小板薬の必要性が極めて重要です。[39]
将来の展望
ADP阻害薬の開発は絶えず進歩しており、より優れたP2Y 12拮抗薬の探索は現在も進行中です。 [1] ACS患者またはPCI施行患者におけるアテローム血栓性イベントの二次予防の要は、アスピリンとクロピドグレルの併用抗血小板療法です。しかしながら、アテローム血栓症イベントは依然として発生しています。[41]現在の抗血小板薬の限界として、出血リスクと血小板阻害反応の個人差が挙げられます。[6]
目的は、出血などの安全性への懸念を軽減しながら、治療効果を最大化するための最適な治療域を特定することです。したがって、ADP阻害剤の主要な未達成目標は、作用発現が速く、高い抗血小板活性を有しながらも出血リスクを低減した、強力な可逆性抗血小板剤の開発です。この困難な目標は、1日1回経口投与のプロファイルと最適化された標的選択性と相まって、この分野における重要なブレークスルーとなる可能性があります。[1] [39]
ビカグレルは、2017年9月現在、この分野における最新の開発品です。クロピドグレルの新規酢酸類似体であり、抗血小板作用の向上と出血リスクの低減が期待されています。[42]ビカグレルの予備的な薬物動態試験では、クロピドグレルよりも高いバイオアベイラビリティが示されており、ビカグレルの治療有効用量ははるかに低いことが示唆されています。ビカグレルがクロピドグレルに対して優れている点は、CYP2C19代謝不良者に対する薬剤耐性の低さ、有効用量の低さと作用発現の速さによる用量依存性毒性の低さなどと考えられています。[39]
参考文献
- ^ abcdefghijk アナ・マルティネス、カルメン・ギル編 (2017年7月19日).包括的医薬品化学 第1巻 一般的視点 ― 創薬の未来(第3版). アムステルダム(オランダ). ISBN 9780128032008. OCLC 989872324.
{{cite book}}: CS1 maint: location missing publisher (link)[ページが必要] - ^ 「欧州医薬品庁. 2017. エフィエント」. EMA . 2017年9月22日閲覧。
- ^ 「欧州医薬品庁. 2017. Brilique」. EMA . 2017年9月22日閲覧。[永久リンク切れ]
- ^ 「欧州医薬品庁. 2017. Kengrexal」. EMA . 2017年9月22日閲覧。[永久リンク切れ]
- ^ abc K., Chopra, H. (2012-12-30).心臓病学教科書:臨床的・歴史的視点. Nanda, Navin C. (Navin Chandar), 1937-. ニューデリー. ISBN 9789350900819. OCLC 870265462。
{{cite book}}: CS1 maint: location missing publisher (link) CS1 maint: multiple names: authors list (link)[ページが必要] - ^ ab Angiolillo, Dominick J.; Luis Ferreiro, José (2010年1月). 「血小板アデノシン二リン酸P2Y12受容体拮抗作用:現在の治療戦略の利点と限界、そして将来の方向性」. Revista Española de Cardiología . 63 (1): 60– 76. doi :10.1016/s1885-5857(10)70010-4. PMID 20089227. S2CID 24637687.
- ^ abcdefg マフラン、ジャン=ピエール(2012年8月)「クロピドグレルとその前身であるチクロピジンの物語:これらの主要な抗血小板薬および抗血栓薬は今日発見・開発される可能性があったか?」 Comptes Rendus Chimie 15 ( 8): 737– 743. doi :10.1016/j.crci.2012.05.006.
- ^ Small, DS; Wrishko, RE; Ernest II, CS; Ni, L.; Winters, KJ; Farid, NA; Li, YG; Brandt, JT; Salazar, DE; Borel, AG; Kles, KA; Payne, CD (2009年10月). 「中等度腎機能障害および末期腎疾患患者におけるプラスグレルの薬物動態および薬力学」. Journal of Clinical Pharmacy and Therapeutics . 34 (5): 585– 594. doi : 10.1111/j.1365-2710.2009.01068.x . PMID 19744014. S2CID 46499725.
- ^ Sinha, Nakul (2012年9月). 「チカグレロル:分子レベルの発見から臨床的エビデンスへ」. Indian Heart Journal . 64 (5): 497– 502. doi :10.1016/j.ihj.2012.09.002. PMC 3861097. PMID 23102389 .
- ^ Storey, Robert (2017年12月6日). 「可逆的に結合するP2Y12阻害剤の薬理学と臨床試験」. Thrombosis and Haemostasis . 105 (S 06): S75 – S81 . doi :10.1160/THS10-12-0769. PMID 21479343. S2CID 3261918.
- ^ 「Briliqueの評価報告書」(PDF) 。 2018年5月17日時点のオリジナル(PDF)からアーカイブ。 2017年9月29日閲覧。
- ^ 「FDA、急性冠症候群の治療薬として血液凝固阻止薬ブリリンタを承認」。食品医薬品局。2011年7月23日時点のオリジナルよりアーカイブ。
- ^ アンジオリロ, ドミニク・J.; カプランツァーノ, ピエラ (2008年8月). 「新興新規血小板阻害剤の薬理学」. American Heart Journal . 156 (2): 10S – 15S . doi :10.1016/j.ahj.2008.06.004. PMID 18657681.
- ^ Wood, Shelley (2009年5月13日). 「カングレロールを用いたCHAMPION試験、有効性不足のため中止」. Medscape . 2017年9月29日閲覧。
- ^ Bhatt, Deepak L.; Stone, Gregg W.; Mahaffey, Kenneth W.; Gibson, C. Michael; Steg, P. Gabriel; Hamm, Christian W.; Price, Matthew J.; Leonardi, Sergio; Gallup, Dianne; Bramucci, Ezio; Radke, Peter W.; Widimský, Petr; Tousek, Frantisek; Tauth, Jeffrey; Spriggs, Douglas; McLaurin, Brent T.; Angiolillo, Dominick J.; Généreux, Philippe; Liu, Tiepu; Prats, Jayne; Todd, Meredith; Skerjanec, Simona; White, Harvey D.; Harrington, Robert A. (2013年4月4日). 「PCI中のカングレロールによる血小板抑制が虚血性イベントに及ぼす影響」. New England Journal of Medicine . 368 (14): 1303– 1313. doi : 10.1056/NEJMoa1300815 . PMID 23473369.
- ^ Norgard, Nicholas B.; Hann, Callie L.; Dale, George L. (2008年9月15日). 「カングレロールは被覆血小板形成を減弱させる」. Clinical and Applied Thrombosis/Hemostasis . 15 (2): 177– 182. doi : 10.1177/1076029608321437 . PMID 18796456.
- ^ ab Wallentin, L. (2009年7月24日). 「P2Y12阻害剤:特性と作用機序の相違点、そして臨床使用における潜在的な影響」. European Heart Journal . 30 (16): 1964– 1977. doi : 10.1093/eurheartj/ehp296 . PMID 19633016.
- ^ abcd Lemke, Thomas L.; Williams, David A. 編 (2013). Foye's Principles of medicinal chemistry (第7版). フィラデルフィア: Wolters Kluwer Health/Lippincott Williams & Wilkins. ISBN 9781451175721. OCLC 748675182。[ページが必要]
- ^ abc Damman, Peter; Woudstra, Pier; Kuijt, Wichert J.; de Winter, Robbert J.; James, Stefan K. (2011年12月20日). 「臨床実践におけるP2Y12血小板阻害」. Journal of Thrombosis and Thrombolysis . 33 (2): 143– 153. doi :10.1007/s11239-011-0667-5. PMC 3269569. PMID 22183178 .
- ^ ab Farid, Nagy A.; Kurihara, Atsushi; Wrighton, Steven A. (2010年2月). 「チエノピリジン系抗血小板薬チクロピジン、クロピドグレル、プラスグレルのヒトにおける代謝と体内動態」. The Journal of Clinical Pharmacology . 50 (2): 126– 142. doi :10.1177/0091270009343005. PMID 19948947. S2CID 31554679.
- ^ ab Sible, Alexandra M.; Nawarskas, James J. (2017). 「カングレロール」. Cardiology in Review . 25 (3): 133– 139. doi :10.1097/CRD.0000000000000142. PMID 28379902. S2CID 24080809.
- ^ abc Zetterberg, Fredrik; Svensson, Peder (2016年6月). 「現状:可逆性P2Y 12 受容体拮抗薬の設計と構造活性相関」. Bioorganic & Medicinal Chemistry Letters . 26 (12): 2739– 2754. doi :10.1016/j.bmcl.2016.04.030. PMID 27133596.
- ^ ab Hollopeter, Gunther; Jantzen, Hans-Michael; Vincent, Diana; Li, Georgia; England, Laura; Ramakrishnan, Vanitha; Yang, Ruey-Bing; Nurden, Paquita; Nurden, Alan; Julius, David; Conley, Pamela B. (2001年1月). 「抗血栓薬の標的となる血小板ADP受容体の同定」. Nature . 409 (6817): 202– 207. doi :10.1038/35051599. PMID 11196645. S2CID 4423579. ProQuest 204499734.
- ^ 杉立 篤弘、浅井 文俊、小川 武俊、井上 輝彦、小池 宏之(2000年4月). 「血小板ADP受容体拮抗作用を有する新規抗血小板剤CS-747の薬理学的プロファイル」. British Journal of Pharmacology . 129 (7): 1439– 1446. doi :10.1038/sj.bjp.0703237. PMC 1571986. PMID 10742300 .
- ^ Wijeyeratne, Yanushi Dullewe; Heptinstall, Stan (2011年10月). 「抗血小板療法:ADP受容体拮抗薬」. British Journal of Clinical Pharmacology . 72 (4): 647– 657. doi :10.1111/j.1365-2125.2011.03999.x. PMC 3187865. PMID 21518389 .
- ^ ab Bhatt, Deepak L. (2009年9月3日). 「プラスグレルの臨床実践」. New England Journal of Medicine . 361 (10): 940– 942. doi :10.1056/NEJMp0806848. PMID 19605807. ProQuest 223915809.
- ^ Geiger, J.; Brich, J.; Hönig-Liedl, P.; Eigenthaler, M.; Schanzenbächer, P.; Herbert, JM; Walter, U. (1999年8月). 「抗血小板薬クロピドグレルによるヒト血小板P2YAC ADP受容体を介したシグナル伝達の特異的障害」. Arteriosclerosis, Thrombosis, and Vascular Biology . 19 (8): 2007– 2011. doi : 10.1161/01.atv.19.8.2007 . PMID 10446085.
- ^ ab アンジオリロ, ドミニク・J.; ベイツ, エリック・R.; バス, セオドア・A. (2008年8月). 「新規チエノピリジン、プラスグレルの臨床プロファイル」. American Heart Journal . 156 (2): 16S – 22S . doi :10.1016/j.ahj.2008.06.005. PMID 18657682.
- ^ ab サラフォフ, ニコラウス; A. バーン, ロバート; シビング, ディルク (2012年9月23日). 「クロピドグレルの臨床使用」. Current Pharmaceutical Design . 18 (33): 5224– 5239. doi :10.2174/138161212803251853. PMID 22724411.
- ^ Tang, Jie; Li, Mu-Peng; Zhou, Hong-Hao; Chen, Xiao-Ping (2015年8月25日). 「血小板阻害薬:P2Y12受容体拮抗薬の現状と将来」Current Vascular Pharmacology . 13 (5): 566– 577. doi :10.2174/1570161112666141127162209. PMID 25440595.
- ^ Ahmad, Shiraz; F. Storey, Robert (2012年9月23日). 「プラスグレルとチカグレロルの開発と臨床使用」. Current Pharmaceutical Design . 18 (33): 5240– 5260. doi :10.2174/138161212803251989. PMID 22724412.
- ^ Storey, Robert F.; Becker, Richard C.; Harrington, Robert A.; Husted, Steen; James, Stefan K.; Cools, Frank; Steg, Philippe Gabriel; Khurmi, Nardev S.; Emanuelsson, Håkan; Cooper, Anna; Cairns, Richard; Cannon, Christopher P.; Wallentin, Lars (2011年12月). 「PLATO試験におけるチカグレロルまたはクロピドグレル投与患者における呼吸困難の特徴と臨床転帰との関連性」. European Heart Journal . 32 (23): 2945– 2953. doi : 10.1093/eurheartj/ehr231 . PMID 21804104.
- ^ Hensch, Nicole R.; Karim, Zubair A.; Pineda, Joshua; Mercado, Nicole; Alshbool, Fatima Z.; Khasawneh, Fadi T. (2017年11月). 「P2Y 12抗体は血小板の活動を阻害し、血栓形成を抑制する」. Biochemical and Biophysical Research Communications . 493 (2): 1069– 1074. doi :10.1016/j.bbrc.2017.09.083. PMID 28928091.
- ^ ギラール、マルティーヌ;アルノー、ベルトラン。コルニリー、ジャン=クリストフ。ル・ガル、グレゴワール。ラカット、カリン。ル・カルベス、ジュヌヴィエーヴ。マンスーラティ、ジャック。モティエ、ドミニク。アブグラル、ジャン=フランソワ。ジャック・ボシャット(2008年1月)。 「アスピリンに伴うクロピドグレルの抗血小板作用に対するオメプラゾールの影響」。米国心臓病学会のジャーナル。51 (3): 256–260。土井: 10.1016/j.jacc.2007.06.064。PMID 18206732。
- ^ ab Sibbing, Dirk; Morath, Tanja; Stegherr, Julia; Braun, Siegmund; Vogt, Wolfgang; Hadamitzky, Martin; Schömig, Albert; Kastrati, Adnan; Beckerath, Nicolas von (2017年11月23日). 「プロトンポンプ阻害剤によるクロピドグレルの抗血小板作用への影響」(PDF) . Thrombosis and Haemostasis . 101 (4): 714– 719. doi :10.1160/TH08-12-0808. PMID 19350116. S2CID 19243268. 2019年3月9日時点のオリジナル(PDF)からアーカイブ。
- ^ Small, David S.; Farid, Nagy A.; Payne, Christopher D.; Weerakkody, Govinda J.; Li, Ying G.; Brandt, John T.; Salazar, Daniel E.; Winters, Kenneth J. (2008年4月). 「プロトンポンプ阻害剤ランソプラゾールのプラスグレルおよびクロピドグレルの薬物動態および薬力学に対する影響」. The Journal of Clinical Pharmacology . 48 (4): 475– 484. doi :10.1177/0091270008315310. PMID 18303127. S2CID 6216572.
- ^ Siller-Matula、Jolanta M.;シュピール、アレクサンダー・O.ラング、アイリーン M.クライナー、ゲルハルト。キリスト、ギュンター。ベルント、ジルマ(2009 年 1 月)。 「クロピドグレルによる血小板阻害に対するパントプラゾールおよびエソメプラゾールの効果」。アメリカン・ハート・ジャーナル。157 (1): 148.e1–148.e5。土井:10.1016/j.ahj.2008.09.017。PMID 19081411。
- ^ ab Drepper, Michael D; Spahr, L; Frossard, JL (2012). 「クロピドグレルとプロトンポンプ阻害剤 - 2012年の現状は?」World Journal of Gastroenterology . 18 (18): 2161– 2171. doi : 10.3748/wjg.v18.i18.2161 . PMC 3351765 . PMID 22611308.
- ^ abcd シャン、ジアチー;チャン、ボーユ。朱、姚丘。ジャオ、ボー。鄭、威儀。チー、シャオウェイ。ゴン、ヤンチュン。ユアン、ファン; LV、フーシェン。ホンビン、サン(2012年4月2日)。 「クロピドグレル耐性の克服:非常に強力で経口的に生体利用可能な抗血小板薬としてのビカグレルの発見」。医薬化学ジャーナル。55 (7): 3342–3352。土井:10.1021/jm300038c。PMID 22428882。
- ^ abc Vlachojannis, GJ; Dimitropoulos, G; Alexopoulos, D (2011). 「クロピドグレル耐性:現状と今後の方向性」Hellenic Journal of Cardiology . 52 (3): 236– 45. PMID 21642072.
- ^ Capodanno, D.; Ferreiro, JL; Angiolillo, DJ (2013年6月). 「抗血小板療法:新たな薬理学的薬剤と変化するパラダイム」. Journal of Thrombosis and Haemostasis . 11 : 316– 329. doi : 10.1111/jth.12219 . PMID 23809135.
- ^ コリンズ、ロバート・ジョン;チャン、チーウィン(1989年9月15日)「香港華人における大腸癌:1972~1981年の1,117症例の病理学的調査」International Journal of Cancer . 44 (3): 410–414 . doi :10.1002/ijc.2910440305. PMC 5054534. PMID 2777406 .