
| ベスト1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 識別子 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| エイリアス | BEST1、ARB、BEST、BMD、RP50、TU15B、VMD2、ベストロフィン 1、Best1V1Delta2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 外部ID | オミム:607854; MGI : 1346332;ホモロジーン: 37895;ジーンカード:BEST1; OMA :BEST1 - オルソログ | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| ウィキデータ | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
ベストロフィン-1(Best1)は、ヒトではBEST1遺伝子(RPD ID - 5T5N/4RDQ)によってコードされるタンパク質である。 [5]
ベストロフィンタンパク質ファミリーは、膜貫通タンパク質をコードする4つの進化的関連遺伝子(BEST1、 BEST2、BEST3、BEST4)で構成されています。[6]このファミリーは、BEST1変異とベスト黄斑ジストロフィー(BVMD)との関連により、ヒトにおいて初めて同定されました。 [7] BEST1遺伝子の変異は、少なくとも5つの異なる網膜変性疾患の主な原因として特定されています。[7]
ベストロフィンは、細菌からヒトに至るまで、研究対象となったほぼすべての生物で同定されている、構造的に保存された古代のタンパク質ファミリーです。ヒトでは、カルシウム活性化陰イオンチャネルとして機能し、それぞれが体全体にわたって独自の組織分布を有しています。具体的には、染色体11q13上のBEST1遺伝子は、ヒトにおいて網膜で最も高い発現を示すベストロフィン1タンパク質をコードしています。[7]
構造
遺伝子
ベストロフィン遺伝子は保存された遺伝子構造を有し、RFP-TMドメインをコードする8つのエクソンはほぼ同一の大きさで、エクソンとイントロンの境界は高度に保存されている。4つのベストロフィン遺伝子はそれぞれ、長さが可変の3'末端を持つ。[5]
BEST1は2つの独立した研究によって、小眼球症関連転写因子によって制御されていることが示されている。[8] [9]
タンパク質
ベストロフィン-1は、主に眼の網膜色素上皮(RPE)に存在する膜貫通タンパク質です。 [10] RPE層内では、主に基底外側膜に局在します。タンパク質の結晶構造は、このタンパク質の主要なイオンチャネル機能とカルシウム調節能を示しています。[10] [7]ベストロフィン-1は585個のアミノ酸から構成され、 N末端とC末端の両方が細胞内に局在します。

Best1の構造は、5つの同一のサブユニットから構成され、各サブユニットは膜を4回貫通し、不変のarg-phe-pro(RFP)モチーフなどの芳香族残基を多く含む2番目の膜貫通ドメインを介して、連続した漏斗状の細孔を形成します。 [7] [11] [12]細孔は、さまざまな非極性の疎水性アミノ酸で裏打ちされています。 細孔の構造と組成の両方により、小さな陰イオンだけがチャネルを完全に通過できるようになります。 チャネルは、連携して動作する2つの漏斗として機能します。 半選択的な陰イオンの狭い入り口から始まり、次により大きく正に帯電した領域に開き、さらに狭い経路につながり、細孔を通過する陰イオンのサイズがさらに制限されます。 カルシウムクラスプは、チャネルのより大きな中央セクションの周囲をベルト機構として機能します。カルシウムイオンは、最後の膜貫通ドメインの直後のC末端でのカルシウム結合によって引き起こされる構造変化により、チャネルの開閉を制御します。 [7] [12]
組織および細胞内分布
BEST1遺伝子の発現部位はタンパク質の機能に不可欠であり、その誤った局在はしばしば様々な網膜 変性疾患と関連している。BEST1遺伝子は、主に網膜色素上皮の細胞質でBest1タンパク質を発現する。このタンパク質は通常、細胞膜近くの小胞に含まれる。また、Best1タンパク質が小胞体(タンパク質と脂質の合成に関与する細胞内器官)に局在し、そこで産生されることを裏付ける研究もある。Best1は通常、カルレティキュリン、カルネキシン、Stim-1など、小胞体で合成される他のタンパク質とともに発現する。塩化物イオンの逆輸送におけるカルシウムイオンの関与も、Best1が細胞内のカルシウム貯蔵の形成に関与しているという考えを裏付けている。[10]
関数
Best1は主に細胞膜上の細胞内カルシウム活性化塩素イオンチャネルとして機能し、電圧依存性はありません。[6] [10] [12]最近ではBest1が容積調節陰イオンチャネルとして機能することが示されています。
病気
最良の卵黄様黄斑ジストロフィー(BVMD)

ベスト卵黄様黄斑ジストロフィー(BVMD)は、Best1遺伝子関連疾患のなかでも最も一般的なものの1つである。BVMDは典型的には小児で顕著となり、眼におけるリポフスチン(脂質残留物)病変の蓄積として現れる。 [6] [10]通常、診断は網膜色素上皮の基底外側膜におけるカルシウムチャネルの活性化低下が明らかになる異常眼電図の後に行われる。BEST1遺伝子の変異はチャネル機能の喪失を招き、最終的には網膜変性を引き起こす。[10] BVMDは常染色体優性遺伝の黄斑ジストロフィー であるが、罹患家系の圧倒的多数が北欧系であるにもかかわらず、その表現型は罹患家系内および罹患家系間でも異なる。[7] [10]典型的には、この疾患の患者は5段階の進行性悪化を経験するが、時期と重症度は大きく異なる。BVMDは単一のミスセンス変異によって引き起こされることが多いが、アミノ酸の欠失も特定されている。[7] Best1塩素チャネルの機能喪失は、BVMDに関連する最も一般的な問題のいくつか、すなわち細胞内イオン濃度の調節と細胞全体の容積の調節の不全を説明する可能性がある。[13]現在までに、100を超える疾患原因変異がBVMDおよびその他の多くの変性網膜疾患に関連している。[12]
成人発症型卵黄様黄斑ジストロフィー(AVMD)
成人発症型卵黄様黄斑ジストロフィー(AVMD)は、網膜にBVMDに類似した病変を呈します。しかし、原因はBVMDほど明確ではありません。遺伝子検査によるAVMDの診断が不可能なため、AVMDとパターンジストロフィーの鑑別は困難です。また、BEST1変異に起因するAVMDとPRPH2変異に起因するAVMDの間に臨床的な差異があるかどうかも不明です。AVMDは通常、BVMDよりも視力低下が少なく、家族内での発症も少ないのが一般的です。[7]
常染色体劣性ベストロフィノパチー(ARB)
常染色体劣性ベストロフィノパチー(ARB)は2008年に初めて特定されました。ARBの患者は、生後10年間に視力低下が見られます。この疾患は常染色体劣性であるため、両親や家族には通常異常が見られず、BEST1遺伝子の両方の対立遺伝子が変異していると考えられます。卵黄様病変がしばしば認められ、嚢胞様黄斑浮腫を伴う症例もあります。さらに、他の合併症も観察されています。視力は時間の経過とともにゆっくりと低下しますが、低下速度は様々です。ARBを引き起こす変異は、ミスセンス変異から非コード領域の1塩基変異まで多岐にわたります。[7]
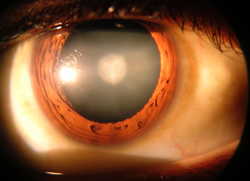
常染色体優性硝子体網脈絡膜症
常染色体優性硝子体網脈絡膜症は1982年に初めて発見され、両眼に過剰な体液と網膜色素変性による周辺視力の低下を伴います。早期に白内障を発症する可能性もあります。[7]
網膜色素変性症(RP)

網膜色素変性症は2009年にBEST1遺伝子との関連で初めて報告され、ヒトにおけるBEST1遺伝子の4つの異なるミスセンス変異と関連していることが判明しました。罹患したすべての患者は、網膜における光に対する反応の低下を経験し、色素沈着の変化、視神経乳頭の蒼白、体液貯留、視力低下がみられることがあります。[7]
上記の疾患にはいずれも、治療法や治癒法は知られていません。しかし、2017年現在、研究者たちは網膜色素上皮細胞の幹細胞移植による治療法の開発に取り組んでいます。 [7]
参考文献
- ^ abc GRCh38: Ensemblリリース89: ENSG00000167995 – Ensembl、2017年5月
- ^ abc GRCm38: Ensemblリリース89: ENSMUSG00000037418 – Ensembl、2017年5月
- ^ 「Human PubMed Reference:」。米国国立医学図書館、国立生物工学情報センター。
- ^ 「マウスPubMedリファレンス:」。米国国立医学図書館、国立生物工学情報センター。
- ^ ab "エントレズ遺伝子: BEST1 ベストロフィン 1".
- ^ abc Kunzelmann K (2015年9月). 「TMEM16、LRRC8A、ベストロフィン:Ca(2+)と細胞容積によって制御される塩化物チャネル」レビュー. Trends in Biochemical Sciences . 40 (9): 535–43 . doi :10.1016/j.tibs.2015.07.005. PMID 26254230.
- ^ abcdefghijklm Johnson AA, Guziewicz KE, Lee CJ, Kalathur RC, Pulido JS, Marmorstein LY, Marmorstein AD (2017年1月). 「Bestrophin 1と網膜疾患」レビュー.網膜と眼の研究の進歩. 58 : 45–69 . doi :10.1016/j.preteyeres.2017.01.006. PMC 5600499. PMID 28153808 .
- ^ Esumi N, Kachi S, Campochiaro PA, Zack DJ (2007年1月). 「VMD2プロモーターはin vivoでの活性発現に2つの近位Eボックス部位を必要とし、MITF-TFEファミリーによって制御される」. プライマリ. The Journal of Biological Chemistry . 282 (3): 1838–50 . doi : 10.1074/jbc.M609517200 . PMID 17085443.
- ^ Hoek KS, Schlegel NC, Eichhoff OM, Widmer DS, Praetorius C, Einarsson SO, Valgeirsdottir S, Bergsteinsdottir K, Schepsky A, Dummer R, Steingrimsson E (2008年12月). 「2段階DNAマイクロアレイ戦略を用いた新規MITF標的の同定」. プライマリ. Pigment Cell & Melanoma Research . 21 (6): 665–76 . doi : 10.1111/j.1755-148X.2008.00505.x . PMID 19067971. S2CID 24698373.
- ^ abcdefg Strauss O, Neussert R, Müller C, Milenkovic VM (2012). 「ベストロフィン-1の潜在的な細胞質機能」.網膜変性疾患. レビュー. 実験医学生物学の進歩. 第723巻. pp. 603–10 . doi :10.1007/978-1-4614-0631-0_77. ISBN 978-1-4614-0630-3. PMID 22183384。
- ^ Hartzell HC, Qu Z, Yu K, Xiao Q, Chien LT (2008年4月). 「ベストロフィンの分子生理学:ベスト病およびその他の網膜症に関連する多機能性膜タンパク質」. レビュー.生理学レビュー. 88 (2): 639–72 . doi :10.1152/physrev.00022.2007. PMID 18391176.
- ^ abcd Xiao Q, Hartzell HC, Yu K (2010年7月). 「ベストロフィンと網膜症」. レビュー. Pflügers Archiv . 460 (2): 559– 69. doi :10.1007/s00424-010-0821-5. PMC 2893225. PMID 20349192 .
- ^ Olaf S, Müller C, Reichhart N, Tamm ER, Gomez NM (2014). 「細胞内Ca2 +シグナル伝達におけるベストロフィン-1の役割」. Ash J, Grimm C, Hollyfield JG, Anderson RE, LaVail NM, Rickman CB (編).網膜変性疾患:メカニズムと実験的治療. レビュー. 実験医学生物学の進歩. 第801巻. ニューヨーク: Springer. pp. 113– 119. doi :10.1007/978-1-4614-3209-8_15. ISBN 978-1-4614-3209-8. PMID 24664688。
さらに読む
- White K, Marquardt A, Weber BH (2000). 「卵黄様黄斑ジストロフィー(ベスト病)およびその他の黄斑症におけるVMD2遺伝子変異」. Human Mutation . 15 (4): 301–8 . doi : 10.1002/(SICI)1098-1004(200004)15:4<301::AID-HUMU1>3.0.CO;2-N . PMID 10737974. S2CID 23807050.
- Nordström S, Barkman Y (1977年2月). 「スウェーデン中部における遺伝性黄斑変性症(HMD)246例の症例が単一の遺伝子源に起因することが判明」. Hereditas . 84 (2): 163–76 . doi : 10.1111/j.1601-5223.1977.tb01394.x . PMID 838599.
- Forsman K, Graff C, Nordström S, Johansson K, Westermark E, Lundgren E, Gustavson KH, Wadelius C, Holmgren G (1992年9月). 「スウェーデン人一家系においてベスト黄斑ジストロフィーの遺伝子は11q13に位置する」. Clinical Genetics . 42 (3): 156–9 . doi :10.1111/j.1399-0004.1992.tb03229.x. PMID 1395087. S2CID 924428.
- Stöhr H, Marquardt A, Rivera A, Cooper PR, Nowak NJ, Shows TB, Gerhard DS, Weber BH (1998年1月). 「染色体11q12-q13.1におけるベスト卵黄様黄斑ジストロフィー領域の遺伝子マップ」. Genome Research . 8 (1): 48– 56. doi :10.1101/gr.8.1.48. PMC 310689. PMID 9445487 .
- Petrukhin K, Koisti MJ, Bakall B, Li W, Xie G, Marknell T, Sandgren O, Forsman K, Holmgren G, Andreasson S, Vujic M, Bergen AA, McGarty-Dugan V, Figueroa D, Austin CP, Metzker ML, Caskey CT, Wadelius C (1998年7月). 「ベスト黄斑ジストロフィーの原因遺伝子の同定」. Nature Genetics . 19 (3): 241–7 . doi :10.1038/915. PMID 9662395. S2CID 23334668.
- Pennisi E (1998年7月). 「遺伝性黄斑変性症の新しい遺伝子を発見」. Science . 281 (5373): 31. doi :10.1126/science.281.5373.31. PMID 9679014. S2CID 44271444.
- Marquardt A, Stöhr H, Passmore LA, Krämer F, Rivera A, Weber BH (1998年9月). 「未知の特性を持つタンパク質をコードする新規遺伝子VMD2の変異が、若年発症型卵黄様黄斑ジストロフィー(ベスト病)を引き起こす」. Human Molecular Genetics . 7 (9): 1517–25 . doi : 10.1093/hmg/7.9.1517 . PMID 9700209.
- Caldwell GM, Kakuk LE, Griesinger IB, Simpson SA, Nowak NJ, Small KW, Maumenee IH, Rosenfeld PJ, Sieving PA, Shows TB, Ayyagari R (1999年5月). 「ベスト卵黄様黄斑ジストロフィー患者におけるベストロフィン遺伝子変異」. Genomics . 58 (1): 98– 101. doi :10.1006/geno.1999.5808. PMID 10331951.
- Bakall B, Marknell T, Ingvast S, Koisti MJ, Sandgren O, Li W, Bergen AA, Andreasson S, Rosenberg T, Petrukhin K, Wadelius C (1999年5月). 「ベストロフィンタンパク質の変異スペクトル ― 機能的意義」.ヒト遺伝学. 104 (5): 383–9 . doi :10.1007/s004390050972. PMID 10394929. S2CID 21255716.
- Allikmets R, Seddon JM, Bernstein PS, Hutchinson A, Atkinson A, Sharma S, Gerrard B, Li W, Metzker ML, Wadelius C, Caskey CT, Dean M, Petrukhin K (1999年6月). 「加齢黄斑変性症およびその他の黄斑症患者におけるBest疾患遺伝子の評価」. Human Genetics . 104 (6): 449–53 . doi :10.1007/s004390050986. PMID 10453731. S2CID 6214287.
- Palomba G, Rozzo C, Angius A, Pierrottet CO, Orzalesi N, Pirastu M (2000年2月). 「VMD2遺伝子における新たな自然発生的ミスセンス変異は、散発性黄斑ジストロフィーの最も良い症例の原因である」. American Journal of Ophthalmology . 129 (2): 260–2 . doi :10.1016/S0002-9394(99)00327-X. PMID 10682987.
- Lotery AJ、Namperumalsamy P、Jacobson SG、Weleber RG、Fishman GA、Musarella MA、Hoyt CS、Héon E、Levin A、Jan J、Lam B、Carr RE、Franklin A、Radha S、Andorf JL、Sheffield VC、Stone EM (2000 年 4 月)。 「レーベル先天性黒内障患者における 3 つの遺伝子の変異分析」。眼科のアーカイブ。118 (4): 538–43 .土井: 10.1001/archoht.118.4.538。PMID 10766140。
- Lotery AJ, Munier FL, Fishman GA, Weleber RG, Jacobson SG, Affatigato LM, Nichols BE, Schorderet DF, Sheffield VC, Stone EM (2000年5月). 「VMD2遺伝子のアレル変異と加齢黄斑変性症の関連性」. Investigative Ophthalmology & Visual Science . 41 (6): 1291–6 . PMID 10798642.
- Krämer F, White K, Pauleikhoff D, Gehrig A, Passmore L, Rivera A, Rudolph G, Kellner U, Andrassi M, Lorenz B, Rohrschneider K, Blankenagel A, Jurklies B, Schilling H, Schütt F, Holz FG, Weber BH (2000年4月). 「VMD2遺伝子の変異は若年発症型卵黄様黄斑ジストロフィー(ベスト病)および成人型卵黄様黄斑ジストロフィーと関連しているが、加齢性黄斑変性とは関連していない」. European Journal of Human Genetics . 8 (4): 286–92 . doi : 10.1038/sj.ejhg.5200447 . PMID 10854112.
- Marmorstein AD, Marmorstein LY, Rayborn M, Wang X, Hollyfield JG, Petrukhin K (2000年11月). 「ベスト卵黄様黄斑ジストロフィー遺伝子(VMD2)の産物であるベストロフィンは、網膜色素上皮の基底外側細胞膜に局在する」. Proceedings of the National Academy of Sciences of the United States of America . 97 (23): 12758–63 . Bibcode :2000PNAS...9712758M. doi : 10.1073/pnas.220402097 . PMC 18837. PMID 11050159 .
- マルシャン D、ゴガ K、ブートブール S、ペキニョ M、スタンバーグ C、デュロー P、ロシュ O、ウテザ Y、アッシュ JC、ピュシュ B、ピュシュ V、デュムール V、ムイヨン M、ムニエ FL、ショードルレ DF、マルサック C、デュフィエ JL、アビトボル M (2001 年 3 月)。 「最良の卵黄様黄斑ジストロフィー患者における新規のVMD2遺伝子変異の同定」。人間の突然変異。17 (3): 235.土井: 10.1002/humu.9。PMID 11241846。S2CID 16128731 。
- Eksandh L, Bakall B, Bauer B, Wadelius C, Andréasson S (2001年6月). 「VMD2遺伝子の新たな変異(Val89Ala)によって引き起こされるベスト卵黄様黄斑ジストロフィー」.眼科遺伝学. 22 (2): 107–15 . doi :10.1076/opge.22.2.107.2226. PMID 11449320. S2CID 7035792.
- Sun H, Tsunenari T, Yau KW, Nathans J (2002年3月). 「卵黄様黄斑ジストロフィータンパク質は新たな塩素イオンチャネルファミリーを定義する」. Proceedings of the National Academy of Sciences of the United States of America . 99 (6): 4008–13 . Bibcode :2002PNAS...99.4008S. doi : 10.1073/pnas.052692999 . PMC 122639. PMID 11904445 .
- Xiao Q, Yu K, Cui YY, Hartzell HC (2009年9月). 「セラミド誘導性脱リン酸化によるヒトベストロフィン-1の調節不全」. The Journal of Physiology . 587 (Pt 18): 4379–91 . doi :10.1113/jphysiol.2009.176800. PMC 2766645. PMID 19635817 .
- Xiao Q, Prussia A, Yu K, Cui YY, Hartzell HC (2008年12月). 「カルシウムによるベストロフィンClチャネルの制御:C末端の役割」. The Journal of General Physiology . 132 (6): 681–92 . doi :10.1085/jgp.200810056. PMC 2585866. PMID 19029375 .
外部リンク
- GeneReviews/NCBI/NIH/UW の網膜色素変性症に関するエントリーの概要
- UCSC ゲノム ブラウザのヒト BEST1 ゲノムの位置と BEST1 遺伝子の詳細ページ。
この記事には、パブリック ドメインである米国国立医学図書館のテキストが組み込まれています。






