コラーゲン、タイプXXIII、アルファ1
| COL23A1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 識別子 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| エイリアス | COL23A1、コラーゲンXXIII型アルファ1鎖 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 外部ID | オミム: 610043 ; MGI : 2653243 ;ホモロジーン: 72101 ;ジーンカード:COL23A1 ; OMA : COL23A1 - オルソログ | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| ウィキデータ | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
コラーゲンα-1(XXIII)鎖は、COL23A1遺伝子によってコードされるタンパク質であり、ヒトでは染色体5q35、マウスでは染色体11B1+2に位置している。[ 5 ]この遺伝子の位置はゲノム配列解析によって発見された。
コラーゲンXXIIIはII型膜貫通タンパク質であり、非線維性膜貫通コラーゲンのサブファミリーの4番目にあたります。このタイプのコラーゲンは、1回膜貫通の疎水性膜貫通ドメインを有します。コラーゲンXXIII分子は、膜結合型または脱落型のいずれかで存在します。
XXIII型コラーゲンは、成人の組織と発達中の臓器の両方で発現しています。表皮や舌、腸、肺などの上皮組織だけでなく、脳、腎臓、角膜にも存在します。前立腺では、XXIII型コラーゲンの発現が腫瘍の進行と関連していることが示されています。
コラーゲン XXIII の機能はまだ不明ですが、コラーゲン XIIIなどの他の膜貫通タンパク質と似ている可能性があると考えられています。
発見
コラーゲンXXIIIは、2003年にジャクリーン・バンヤード、レレ・バオ、ブルース・R・ゼッターによってラット前立腺癌細胞から初めて同定・単離されました[ 6 ]。彼らはヒト組織でもこのタンパク質を同定しました。彼らは、ヌクレオチドレベルでヒトとラットのコラーゲンXXIIIα1は76%の相同性を示すと結論付けました。さらに、コラーゲンXXIIIの細胞内局在は、タンパク質のカルボキシル末端を認識する抗体を用いた免疫蛍光染色によって決定されました。その結果、コラーゲンXXIIIのカルボキシル末端は細胞表面に存在することが実証されました。
構造
タンパク質構造
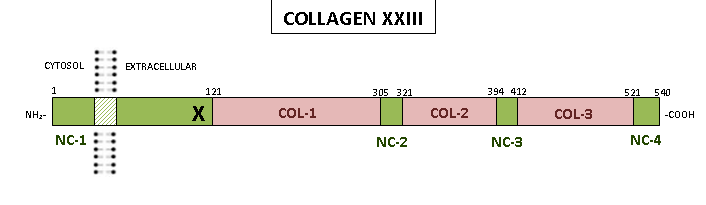
ホモ三量体であるヒトコラーゲンα1(XXIII)には、以下の場所に分布する540個のアミノ酸が含まれています。
- 120 個のアミノ酸からなる長いアミノ末端非コラーゲンドメイン(NC-1) は、短い細胞質領域、膜貫通領域、短い細胞外領域の 3 つの部分に分けられます。
- 図に示すように、 420 アミノ酸長の細胞外領域は、3 つのコラーゲンドメイン(COL1、COL2、COL3)で構成され、短い非コラーゲンドメイン (NC2、NC3、NC4) によって中断されています。
構造相同性

コラーゲンXXIIIは、膜貫通型コラーゲンサブファミリーに属します。このグループに含まれるタンパク質は、アミノ末端の細胞質ドメイン、それに続く膜貫通型疎水性ドメイン、そして少なくとも1つの細胞外三重らせんコラーゲンドメインと、短い非コラーゲンドメインが交互に配置された構造を有します。
コラーゲンXIII、XVII、XXV、およびクラスAマクロファージスカベンジャー受容体、エクトジスプラシンA 、MARCO1受容体などの関連タンパク質もこのグループに属します。このタイプのタンパク質はMACIT(膜関連コラーゲン、中断された三重らせん構造) とも呼ばれます。
コラーゲンXXIIIは、コラーゲンXIIIおよびコラーゲンXXVと構造相同性を示す[ 7 ] 。膜貫通型コラーゲンの特徴的な構造を有することに加え、これら3つのタンパク質は、コラーゲン領域および非コラーゲン領域において高いレベルのアミノ酸残基の保存性を示す。
コラーゲン α1(XIII)、α1(XXIII)、α1(XXV) には、3 つのコラーゲンドメイン (Col 1、Col 2、Col 3) と 4 つの非コラーゲンドメイン (膜貫通ドメインでもある NC1、NC2、NC3、NC4) があります。
α1(XXIII) の Col 1 ドメインはコラーゲン型 α1(XIII) および α1(XXV) の Col 1 および Col 2 ドメインの両方の領域と類似性を示し、一方 α1(XXIII) の Col 2 および Col 3 ドメインの配列は α1(XIII) および α1(XXV) の Col 3 ドメインと関連していることが報告されています。
短い非コラーゲン性ドメインも類似性を示し、特にNC1ドメインとNC4ドメインにおいて顕著です。これらのドメインのアミノ酸残基の60~78%は、3つの鎖すべてで同一です。さらに、これらのコラーゲンそれぞれにおいて、アミノ末端NC1ドメインとカルボキシル末端NC4ドメインの両方に、フーリン(主要な生理的プロテアーゼ)の切断部位と考えられる認識配列が見つかっています。このプロテアーゼの活性は、XIII、XXIII、XXV型コラーゲンがとり得る2つの形態の起源を説明する上で非常に重要です。
脱皮

膜貫通型コラーゲンの共通の特徴は、分子に2つの形態、すなわち全長の膜結合型と細胞外ドメインから分離した形態が存在することです。この特徴はコラーゲンXXIIIにも当てはまります。
コラーゲン XXIII の両方の形態の分布は組織特異性があり、脳などの臓器では分離形態が優勢であるのに対し、肺では分子は一般に全長形態として存在します。
細胞は膜結合型コラーゲンXXIIIと分泌型コラーゲンXXIIIの量を調節し、必要に応じてどちらかの形態のコラーゲンの産生に影響を与えることが報告されています。そのため、コラーゲンXXIIIの切断プロセスは選択的タンパク質分解として説明されており、主にフーリンによって行われますが、[ 8 ]セリンプロテアーゼやシステインプロテアーゼなど、この分子を切断できる他の酵素も存在します。
コラーゲン XXIII がゴルジ体内にあるとき、フーリンプロテアーゼが作用してタンパク質を切断し、分子の分離形態を生成します。この分離形態は、エキソサイトーシスによって細胞外マトリックスに放出されます。
分子の全長が、フーリンによって切断される前に細胞表面に到達する可能性もあります。この場合、コラーゲン分子全体が細胞膜に導入され、非コラーゲン性の膜貫通ドメインによって安定化され、コラーゲン性ドメインは細胞外に残ります。
コラーゲンXXIIIの完全長分子は通常、脂質ラフト中に存在します。脂質ラフトは、コレステロールとスフィンゴ脂質に富み、密集した細胞膜のミクロドメインです。フーリンプロテアーゼは、脂質ラフト内にあるコラーゲンXXIII分子に到達できないため、コラーゲンXXIII分子は完全長の形態を維持できます。
これらの分子が脂質ラフト保護を失った場合(つまり、膜コレステロールレベルが低下した場合)、フーリンプロテアーゼが作用して、細胞のすぐ外でタンパク質を切断し、コラーゲンXXIIIの分離した形態を直接細胞外マトリックスに放出します。
インテグリンα2β1との相互作用
コラーゲンの細胞受容体はβ1インテグリンファミリーに属します。コラーゲンXXIIIは、イオン依存的および立体構造依存的にインテグリンα2β1と相互作用します。[ 9 ] インテグリンα2β1は表皮に存在するコラーゲン結合インテグリンであるため、相互作用は表皮で起こります。両タンパク質は基底角化細胞表面に共局在します。
臨床的意義
コラーゲンXXIIIは、 NCLSC細胞(非小細胞肺癌)の検出と再発[ 10 ]、および前立腺癌の再発[ 11 ]のバイオマーカーとしての役割を担っています。いくつかの実験では、コラーゲンXXIIIが細胞接着に影響を与え、癌細胞が丸くなって転移できない状態で増殖と生存を促進することで転移の発達を促進することが示唆されています[ 12 ]。コラーゲンXXIIIの減少は細胞接着を複雑化し、肺癌細胞の滞留を減少させる可能性があることが示されています。
参照
参考文献
- ^ a b c GRCh38: Ensemblリリース89: ENSG00000050767 – Ensembl、2017年5月
- ^ a b c GRCm38: Ensemblリリース89: ENSMUSG00000063564 – Ensembl、2017年5月
- ^ 「ヒトPubMedリファレンス:」。米国国立医学図書館、国立生物工学情報センター。
- ^ 「マウスPubMedリファレンス:」米国国立医学図書館、国立生物工学情報センター。
- ^ 「Entrez遺伝子:COL23A1コラーゲン、タイプXXIII、アルファ1」。
- ^ Banyard J, Bao L, Zetter BR (2003年6月). 「転移性腫瘍細胞で同定された新たな膜貫通コラーゲン、タイプXXIIIコラーゲン」 . J. Biol. Chem . 278 (23): 20989–94 . doi : 10.1074/jbc.M210616200 . PMID 12644459 .
- ^ Koch M、Veit G、Stricker S、Bhatt P、Kutsch S、Zhou P、Reinders E、Hahn RA、Song R、Burgeson RE、Gerecke DR、Mundlos S、Gordon MK (2006 年 5 月)。「XXIII 型コラーゲンの mRNA とタンパク質の発現」。J.Biol.化学。281 (30): 21546–57 .土井: 10.1074/jbc.M604131200。hdl : 11858/00-001M-0000-0010-83E3-6。PMID 16728390。
- ^ Veit G, Zimina EP, Franzke CW, Kutsch S, Siebolds U, Gordon MK, Bruckner-Tuderman L, Koch M (2007年9月). 「コラーゲンXXIIIの切断はフーリンを介して起こり、細胞膜微小環境に依存する」 . J. Biol. Chem . 282 (37): 27424–35 . doi : 10.1074/jbc.M703425200 . PMID 17627939 .
- ^ファイト G、ズヴォラネック D、エッケス B、ニランド S、カピュラ J、ツヴェール MC、イシャダ・ヤマモト A、クリーグ T、ヘイノ J、エブレ JA、コッホ M (2011 年 8 月)。「コラーゲンXXIII、表皮におけるインテグリンα2β1の新規リガンド」。J.Biol.化学。286 (31): 27804–13 .土井: 10.1074/jbc.M111.220046。PMC 3149370。PMID 21652699。
- ^ Spivey KA, Banyard J, Solis LM, Wistuba II, Barletta JA, Gandhi L, Feldman HA, Rodig SJ, Chirieac LR, Zetter BR (2010年5月). 「コラーゲンXXIII:原発性および再発性非小細胞肺癌の検出における潜在的なバイオマーカー」 . Cancer Epidemiol. Biomarkers Prev . 19 (5): 1362– 72. doi : 10.1158 / 1055-9965.EPI-09-1095 . PMC 2880394. PMID 20447926 .
- ^ Banyard J, Bao L, Hofer MD, Zurakowski D, Spivey KA, Feldman AS, Hutchinson LM, Kuefer R, Rubin MA, Zetter BR (2007年5月). 「コラーゲンXXIIIの発現は前立腺癌の再発および遠隔転移と関連する」 . Clin Cancer Res . 13 (9): 2634–42 . doi : 10.1158/1078-0432.CCR-06-2163 . PMID 17473194 .
- ^ Spivey KA, Chung I, Banyard J, Adini I, Feldman HA, Zetter BR (2012年5月). 「癌細胞接着、足場非依存性、転移におけるコラーゲンXXIIIの役割」 . Oncogene . 31 (18): 2362–72 . doi : 10.1038/onc.2011.406 . PMC 3968770. PMID 21963851 .
さらに読む
- Brinckmann J (2005).コラーゲン:構造、処理、そして集合の入門書. 第247巻. Springer. pp. 1– 6. doi : 10.1007/b103817 .
- 硬タンパク質:研究と応用の進歩:2013年版. ScholarlyEditions. 2013. ISBN 978-1-481-68001-1。