カルボニル基

有機化学において、カルボニル基は化学式C=Oで表される官能基であり、炭素原子と酸素原子が二重結合した構造を持ち、C原子において二価である。カルボニル基は、アルデヒド、ケトン、カルボン酸などのいくつかの有機化合物に共通しており、多くのより大きな官能基の一部である。カルボニル基を含む化合物は、しばしばカルボニル化合物と呼ばれる。[ 1 ]
カルボニルという用語は、無機または有機金属錯体(金属カルボニル、例:ニッケルカルボニル)の配位子としての一酸化炭素を指すこともあります。
この記事の残りの部分では、炭素と酸素が二重結合を共有するカルボニルの有機化学の定義について説明します。
カルボニル化合物
有機化学において、カルボニル基は次の種類の化合物を特徴付けます。
| 化合物 | アルデヒド | ケトン | カルボン酸 | カルボン酸エステル | アミド |
|---|---|---|---|---|---|
| 構造 |  |  |  |  |  |
| 一般式 | RCHO | RCOR' | RCOOH | RCOOR' | RCONR'R'' |
| 化合物 | エノーネ | ハロゲン化アシル | 酸無水物 | イミド |
|---|---|---|---|---|
| 構造 |  |  | 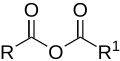 |  |
| 一般式 | RC(O)C(R')CR''R''' | RCOX | (RCO)2O | RC(O)N(R')C(O)R'' |
その他の有機カルボニル化合物としては、尿素、カルバメート、塩化アシル、クロロホルメート、ホスゲンの誘導体、炭酸エステル、チオエステル、ラクトン、ラクタム、ヒドロキサメート、イソシアネートなどがあります。無機カルボニル化合物の例としては、二酸化炭素や硫化カルボニルなどがあります。
カルボニル化合物の特別なグループはジカルボニル化合物であり、特殊な特性を示すことができます。
構造と反応性
有機化合物の場合、C–O結合の長さは120ピコメートルからそれほど大きく変わりません。無機カルボニルのC–O結合距離はより短く、COは113ピコメートル、CO 2は116ピコメートル、COCl 2は116ピコメートルです。[ 2 ]
カルボニル炭素は典型的には求電子性を示します。求電子性の定性的な順序は、RCHO(アルデヒド)> R 2 CO(ケトン)> RCO 2 R'(エステル)> RCONH 2(アミド)です。様々な求核剤が攻撃し、炭素-酸素二重結合を切断します。
コラーゲンの研究において、カルボニル基と他の置換基との相互作用が発見されました。[ 3 ]置換基はシグマ結合によって電子密度を増減させることでカルボニル基に影響を及ぼすことができます。[ 4 ]カルボニル基上の置換基が炭素よりも電気陰性度が高い場合、ΔHσ値ははるかに大きくなります。[ 4 ]

C=O結合の極性は、隣接するCH結合の酸性度を高めます。炭素の正電荷と酸素の負電荷により、カルボニル基は付加攻撃や求核攻撃を受けやすくなります。様々な求核剤が攻撃し、炭素-酸素二重結合を切断して付加脱離反応を引き起こします。求核反応性は求核剤の塩基性に比例することが多く、求核性が高まるほどカルボニル化合物の安定性は低下します。[ 5 ]アセトアルデヒドとアセトンのpKa値はそれぞれ16.7と19です。[ 6 ]
分光法
- 赤外分光法:C=O二重結合は、約1600~1900 cm −1 (5263 nm~6250 nm)の波数域の赤外光を吸収します。吸収の正確な位置は、分子の形状から十分に理解されています。この吸収は、赤外吸収スペクトル上では「カルボニル伸縮」として知られています。[ 7 ]さらに、水中のプロパノンの紫外可視スペクトルでは、257 nmにカルボニル基の吸収が見られます。[ 8 ]
- 核磁気共鳴:C=O二重結合は周囲の原子に応じて異なる共鳴を示し、一般的には低磁場シフトを示す。カルボニル炭素の13C NMRは160~220 ppmの範囲にある。[ 9 ]
参照
参考文献
- ^ Saul Patai編 (1966).カルボニル基. PATAI'S Chemistry of Functional Groups. 第1巻. John Wiley & Sons. doi : 10.1002/9780470771051 . ISBN 9780470771051。ジェイコブ・ザビッキー編 (1970).カルボニル基. PATAI'S Chemistry of Functional Groups. 第2巻. John Wiley & Sons. doi : 10.1002/9780470771228 . ISBN 9780470771228。
- ^ G. Berthier, J. Serre (1966). 「カルボニル基の一般的および理論的側面」. Saul Patai (編).カルボニル基. PATAI'S Chemistry of Functional Groups. 第1巻. John Wiley & Sons. pp. 1– 77. doi : 10.1002/9780470771051.ch1 . ISBN 9780470771051。
- ^ Newberry, Robert W.; Raines, Ronald T. (2017-08-15). 「n→π*相互作用」 . Accounts of Chemical Research . 50 (8): 1838– 1846. doi : 10.1021/acs.accounts.7b00121 . ISSN 0001-4842 . PMC 5559721. PMID 28735540 .
- ^ a b Wiberg, Kenneth B. (1999-11-01). 「カルボニル基と置換基の相互作用」 . Accounts of Chemical Research . 32 (11): 922– 929. doi : 10.1021/ar990008h . ISSN 0001-4842 .
- ^ Lienhard, Gustav E.; Jencks, William P. (1966年9月). 「カルボニル基へのチオール付加反応.平衡と反応速度論1」 . Journal of the American Chemical Society . 88 (17): 3982– 3995. doi : 10.1021/ja00969a017 . ISSN 0002-7863 . PMID 5915153 .
- ^ Ouellette, RJおよびRawn, JD「有機化学」第1版、Prentice-Hall, Inc.、1996年:ニュージャージー州 。ISBN 0-02-390171-3
- ^ Mayo DW、Miller FA、Hannah RW「赤外線およびラマンスペクトルの解釈に関するコースノート」第1版、John Wiley & Sons Inc、2004年:ニュージャージー州 。ISBN 0-471-24823-1。
- ^ 「アーカイブコピー」(PDF) 。 2015年8月24日時点のオリジナル(PDF)からアーカイブ。 2015年7月11日閲覧。
{{cite web}}: CS1 maint: アーカイブされたコピーをタイトルとして (リンク) - ^ “NMR Spectroscopy. 13C NMR” . organicchemistrydata.org . 2021年10月20日. 2024年1月6日時点のオリジナルよりアーカイブ。 2024年1月6日閲覧。
さらに読む
- LG Wade, Jr.有機化学、第5版、Prentice Hall、2002年。ISBN 0-13-033832-X
- フロストバーグ州立大学化学科.有機化学ヘルプ(2000).
- Advanced Chemistry Development, Inc. IUPAC有機化学命名法(1997)。
- ウィリアム・ロイシュ.有機化学の仮想テキスト(2004).
- パーデュー大学化学部[1] (2006年9月閲覧)。水溶解度データを含む。
- William Reusch. (2004) Aldehydes and Ketones 2005年5月23日閲覧。
- ILPI (2005) MSDSハイパー用語集-無水物。

