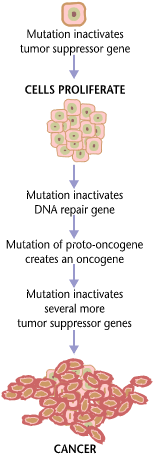
がんは、遺伝子変異によって引き起こされ、制御不能な細胞増殖と腫瘍形成を引き起こします。散発性(非家族性)がんの基本的な原因は、DNA損傷とゲノム不安定性です。[1] [2]がんの少数は、遺伝性の遺伝子変異が原因です。[3]ほとんどのがんは、環境、生活習慣、または行動による曝露に関連しています。[4] がんは一般的にヒトに伝染しませんが、オンコウイルスや癌菌によって引き起こされる可能性があります。がん研究者が使用する「環境」という用語は、体外でヒトと相互作用するすべてのものを指します。[5]環境は、生物物理学的環境(大気汚染や日光などの要因への曝露など)に限定されず、生活習慣や行動要因も含まれます。[6]
世界中で癌による死亡の3分の1以上(米国では約75~80%)は、既知の要因への曝露を減らすことで潜在的に回避できる。[7] [8]癌による死亡に寄与する一般的な環境要因には、さまざまな化学物質や物理的因子への曝露(喫煙は癌による死亡の25~30%を占める)、環境汚染物質、食事と肥満(30~35%)、感染症(15~20%)、放射線(電離放射線と非電離放射線の両方、最大10%)などがある。[9]これらの要因は、少なくとも部分的には、細胞内の遺伝子の機能を変化させることで作用する。[10]通常、癌が発生するには、このような遺伝子変化が多数必要である。[10]特定の癌の発生リスク要因を評価する際に、加齢は繰り返し一貫して考慮すべき重要な側面とみなされてきた。癌の発生に関与する多くの分子レベルおよび細胞レベルの変化は、加齢の過程で蓄積し、最終的に癌として発現する。[11]
遺伝学

遺伝性の癌は50種類以上確認されていますが、癌関連の遺伝子変異の保因者は人口の0.3%未満であり、癌症例全体の3~10%未満を占めています。[3]癌の大部分は非遺伝性(散発性癌)です。遺伝性癌は主に遺伝性の遺伝子欠陥によって引き起こされます。癌症候群または家族性癌症候群は、1つまたは複数の遺伝子における遺伝性の遺伝子変異によって癌を発症しやすくなり、早期に発症することもある遺伝性疾患です。癌症候群は癌のリスク増加を示しますが、そのリスクは様々です。これらの疾患の中には、癌が主症状ではなく、まれな結果であるものもあります。
がん症候群の症例の多くは、細胞の成長を制御する腫瘍抑制遺伝子の変異によって引き起こされます。その他の一般的な変異は、DNA修復遺伝子、がん遺伝子、血管の生成に関与する遺伝子の機能を変化させます。[12] BRCA1およびBRCA2遺伝子の特定の遺伝性変異は、乳がんおよび卵巣がんのリスクを75%以上伴います。[3]大腸がんを引き起こす可能性のある遺伝性遺伝子疾患には、家族性腺腫性ポリープ症や遺伝性非ポリープ性大腸がんなどがありますが、これらは大腸がん症例の5%未満を占めます。[13]多くの場合、遺伝子検査を使用して、世代を超えて受け継がれる変異遺伝子または染色体を特定できます。
癌症候群
- 毛細血管拡張性運動失調症
- ブルーム症候群
- BRCA1とBRCA2
- ファンコニ貧血
- 家族性大腸腺腫症
- 遺伝性乳がんおよび卵巣がん
- 遺伝性非ポリポーシス大腸がん
- リ・フラウメニ症候群
- 母斑性基底細胞癌症候群
- フォン・ヒッペル・リンドウ病
- ウェルナー症候群
- 色素性乾皮症
物理的および化学的薬剤
発がん物質として知られる特定の物質は、特定の種類のがんに関連付けられている。非放射性発がん物質の一般的な例としては、吸入アスベスト、特定のダイオキシン、タバコの煙がある。一般の人々は発がん性というと合成化学物質を連想するが、天然物質と合成物質のどちらでも同程度に発がん性が生じる可能性がある。[14]米国では毎年約2万人ががんにより死亡し、4万人が新たにがんを発症しており、その原因は職業にあると推定されている。[15]世界中で毎年少なくとも20万人が職場に関連するがんにより死亡している。[16]何百万人もの労働者が、アスベスト繊維やタバコの煙を吸入することで肺がんや中皮腫などのがんを、職場でのベンゼンへの曝露で白血病を発症するリスクにさらされている。[16]職業に関連するがんは、全症例の2~20%を占めると考えられている。[17]職業上の危険因子による癌による死亡のほとんどは先進国で発生しています。[16]職業上のストレスは、少なくとも肺がん、大腸がん、乳がん、前立腺がんにおいては、重要な要因ではないようです。[18] ベトナム戦争中にランチハンド作戦に参加したり、ゴルフ場の近くに住んだり、農場で生活したりすると、化学物質2,4-Dへの曝露により非ホジキンリンパ腫のリスクが高まります。2,4-Dが別の化学殺虫剤または除草剤である2,4-Tと50:50の割合で混合されると、これらはまとめてエージェントオレンジと呼ばれます。
大気汚染

2019年には、大気中に浮遊する微小粒子状物質(PM2.5 )への曝露が原因で、世界中で約26万5千人の肺がんによる死亡が報告されています。 [19]ラドンを含む室内空気汚染への曝露により、さらに17万人が肺がんにより死亡しました。[19]また、 NO2や黒色炭素に曝露した人々の間でも肺がんの罹患率が高くなっています。 [20]
屋外の大気汚染は他の種類の癌のリスクも高める可能性がありますが、肺癌ほど明確な証拠はありません。[21]例えば、腎臓癌とPM2.5およびNO2レベルとの間には関係がある可能性があります。[22]家庭内の大気汚染(固形燃料を使った調理だけでなく、建材中のラドンからも)は、子宮頸癌、口腔癌、食道癌と関連付けられています。[21]喫煙


喫煙は多くの種類の癌と関連があり、[24]肺癌の 80% の原因となっています。[25]数十年にわたる研究により、タバコの使用と肺、喉頭、頭部、頸部、胃、膀胱、腎臓、食道、膵臓の癌との関連が実証されています。[26]骨髄性白血病、扁平上皮細胞副鼻腔癌、肝臓癌、大腸癌、胆嚢癌、副腎癌、小腸癌、およびさまざまな小児癌を発症するリスクがわずかに増加することを示唆する証拠がいくつかあります。[26]タバコの煙には、呼吸器の発癌に最も関連する 7 つの毒物が確認されています。[27]そのうちの 2 つ、アクリロニトリルとアクロレイン の作用機序は、酸化ストレスと酸化 DNA 損傷に関与していると思われます。[28] [29]他の5つの毒物、アセトアルデヒド、カドミウム、エチレンオキシド、ホルムアルデヒド、イソプレンは、DNAとの直接相互作用を含む様々なメカニズムを通じて作用します。タバコの煙には、ニトロソアミンや多環芳香族炭化水素など、50種類以上の発がん性物質が含まれています。[30]タバコは、先進国における癌による死亡の約3分の1の原因であり、[24]世界全体では約5分の1の原因となっています。[30]米国の肺癌による死亡率は喫煙パターンを反映しており、喫煙が増加すると肺癌による死亡率が劇的に増加し、より最近では、1950年代以降喫煙率が低下し、1990年以降は男性の肺癌による死亡率が低下しています。[31] [32]しかし、世界中の喫煙者数は依然として増加しており、一部の組織がタバコの流行と表現している状況につながっています。[33]
電子タバコ(e-cigarette)は、タバコの喫煙感覚を模倣した携帯型電子機器です。高電圧(5.0V)の電子タバコを毎日長期使用すると、喫煙よりも高いレベルのホルムアルデヒド形成化学物質が発生する可能性があります。これは、生涯がんリスクが喫煙の約5~15倍であると判定されています。[34]しかし、電子タバコの全体的な安全性と長期的な健康への影響は依然として不明です。[35]
材料

一部の物質は、細胞に対する化学的影響ではなく、物理的影響によって主にがんを引き起こします。[36]その顕著な例は、アスベストへの長期曝露です。アスベストは天然に存在する鉱物繊維で、漿膜(通常は肺を囲む漿膜)のがんである中皮腫の主な原因です。[36]このカテゴリーの他の物質(ウォラストナイト、アタパルジャイト、グラスウール、ロックウールなど、天然および合成のアスベスト様繊維を含む)も同様の影響を及ぼすと考えられています。[36]がんを引き起こす非繊維性粒子状物質には、金属コバルトおよびニッケルの粉末、結晶性シリカ(石英、クリストバライト、トリジマイト)などがあります。[36]通常、物理的な発がん物質は、(小さな破片を吸入するなどして)体内に入り、がんを発症するには何年もの曝露が必要です。[36]一般的な職業性発がん物質には、以下のものがあります。 [37]
ライフスタイル
様々なライフスタイル要因ががんリスクの上昇に寄与しています。食生活と肥満は合わせて、がんによる死亡の約30~35%に関連しています。[9] [38]がん予防のための食生活の推奨事項には、一般的に野菜、果物、全粒穀物、魚介類を多く摂り、加工肉、赤身肉、動物性脂肪、精製炭水化物を避けることが含まれます。[39]これらの食生活の変化を裏付ける証拠は決定的なものではありません。[40]
アルコール

アルコールは化学的発がん物質の一例である。世界保健機関はアルコールをグループ1の発がん物質に分類している。[41]西ヨーロッパでは、男性のがんの10%、女性のがんの3%がアルコールに起因している。[42]世界的には、すべてのがん症例の3.6%、およびがんによる死亡の3.5%がアルコールに起因している。[43]特に、アルコールの使用は、口腔、食道、咽頭、喉頭、胃、肝臓、卵巣、および結腸のがんを発症するリスクを高めることがわかっている。[44]がん発症の主なメカニズムは、発がん物質でありエタノールの分解産物であるアセトアルデヒドへの曝露増加を伴う。[45] アセトアルデヒドは、DNA損傷の一形態であるDNA鎖間架橋を誘発する。これらは、不正確な複製と連動したDNA修復経路によって修復され得る。[46]この修復経路は、突然変異頻度の増加と突然変異スペクトルの変化をもたらす。[46]アルコール関連の栄養不足、 DNAメチル化の変化、組織における酸化ストレスの誘導など、他のメカニズムも提案されている。 [47]
ダイエット
特定の食品は特定のがんと関連していることが知られています。研究によると、赤肉や加工肉を摂取する人は、乳がん、前立腺がん、膵臓がんを発症するリスクが高いことが示されています。[48]これは、高温で調理された食品に発がん物質が含まれていることが部分的に説明できるかもしれません。 [49]大腸がん発症の危険因子には、脂肪、アルコール、赤肉や加工肉の過剰摂取、肥満、運動不足などがあります。[50]塩分の多い食事は胃がんと関連しています。食品によく含まれるアフラトキシンB1は肝臓がんと関連しています。ビンロウの実を噛むと口腔がんを引き起こすことが示されています。[51]
食生活と特定のがんの発生との関係は、国によってがん発生率が異なる理由を部分的に説明する可能性がある。例えば、胃がんは日本では塩分の多い食事の摂取頻度が高いため、米国では加工肉や赤身肉の摂取量が多いため、より多く発症する。[52]移民コミュニティは、移住先の国のがんリスクプロファイルを、多くの場合1~2世代以内に形成する傾向があり、これは食生活とがんの間に強い関連があることを示唆している。[53] [54]
マウスの餌にデオキシコール酸を添加し、その糞便に高脂肪食を摂取した人間の糞便と同程度のデオキシコール酸が含まれるようにしたところ、10ヶ月後に45~56%のマウスが大腸がんを発症したのに対し、デオキシコール酸を含まない餌を摂取したマウスではがんを発症しなかった。 [55] [56]微生物代謝物とがん の関係を調査した最近の前向きヒト研究では、女性の大腸がんリスクと循環デオキシコール酸およびその他の特定の胆汁酸との間に強い相関関係があることが判明した。 [ 57]
がんの代謝理論
癌の代謝理論とは、癌の主原因は細胞代謝の変化であるという仮説である。この理論は、食事療法が多くの、あるいはほとんどの種類の癌の予防または治療に利用できるという考えと強く結びついている。[58]細胞代謝の変化、具体的にはエネルギー源としてのブドウ糖 への依存度の増加と同化プロセスの活性化が、多くの種類の癌細胞で実際に起こることは広く認められている。[59] しかし、癌が食事療法によって大部分または完全に制御できるという考えは、医学分野では広く受け入れられていない。
がんの代謝理論は、正常細胞と急速に増殖する細胞の間のよく知られた生化学的差異に基づいています。
- ワールブルク効果:1920年代、オットー・ワールブルクは、がん細胞は酸素が豊富であっても嫌気性発酵によるエネルギー産生を好むことを観察しました。これは、酸素依存性の酸化的リン酸化によってより効率的なエネルギー産生を行う正常細胞とは異なります。[60] その結果、がん細胞はエネルギー源としてグルコース(糖)に大きく依存し、多量の乳酸を産生します。[61]
- ミトコンドリア機能不全:代謝理論の支持者は、ミトコンドリア機能不全が癌において重要な役割を果たしていると主張している。ミトコンドリアは細胞のエネルギー工場であり、細胞死(アポトーシス)を制御する役割を果たしている。[62] ミトコンドリアの形態変化は、ほとんどの種類の癌細胞で明らかである。[62]
- 代謝の柔軟性とグルタミン依存:癌細胞は、特にブドウ糖が限られている場合、代替エネルギー源として、また成長の構成要素としてグルタミンに依存することが多い。 [63] この代謝の柔軟性により、癌細胞はさまざまな条件下で適応し、増殖することができ、化学療法などの標準的な治療に対する耐性が高まります。[64]
低炭水化物食またはケトジェニック食は、がんの第一選択治療の補助として提案されています。これらの食事は体液中のグルコース濃度を大幅に低下させ、がん細胞が好むエネルギー源を枯渇させます。[65]
しかし、代謝理論は依然として研究段階にあり、議論の余地が残っています。がんにおける代謝異常の役割を裏付ける証拠はあるものの、多くの研究者は、がんを純粋に遺伝性疾患や代謝性疾患としてではなく、遺伝子変異と代謝異常の複雑な相互作用として研究しています。[66] [58] 2020年現在、がん治療におけるケトジェニックダイエットのランダム化比較試験は実施されていません。[65]
肥満
| 男性 | 女性 |
|---|---|
| 大腸がん | 大腸がん |
| 食道腺癌 | 子宮内膜がん |
| 腎臓がん | 食道腺癌 |
| 膵臓癌 | 胆嚢がん |
| 甲状腺がん | 腎臓がん |
| 膵臓癌 | |
| 閉経後乳がん |
米国では、過剰な体重は多くの種類の癌の発生と関連しており、癌による死亡全体の14~20%の要因となっています。[38]米国では毎年、約85,000件の新たな癌診断が肥満に関連しています。[67]減量のために肥満手術を受けた人は、癌の発症率と死亡率が低下しています。 [67]
肥満と大腸がん、閉経後乳がん、子宮内膜がん、腎臓がん、食道がんの間には関連がある。[67]肥満は肝臓がんの発生とも関連付けられている。[68]肥満におけるがん発生のメカニズムに関する現在の理解は、代謝タンパク質(インスリン様成長因子を含む)と性ホルモン(エストロゲン、アンドロゲン、プロゲストゲン)の異常なレベルに関連している。[67]脂肪組織はまた、がんの発生に寄与する可能性のある炎症性環境を作り出す。[ 69 ] 脂肪組織の調節不全は酸化ストレスをもたらし、酸化DNA損傷とがんに関連する遺伝的不安定性 につながる可能性がある。 [70]
身体活動不足は、体重への影響だけでなく、免疫系や内分泌系への悪影響を通じても、がんのリスクに寄与すると考えられています。[38] 食事による影響の半分以上は、健康的な食品の摂取不足ではなく、栄養過多によるものです。 [67]
ホルモン

いくつかのホルモンは細胞増殖を促進することで癌の発生に関与している。[71] インスリン様成長因子とその結合タンパク質は癌細胞の増殖、分化、アポトーシスに重要な役割を果たしており、発癌に関与している可能性を示唆している。[72]
ホルモンは、乳がん、子宮内膜がん、前立腺がん、卵巣がん、精巣がんなどの性別に関連するがんのほか、甲状腺がんや骨肉腫においても重要な役割を果たしている。[71] 例えば、乳がんにかかった女性の娘は、乳がんにかかっていない女性の娘よりもエストロゲンとプロゲステロンの値が有意に高い。これらのホルモン値が高いことが、乳がん遺伝子がなくてもこれらの女性が乳がんになるリスクが高い理由を説明できるかもしれない。[71]同様に、アフリカ系の男性はヨーロッパ系の男性よりもテストステロン値が有意に高く、それに応じて前立腺がんの発生率もはるかに高い。[71]テストステロンを活性化するアンドロスタンジオールグルクロン酸抱合体値が最も低いアジア系の男性は、前立腺がんの発生率も最も低い。[71]
他の要因も関連している。肥満者は癌に関連するいくつかのホルモンのレベルが高く、それらの癌の発生率も高い。[71]ホルモン補充療法を受ける女性は、それらのホルモンに関連する癌を発症するリスクがより高い。[71]一方、平均よりもはるかに多くの運動をする人はこれらのホルモンのレベルが低く、癌のリスクも低い。[71] 骨肉腫は成長ホルモンによって促進される可能性がある。[71]
一部の治療法や予防法では、ホルモンレベルを人工的に低下させることでこの原因を利用し、ホルモン感受性癌の増殖を抑制することがあります。ステロイドホルモンは特定の癌細胞における遺伝子発現の強力な推進力であるため、特定のホルモンのレベルや活性を変化させることで、特定の癌の増殖を停止させたり、細胞死を引き起こしたりすることができます。[71]腫瘍学におけるホルモン療法の最もよく知られた例は、おそらく選択的エストロゲン受容体モジュレーターである タモキシフェンを乳癌の治療に使用することです。別の種類のホルモン剤であるアロマターゼ阻害剤も、現在、乳癌の治療において重要な役割を果たしています。
感染と炎症
世界全体で、がん症例の約18%は感染症に関連しています。[9] [73]この割合は地域によって異なり、アフリカでは25%と高いのに対し、先進国では10%未満です。[9]がんを引き起こす感染性病原体として ウイルスが一般的ですが、細菌や寄生虫も原因となります。がんのリスクを高める感染性微生物は、しばしばDNA損傷やゲノム不安定性の原因となります。
ウイルス

ウイルス感染は子宮頸がんおよび肝臓がんの主要な危険因子である。[74]がんを引き起こす可能性のあるウイルスはオンコウイルスと呼ばれる。これには、ヒトパピローマウイルス(子宮頸がん)、エプスタイン・バーウイルス(B細胞リンパ増殖性疾患および鼻咽頭がん)、カポジ肉腫ヘルペスウイルス(カポジ肉腫および原発性滲出性リンパ腫)、B型肝炎ウイルスおよびC型肝炎ウイルス(肝細胞がん)、ヒトT細胞白血病ウイルス1(T細胞白血病)などが含まれる。
西側先進国では、ヒトパピローマウイルス(HPV)、B型肝炎ウイルス(HBV)、C型肝炎ウイルス(HCV)が最も一般的なオンコウイルスです。[75]米国では、HPVは子宮頸がんの大部分の原因であり、膣がん、外陰がん、陰茎がん、肛門がん、直腸がん、咽頭がん、舌がん、扁桃がんの一部もHPVが原因です。[76]高リスクHPVウイルスの中でも、HPV E6およびE7オンコタンパク質は、細胞に感染すると腫瘍抑制遺伝子を不活性化します。さらに、これらのオンコタンパク質は独立して正常なヒト細胞においてゲノム不安定性を誘導し、がん発症リスクを高めます。[77]慢性B型肝炎ウイルス感染者は、非感染者に比べて肝臓がんを発症する可能性が200倍以上高くなります。[78]慢性ウイルス性肝炎感染による肝硬変や過度のアルコール摂取による 肝硬変は、それぞれ独立して肝臓がんの発生と関連しているが、肝硬変とウイルス性肝炎を併発すると肝臓がん発生のリスクが最も高くなる。[78]
細菌と寄生虫

特定の細菌感染も、ヘリコバクター・ピロリ菌誘発性胃癌に見られるように、癌のリスクを高める。[79]ピロリ菌が癌を引き起こすメカニズムは、慢性炎症か、細菌の毒性因子の直接的な作用によるものと考えられる。[80]癌と強く関連する寄生虫感染には、ビルハルツ住血吸虫(膀胱扁平上皮癌)や肝吸虫のタイワン肝吸虫およびシネンシス肝吸虫(胆管癌)などがある。[81]寄生虫の卵によって引き起こされる炎症が、癌を引き起こすメカニズムであると考えられる。特定の寄生虫感染は、体内の発癌性化合物の存在を増加させ、癌の発生につながることもある。[82]結核 菌(M. tuberculosis)によって引き起こされる結核感染も、肺癌の発生と関連付けられている。[83]
炎症
炎症自体が癌の発生と進行に重要な役割を果たしているという証拠がある。 [84]慢性炎症は、時間の経過とともにDNA損傷を引き起こし、癌細胞におけるランダムな遺伝子変異の蓄積につながる可能性がある。[85]炎症は腫瘍微小環境に影響を与えることで、癌細胞の増殖、生存、血管新生、および遊走に寄与する可能性がある。[86]炎症性腸疾患の患者は、大腸癌を発症するリスクが高い。[13]
放射線
浸潤性癌の最大10%は、非電離放射線と電離放射線の両方を含む放射線被曝に関連している。[9]癌の化学的または物理的誘因とは異なり、電離放射線は細胞内の分子にランダムに衝突する。偶然染色体に衝突した場合、染色体が破壊され、染色体数が異常になり、衝突した染色体部分の1つ以上の遺伝子が不活性化され、DNA配列の一部が削除され、染色体転座が起こり、またはその他のタイプの染色体異常を引き起こす可能性がある。[87]大きな損傷は通常、細胞死をもたらすが、小さな損傷は、特に腫瘍抑制遺伝子が放射線によって損傷を受けた場合、増殖して癌に進行する可能性のある安定した部分的に機能する細胞を残すことがある。 [87]電離放射線による癌の発生には、細胞の形態変化、細胞の不死化(正常な細胞寿命制御プロセスの喪失)、そして腫瘍形成に有利な適応という3つの独立した段階が関与していると考えられる。[87]放射線粒子がDNAに直接衝突しなくても、細胞からの反応を引き起こし、間接的に突然変異の可能性を高める。[87]
非電離放射線
.jpg/440px-Squamous_cell_carcinoma_(3).jpg)
すべての種類の電磁放射線が発がん性を持つわけではありません。電波、マイクロ波、赤外線、可視光線など、電磁スペクトル上の低エネルギー波は、化学結合を切断するのに十分なエネルギーを持たないため、発がん性がないと考えられています。携帯電話、電力伝送、その他の類似の放射源から発せられる非電離高周波放射線は、世界保健機関(WHO)の国際がん研究機関(IARC)によって発がん性物質の可能性があるとされています。[88] [89]しかし、携帯電話の放射線とがんリスクの間に一貫した関連性を示す研究は見つかっていません。[90]
太陽光に含まれる紫外線、 X線、ガンマ線などの高エネルギー放射線は、十分な量を浴びると一般的に発がん性があります。太陽からの紫外線に長期間さらされると、メラノーマやその他の皮膚悪性腫瘍を引き起こす可能性があります。[91]非浸潤性癌の大部分は、非電離紫外線によって引き起こされる非メラノーマ皮膚癌です。明確な証拠により、紫外線、特に非電離中波UVBが、世界で最も一般的な癌である非メラノーマ皮膚癌の大部分の原因であることが示されています。[91]
電離放射線

電離放射線の発生源には、医用画像診断やラドンガスなどがある。電離放射線は特に強い変異原ではない。[87]電離放射線の医療利用は、放射線誘発がんの原因として増加している。電離放射線は他のがんの治療に使用されることがあるが、場合によっては、2つ目のがんを誘発することもある。[87]放射線は体のほとんどの部分、すべての動物、あらゆる年齢でがんを引き起こす可能性があるが、放射線誘発固形腫瘍が臨床的に顕在化するまでには通常10~15年かかり、最長40年かかることもあり、放射線誘発白血病が発現するまでには典型的には2~10年かかる。[87]放射線誘発髄膜腫は頭蓋照射のまれな合併症である。[92]母斑性基底細胞がん症候群や網膜芽細胞腫の患者など、一部の人は放射線被曝によって平均よりもがんを発症しやすい。[87]小児および青年は成人に比べて放射線誘発性白血病を発症する可能性が2倍高く、出生前の放射線被曝の影響は10倍である。[87]
電離放射線は、ある種の医用画像診断にも利用されています。先進国では、医用画像診断は、自然放射線とほぼ同量の放射線を公衆に与えています。核医学技術では、放射性医薬品を血流に直接注入します。放射線療法では、病気の治療の一環として、腫瘍とその周囲の組織に意図的に高線量の放射線を照射します。2007年の米国における癌の0.4%は、過去に行われたCT検査によるものと推定されており、同時期のCT検査の利用率によっては、この割合は1.5~2%にまで増加する可能性があります。[93]
住宅内でのラドンガスへの曝露は、受動喫煙と同等のがんリスクがある。[87]原子力発電所の近くに住むなど、低線量被曝は、一般的にがんの発生に全く影響を与えないか、非常に影響が少ないと考えられている。[87]放射線は、ラドンガスへの曝露と喫煙など、他の発がん性物質と組み合わさると、より強力ながん発生源となる。[87]
まれな原因
臓器移植

臓器移植に伴うドナー由来腫瘍の発生は極めて稀です。臓器移植関連腫瘍の主な原因は、臓器摘出時に検出されなかった悪性黒色腫であると考えられます。 [94]また、移植後にウイルスに感染したドナー細胞の腫瘍性増殖によりカポジ肉腫が発生したという報告もあります。[95]
トラウマ
物理的外傷が癌を引き起こすことは比較的まれである。[96]例えば、骨折が骨癌を引き起こしたという主張は、これまで証明されたことがない。[96]同様に、物理的外傷が子宮頸癌、乳癌、脳腫瘍の原因となることは認められていない。[96]認められている原因の一つは、高温の物体を頻繁に長期間身体に当てることである。カンゲルやカイロ(炭火のハンドウォーマー)によるような、身体の同じ部位への繰り返しの火傷は、特に発癌性化学物質が存在する場合、皮膚癌を引き起こす可能性がある。 [96]
熱いお茶を頻繁に飲むと食道がんになりやすい。[96]一般的に、がんは外傷によって直接引き起こされるのではなく、外傷の修復過程で発生するか、既存のがんが促進されると考えられている。[96]しかし、同じ組織が繰り返し損傷を受けると過剰な細胞増殖が促進され、がんの変異の可能性が高まる可能性がある。
母体胎児感染
米国では、毎年約3,500人の妊婦が悪性腫瘍を発症しており、急性白血病、リンパ腫、黒色腫、癌の母体から胎児への胎盤経由感染が観察されている。[97]妊娠やごく少数の臓器提供者による稀な感染を除けば、癌は一般的に伝染性疾患ではない。その主な理由は、 MHC 不適合による組織移植拒絶反応である。[97]ヒトや他の脊椎動物では、MHC抗原は人によって異なるため、免疫系はMHC抗原を用いて「自己」細胞と「非自己」細胞を区別する。非自己抗原に遭遇すると、免疫系は適切な細胞に対して反応する。このような反応は、移植された細胞を排除することで腫瘍細胞の移植を防御すると考えられる。
参照
参考文献
- ^ Basu, Ashis K (2018年3月23日). 「DNA損傷、変異誘発、そしてがん」. Int. J. Mol. Sci. (Review). 19 (4): 970. doi : 10.3390/ijms19040970 . PMC 5979367. PMID 29570697 .
- ^ Ferguson LR、Chen H、Collins AR、Connell M、Damia G、Dasgupta S、他 (2015年12月). 「ヒト癌におけるゲノム不安定性:食事と栄養を通じた治療的攻撃と予防のための分子的洞察と機会」Seminars in Cancer Biology (Review). 35 (Suppl). Elsevier : S5 – S24 . doi :10.1016/j.semcancer.2015.03.005. PMC 4600419. PMID 25869442 .
- ^ abc Roukos DH (2009年4月). 「ゲノムワイド関連研究:個人のがんリスクはどの程度予測可能か?」.抗がん療法専門家レビュー(論説). 9 (4): 389–92 . doi : 10.1586/era.09.12 . PMID 19374592. S2CID 24746283.

- ^ Stewart BW, Wild CP編 (2014). 「がんの病因」.世界がん報告書2014.世界保健機関. pp. 16– 54. ISBN 978-92-832-0429-9。
- ^ がんと環境:知っておくべきこと、できること。国立衛生研究所。2003年3月~2039年。
がんは数年かけて発症し、多くの原因があります。体内外の様々な要因ががんの発生に寄与します。この文脈において、科学者は体外で人間と相互作用するすべてのものを「環境」と呼んでいます。
- ^ Manton KG, Akushevich I, Kravchenko J (2009). 「3 がんリスク要因 §3.2 環境がんリスク要因」 .米国人口におけるがん死亡率と罹患率のパターン:学際的アプローチ. Springer. p. 118. ISBN 978-0-387-78192-1– Open Library経由。
環境
という言葉は、空気、水、土壌だけでなく、食事、喫煙、アルコール、薬物、化学物質への曝露、日光、電離放射線、電磁場、感染性物質など、家庭や職場における物質や状況も指します。ライフスタイル、経済、行動といった要因はすべて、私たちの環境を構成する側面です。
- ^ Doll R , Peto R (1981年6月). 「がんの原因:今日の米国における回避可能ながんリスクの定量的推定」 . Journal of the National Cancer Institute . 66 (6): 1191– 308. doi :10.1093/jnci/66.6.1192. PMID 7017215.
- ^ Whiteman DC, Wilson LF (2016年10月). 「修正可能な要因に起因するがんの割合:グローバルレビュー」 . Cancer Epidemiology (Review). 44 : 203– 221. doi :10.1016/j.canep.2016.06.013. PMID 27460784.
- ^ abcde Anand P, Kunnumakkara AB, Kunnumakara AB, Sundaram C, Harikumar KB, Tharakan ST, Lai OS, Sung B, Aggarwal BB (2008年9月). 「がんは予防可能な疾患であり、生活習慣の大幅な変更が必要である」. Pharmaceutical Research (専門家レビュー). 25 (9): 2097–116 . doi :10.1007/s11095-008-9661-9. PMC 2515569. PMID 18626751 . (正誤表: doi :10.1007/s11095-008-9690-4、PMID18626751 て )
- ^ ab 「第1.1章」。世界がん報告書2014年。世界保健機関。2014年。ISBN 978-92-832-0429-9。
- ^ 「がんファクトシート N°297」世界保健機関2014年2月2014年6月10日閲覧。
- ^ Hodgson S (2008年1月). 「遺伝性癌感受性のメカニズム」.浙江大学科学B誌. 9 (1): 1– 4. doi :10.1631/jzus.B073001. PMC 2170461. PMID 18196605 .
- ^ ab 「第5.5章」。世界がん報告書2014年。世界保健機関。2014年。ISBN 978-92-832-0429-9。
- ^ エイムズ, ブルース・N.; ゴールド, ロイス・スワースキー (2000年1月17日). 「パラケルススから超科学へ:環境による癌の混乱」.突然変異研究/突然変異誘発の基礎的および分子的メカニズム. 447 (1): 3– 13.書誌コード:2000MRFMM.447....3A. doi :10.1016/S0027-5107(99)00194-3. PMID 10686303.
- ^ 「国立労働安全衛生研究所 - 職業性がん」米国国立労働安全衛生研究所. 2007年10月13日閲覧。
- ^ abc 「WHO、健康的な職場環境を通じてがん予防を呼びかける」(プレスリリース)。世界保健機関。2007年4月27日。2007年5月1日時点のオリジナルよりアーカイブ。 2007年10月13日閲覧。
- ^ Irigaray P, Newby JA, Clapp R, Hardell L, Howard V, Montagnier L, Epstein S, Belpomme D (2007年12月). 「がんを引き起こすライフスタイル関連因子と環境因子:概要」. Biomedicine & Pharmacotherapy . 61 (10): 640–58 . doi :10.1016/j.biopha.2007.10.006. PMID 18055160.
- ^ Heikkilä K, Nyberg ST, Theorell T, Fransson EI, Alfredsson L, Bjorner JB, 他 (2013年2月). 「仕事のストレスとがんリスク:欧州の男女11万6000人における5700件のがん発症に関するメタ分析」. BMJ . 346 : f165. doi :10.1136/bmj.f165. PMC 3567204. PMID 23393080 .
- ^ ab Berg, Christine D.; Schiller, Joan H.; Boffetta, Paolo; Cai, Jing; Connolly, Casey; Kerpel-Fronius, Anna; Kitts, Andrea Borondy; Lam, David CL; Mohan, Anant; Myers, Renelle; Suri, Tejas; Tammemagi, Martin C.; Yang, Dawei; Lam, Stephen (2023). 「大気汚染と肺がん:国際肺がん研究協会早期発見・スクリーニング委員会によるレビュー」. Journal of Thoracic Oncology . 18 (10): 1277– 1289. doi : 10.1016/j.jtho.2023.05.024 . ISSN 1556-0864. PMID 37277094.
- ^ Karimi, Behrooz; Samadi, Sadegh (2024). 「大気汚染への長期曝露と心肺機能および肺がん死亡率:系統的レビューとメタアナリシス」. Journal of Environmental Health Science & Engineering . 22 (1): 75– 95. Bibcode :2024JEHSE..22...75K. doi :10.1007/s40201-024-00900-6. ISSN 2052-336X. PMC 11180069. PMID 38887768 .
- ^ ab Turner, Michelle C.; Andersen, Zorana J.; Baccarelli, Andrea; Diver, W. Ryan; Gapstur, Susan M.; Pope, C. Arden; Prada, Diddier; Samet, Jonathan; Thurston, George; Cohen, Aaron (2020). 「屋外大気汚染とがん:最新のエビデンスと公衆衛生に関する推奨事項の概要」. CA: A Cancer Journal for Clinicians . 70 (6): 460– 479. doi :10.3322/caac.21632. ISSN 1542-4863. PMC 7904962. PMID 32964460 .
- ^ Dahman, Lina; Gauthier, Victoria; Camier, Aurore; Bigna, Jean Joel; Glowacki, François; Amouyel, Philippe; Dauchet, Luc; Hamroun, Aghiles (2024). 「大気汚染と腎臓がんリスク:系統的レビューとメタアナリシス」. Journal of Nephrology . 37 (7): 1779– 1790. doi :10.1007/s40620-024-01984-x. ISSN 1724-6059. PMC 11519201. PMID 38913266 .
- ^ 「タバコに起因するがん死亡率」Our World in Data . 2020年3月5日閲覧。
- ^ ab Sasco AJ, Secretan MB, Straif K (2004年8月). 「喫煙とがん:最近の疫学的証拠の簡潔なレビュー」. Lung Cancer . 45 (Suppl 2): S3–9. doi :10.1016/j.lungcan.2004.07.998. PMID 15552776.
- ^ ビエサルスキ HK、ブエノ デ メスキータ B、チェソン A、キティル F、グリンブル R、ヘルムス RJ、ケーレ J、ロタン R、ノーポス K、パストリーノ U、サーナム D (1998)。 「肺がんに関する欧州のコンセンサス声明:危険因子と予防。肺がんパネル」。CA: 臨床医のためのがんジャーナル。48 (3): 167–76、ディスカッション 164–6。土井:10.3322/canjclin.48.3.167。PMID 9594919。S2CID 20891885 。
- ^ ab Kuper H, Boffetta P, Adami HO (2002年9月). 「タバコの使用とがんの発症:腫瘍の種類による関連性」. Journal of Internal Medicine . 252 (3): 206–24 . doi : 10.1046/j.1365-2796.2002.01022.x . PMID 12270001. S2CID 6132726.
- ^ Cunningham FH, Fiebelkorn S, Johnson M, Meredith C (2011年11月). 「曝露マージンアプローチの新たな応用:タバコ煙毒性物質の分離」. Food Chem Toxicol . 49 (11): 2921–33 . doi :10.1016/j.fct.2011.07.019. PMID 21802474.
- ^ Pu X, Kamendulis LM, Klaunig JE (2009年9月). 「雄Sprague-Dawleyラットにおけるアクリロニトリル誘発性酸化ストレスおよび酸化DNA損傷」. Toxicol Sci . 111 (1): 64– 71. doi :10.1093/toxsci/kfp133. PMC 2726299. PMID 19546159 .
- ^ Li L, Jiang L, Geng C, Cao J, Zhong L (2008年4月). 「HepG2細胞におけるアクロレイン誘発DNA損傷における酸化ストレスの役割」. Free Radic Res . 42 (4): 354–61 . doi :10.1080/10715760802008114. PMID 18404534.
- ^ ab Kuper H, Adami HO, Boffetta P (2002年6月). 「タバコの使用、がんの発症、そして公衆衛生への影響」. Journal of Internal Medicine . 251 (6): 455–66 . doi :10.1046/j.1365-2796.2002.00993.x. PMID 12028500. S2CID 9172672.
- ^ Thun MJ, Jemal A (2006年10月). 「米国における癌死亡率の低下のうち、喫煙量の減少がどの程度寄与しているのか?」. Tobacco Control . 15 (5): 345–7 . doi :10.1136/tc.2006.017749. PMC 2563648. PMID 16998161 .
- ^ Dubey S , Powell CA (2008年5月). 「2007年肺がん最新情報」. American Journal of Respiratory and Critical Care Medicine . 177 (9): 941–6 . doi :10.1164/rccm.200801-107UP. PMC 2720127. PMID 18434333.
- ^ Proctor RN (2004年5月). 「世界的な喫煙の流行:歴史と現状報告」. Clinical Lung Cancer . 5 (6): 371–6 . doi :10.3816/CLC.2004.n.016. PMID 15217537.
- ^ Cooke A, Fergeson J, Bulkhi A, Casale TB (2015). 「電子タバコ:良い点、悪い点、そして厄介な点」. The Journal of Allergy and Clinical Immunology. In Practice . 3 (4): 498– 505. doi :10.1016/j.jaip.2015.05.022. PMID 26164573.
- ^ Ebbert, Jon O.; Agunwamba, Amenah A.; Rutten, Lila J. (2015年1月). 「電子タバコ使用に関する患者へのカウンセリング」. Mayo Clinic Proceedings . 90 (1): 128– 134. doi : 10.1016/j.mayocp.2014.11.004 . PMID 25572196.
- ^ abcde Maltoni CF, Holland JF (2000). 「16. 物理的発がん物質」. Holland-Frei Cancer Medicine . BC Decker. NBK20770.
- ^ ロビンズ基礎病理学(第8版). フィラデルフィア, PA: Saunders/Elsevier. 2007. 表6–2. ISBN 978-1-4160-2973-1. OCLC 69672074。
- ^ abc Kushi LH, Byers T, Doyle C, Bandera EV, McCullough M, McTiernan A, Gansler T, Andrews KS, Thun MJ (2006). 「米国癌協会による癌予防のための栄養と身体活動に関するガイドライン:健康的な食事と身体活動による癌リスクの低減」. CA: A Cancer Journal for Clinicians . 56 (5): 254–81 , quiz 313–4. doi : 10.3322/canjclin.56.5.254 . PMID 17005596. S2CID 19823935.
- ^ Kushi LH, Doyle C, McCullough M, Rock CL, Demark-Wahnefried W, Bandera EV, Gapstur S, Patel AV, Andrews K, Gansler T (2012年1月). 「米国癌協会による癌予防のための栄養と身体活動に関するガイドライン:健康的な食事と身体活動による癌リスクの低減」. CA: A Cancer Journal for Clinicians . 62 (1): 30– 67. doi : 10.3322/caac.20140 . PMID 22237782. S2CID 2067308.
- ^ Wicki A, Hagmann J (2011). 「食事とがん」. Swiss Medical Weekly . 141 (3536): w13250. doi : 10.4414/smw.2011.13250 . PMID 21904992.
- ^ 「IARC:IARC、発がん性を示す個人習慣と家庭内曝露に関する調査結果を強化」(PDF)国際がん研究機関 - 世界保健機関2009年。
- ^ Schütze M, Boeing H, Pischon T, Rehm J, Kehoe T, Gmel G, 他 (2011年4月). 「前向きコホート研究に基づくヨーロッパ8カ国におけるアルコール起因がん発症率の負担」. BMJ . 342 d1584. doi :10.1136/bmj.d1584. PMC 3072472. PMID 21474525 .
- ^ Boffetta (2006年8月). 「アルコール摂取に起因するがんの負担」. International Journal of Cancer . 119 (4): 884–7 . doi :10.1002/ijc.21903. hdl : 2434/22728 . PMID 16557583. S2CID 14938863.
- ^ 「アルコール摂取とがんリスク」pubs.niaaa.nih.gov . 2018年2月21日時点のオリジナルよりアーカイブ。 2018年3月22日閲覧。
- ^ Theruvathu JA, Jaruga P, Nath RG, Dizdaroglu M, Brooks PJ (2005). 「ポリアミンはアセトアルデヒドからの変異原性1,N2-プロパノデオキシグアノシン付加物の形成を促進する」. Nucleic Acids Research . 33 (11): 3513–20 . doi :10.1093/nar/gki661. PMC 1156964. PMID 15972793 .
- ^ ab Hodskinson MR, Bolner A, Sato K, Kamimae-Lanning AN, Rooijers K, Witte M, Mahesh M, Silhan J, Petek M, Williams DM, Kind J, Chin JW, Patel KJ, Knipscheer P (2020年3月). 「アルコール由来のDNAクロスリンクは2つの異なるメカニズムによって修復される」. Nature . 579 (7800): 603– 608. Bibcode :2020Natur.579..603H. doi :10.1038/s41586-020-2059-5. PMC 7116288. PMID 32132710 .
- ^ Poschl G (2004年5月). 「アルコールとがん」.アルコールとアルコール依存症. 39 (3): 155–165 . doi : 10.1093/alcalc/agh057 . PMID 15082451.
- ^ スチュワート・B (2014).世界がん報告書2014.世界保健機関. pp. 124–33 . ISBN 978-92-832-0429-9。
- ^ Ferguson LR (2010年2月). 「肉とがん」. Meat Science . 84 (2): 308– 313. doi :10.1016/j.meatsci.2009.06.032. PMID 20374790.
- ^ 「大腸がん2011年報告書:食事、栄養、身体活動、大腸がんの予防」(PDF)世界がん研究基金・米国がん研究所( 2011年)。 2019年5月22日時点のオリジナル(PDF)からアーカイブ。2018年3月22日閲覧。
- ^ Park S, Bae J, Nam BH, Yoo KY (2008). 「アジアにおける癌の病因」. Asian Pacific Journal of Cancer Prevention . 9 (3): 371– 80. PMID 18990005. 2011年9月4日時点 のオリジナル(PDF)からアーカイブ。 2014年7月17日閲覧。
- ^ Brenner H, Rothenbacher D, Arndt V (2009). 「胃がんの疫学」.がん疫学. 分子生物学の方法. 第472巻. pp. 467–77 . doi :10.1007/978-1-60327-492-0_23. ISBN 978-1-60327-491-3. PMC 2166976 . PMID 19107449 .
- ^ Buell P, Dunn JE (1965年5月). 「カリフォルニア州在住の日本人一世・二世における癌死亡率」. Cancer . 18 (5): 656–64 . doi :10.1002/1097-0142(196505)18:5<656::AID-CNCR2820180515>3.0.CO;2-3. PMID 14278899. S2CID 39881987.
- ^ Parkin, DM; Khlat, M. (1996年5月). 「移民におけるがん研究:根拠と方法論」. European Journal of Cancer . 32A (5): 761– 771. doi :10.1016/0959-8049(96)00062-7. PMID 9081351.
- ^ Prasad AR, Prasad S, Nguyen H, Facista A, Lewis C, Zaitlin B, Bernstein H, Bernstein C (2014年7月). 「新規食事関連マウス大腸がんモデルはヒト大腸がんと類似」. World J Gastrointest Oncol . 6 (7): 225–43 . doi : 10.4251/wjgo.v6.i7.225 . PMC 4092339. PMID 25024814 .
- ^ Bernstein C, Holubec H, Bhattacharyya AK, Nguyen H, Payne CM, Zaitlin B, Bernstein H (2011年8月). 「二次胆汁酸であるデオキシコール酸の発がん性」. Archives of Toxicology . 85 (8): 863–71 . Bibcode :2011ArTox..85..863B. doi :10.1007/s00204-011-0648-7. PMC 3149672. PMID 21267546 .
- ^ Loftfield E, Falk RT, Sampson JN, Huang WY, Hullings A, Murphy G, Weinstein SJ, Albanes D, Freedman ND, Sinha R (2022年5月). 「循環胆汁酸および短鎖脂肪酸と大腸がん発症との将来的な関連性」. JNCI Cancer Spectr . 6 (3) pkac027. doi :10.1093/jncics/pkac027. PMC 9115675. PMID 35583137 .
- ^ ab Seyfried, Thomas N. (2012).代謝性疾患としての癌:癌の起源、管理、予防について. ホーボーケン、ニュージャージー州: Wiley. ISBN 978-0-470-58492-7。
- ^ Tufail, Muhammad; Jiang, Can-Hua; Li, Ning (2024年9月). 「がんにおける代謝の変化:エネルギー経路と治療標的への洞察」. Molecular Cancer . 23 (1): 203. doi : 10.1186/s12943-024-02119-3 . PMC 11409553. PMID 39294640 .
- ^ Warburg, O (1956年2月24日). 「がん細胞の起源について」. Science . 123 (3191): 309– 314. Bibcode :1956Sci...123..309W. doi :10.1126/science.123.3191.309. PMID 13298683.
- ^ Vander Heiden, MG; Cantley, LC; Thompson, CB (2009年5月22日). 「ワールブルク効果の理解:細胞増殖の代謝要件」. Science . 324 ( 5930): 1029–33 . Bibcode :2009Sci...324.1029V. doi :10.1126/science.11 60809. PMC 2849637. PMID 19460998.
- ^ ab Seyfried, TN; Flores, RE; Poff, AM; D'Agostino, DP (2014年3月). 「代謝性疾患としての癌:新規治療法への示唆」. Carcinogenesis . 35 (3): 515–27 . doi :10.1093/carcin/bgt480. PMC 3941741. PMID 24343361 .
- ^ DeBerardinis, RJ; Cheng, T (2010年1月21日). 「Q's next: 代謝、細胞生物学、そしてがんにおけるグルタミンの多様な機能」. Oncogene . 29 (3): 313–24 . doi :10.1038/onc.2009.358. PMC 2809806. PMID 19881548 .
- ^ Altman, BJ; Stine, ZE; Dang, CV (2016年10月). 「クレブスから臨床へ:グルタミン代謝からがん治療へ」. Nature Reviews. Cancer . 16 (10): 619–34 . doi :10.1038/nrc.2016.71. PMC 5484415. PMID 27492215 .
- ^ ab Weber, DD; Aminzadeh-Gohari, S; Tulipan, J; Catalano, L; Feichtinger, RG; Kofler, B (2020年3月). 「がん治療におけるケトジェニックダイエット ― 現状は?」. Molecular Metabolism . 33 : 102– 121. doi :10.1016/j.molmet.2019.06.026. PMC 7056920. PMID 31399389 .
- ^ Pavlova, NN; Thompson, CB (2016年1月12日). 「がん代謝の新たな特徴」. Cell Metabolism . 23 (1): 27– 47. doi :10.1016/j.cmet.2015.12.006. PMC 4715268. PMID 26771115 .
- ^ abcdef Basen-Engquist K, Chang M (2011年2月). 「肥満とがんリスク:最近のレビューとエビデンス」Current Oncology Reports . 13 (1): 71–6 . doi :10.1007/s11912-010-0139-7. PMC 3786180 . PMID 21080117.
- ^ Alzahrani B, Iseli TJ, Hebbard LW (2014年4月). 「非ウイルス性肝癌の原因:肥満に伴う炎症は関与しているか?」Cancer Letters . 345 (2): 223–9 . doi :10.1016/j.canlet.2013.08.036. PMID 24007864.
- ^ Gilbert CA, Slingerland JM (2013年1月14日). 「サイトカイン、肥満、そしてがん:肥満とがんリスクおよび進行を結びつけるメカニズムに関する新たな知見」Annual Review of Medicine . 64 (1): 45– 57. doi :10.1146/annurev-med-121211-091527. PMID 23121183.
- ^ Kompella P, Vasquez KM (2019年9月). 「肥満とがん:遺伝的不安定性に影響を与える肥満における代謝変化のメカニズム概観」Mol Carcinog . 58 (9): 1531– 1550. doi :10.1002/mc.23048. PMC 6692207 . PMID 31168912.
- ^ abcdefghij Henderson BE, Bernstein L, Ross RK (2000). 「13. ホルモンと癌の病因」. Bast RC, Kufe DW, Pollock RE (編). Holland-Frei Cancer Medicine (第5版). BC Decker. ISBN 978-1-55009-113-7。
- ^ Rowlands MA, Gunnell D, Harris R, Vatten LJ, Holly JM, Martin RM (2009年5月). 「循環インスリン様成長因子ペプチドと前立腺がんリスク:系統的レビューとメタアナリシス」. International Journal of Cancer . 124 (10): 2416–29 . doi :10.1002/ijc.24202. PMC 2743036. PMID 19142965 .
- ^ De Martel, Catherine; Ferlay, Jacques; Franceschi, Silvia; Vignat, Jérôme; Bray, Freddie; Forman, David; Plummer, Martyn (2012年6月1日). 「2008年の感染症に起因する世界のがん負担:レビューと総合分析」. The Lancet Oncology . 13 (6): 607– 615. doi :10.1016/S1470-2045(12)70137-7. PMID 22575588.
- ^ De Paoli P, Carbone A (2013年10月). 「因果関係の十分な証拠がない発がん性ウイルスと固形がん」. International Journal of Cancer . 133 (7): 1517–29 . doi : 10.1002/ijc.27995 . PMID 23280523. S2CID 38402898.
- ^ Anand P, Kunnumakkara AB, Kunnumakara AB, Sundaram C, Harikumar KB, Tharakan ST, Lai OS, Sung B, Aggarwal BB (2008年9月). 「がんは予防可能な疾患であり、生活習慣の大幅な変更が必要である」. Pharmaceutical Research . 25 (9): 2097–116 . doi :10.1007/s11095-008-9661-9. PMC 2515569. PMID 18626751 . (正誤表: doi :10.1007/s11095-008-9690-4、PMID18626751 て )
- ^ 「ヒトパピローマウイルス(HPV)とがん」CDC、2018年1月2日。 2018年3月22日閲覧。
- ^ Münger K, Baldwin A, Edwards KM, Hayakawa H, Nguyen CL, Owens M, Grace M, Huh K (2004年11月). 「ヒトパピローマウイルス誘発性腫瘍形成のメカニズム」. Journal of Virology . 78 (21): 11451–60 . doi :10.1128/JVI.78.21.11451-11460.2004. PMC 523272. PMID 15479788 .
- ^ ab Sung, Max W.; Thung, Swan N.; Acs, George (2000). 「21. 肝炎ウイルス」. Holland-Frei Cancer Medicine . BC Decker. NBK20828.
- ^ Pagano JS, Blaser M , Buendia MA, Damania B, Khalili K, Raab-Traub N, Roizman B (2004年12月). 「感染性因子と癌:因果関係の基準」. Seminars in Cancer Biology . 14 (6): 453–71 . doi :10.1016/j.semcancer.2004.06.009. PMID 15489139.
- ^ 畠山正則 (2005年12月9日)。 「ヘリコバクター ピロリ CagA: 細菌発癌の新しいパラダイム」。がん科学。96 (12): 835–843 .土井: 10.1111/j.1349-7006.2005.00130.x。PMC 11159386。PMID 16367902。
- ^ Samaras V, Rafailidis PI, Mourtzoukou EG, Peppas G, Falagas ME (2010年6月). 「慢性細菌・寄生虫感染症と癌:レビュー」(PDF) . Journal of Infection in Developing Countries . 4 (5): 267–81 . doi : 10.3855/jidc.819 . PMID 20539059.
- ^ Mustacchi, Piero (2000). 「22. 寄生虫」. Holland-Frei Cancer Medicine . BC Decker. NBK20917.
- ^ Pallis AG, Syrigos KN (2013年12月). 「非喫煙者における肺がん:疾患特性と危険因子」. Critical Reviews in Oncology/Hematology . 88 (3): 494– 503. doi :10.1016/j.critrevonc.2013.06.011. PMID 23921082.
- ^ Taniguchi K, Karin M (2014年2月). 「炎症と癌の重要なリンチピンとしてのIL-6および関連サイトカイン」Seminars in Immunology . 26 (1): 54– 74. doi :10.1016/j.smim.2014.01.001. PMID 24552665.
- ^ Colotta F, Allavena P, Sica A, Garlanda C, Mantovani A (2009年7月). 「がん関連炎症、がんの7番目の特徴:遺伝的不安定性との関連」. Carcinogenesis . 30 (7): 1073–81 . doi :10.1093/carcin/bgp127. PMID 19468060.
- ^ Mantovani A (2010年6月). 「炎症と癌を結びつける分子経路」. Current Molecular Medicine . 10 (4): 369–73 . doi :10.2174/156652410791316968. PMID 20455855.
- ^ abcdefghijkl Little JB (2000). 「第14章 電離放射線」. Kufe DW, Pollock RE, Weichselbaum RR, Bast RC, Gansler TS, Holland JF, Frei E (編). 『癌医学』(第6版). ハミルトン、オンタリオ州: BC Decker. ISBN 978-1-55009-113-7。
- ^ 「IARC、無線周波電磁界をヒトに対して発がん性の可能性があると分類」(PDF)。世界保健機関。
- ^ “IARC Monographs- Classifications”. monographs.iarc.fr . 2017年6月10日時点のオリジナルよりアーカイブ。2018年3月13日閲覧。
- ^ 「携帯電話とがんリスク - 国立がん研究所」Cancer.gov、2013年5月8日。 2013年12月15日閲覧。
- ^ ab Cleaver JE, Mitchell DL (2000). 「15. 紫外線による発がん」Holland-Frei Cancer Medicine . BC Decker. NBK20854.
- ^ 山中 亮、早野 明、金山 剛志(2017年1月). 「放射線誘発性髄膜腫:文献の徹底レビュー」. World Neurosurgery . 97 : 635–644.e8. doi :10.1016/j.wneu.2016.09.094. PMID 27713063.
- ^ Brenner DJ, Hall EJ (2007年11月). 「コンピュータ断層撮影—増加する放射線被曝源」 . The New England Journal of Medicine . 357 (22): 2277–84 . doi :10.1056/NEJMra072149. PMID 18046031. S2CID 2760372.
- ^ Dingli D, Nowak MA (2006年9月). 「がん生物学:感染性腫瘍細胞」. Nature 443 (7107): 35–6 . Bibcode :2006Natur.443...35D. doi :10.1038 / 443035a. PMC 2711443. PMID 16957717 .
- ^ バロッツィ P、ルッピ M、ファッケッティ F、メクッチ C、アル M、サリド R、ラシーニ V、ラヴァッツィーニ L、ロッシ E、フェスタ S、クレッシェンツィ B、ヴォルフ DG、シュルツ TF、トレッリ G (2003 年 5 月)。 「移植後のカポジ肉腫は、ドナー由来の前駆細胞の播種に由来します。」自然医学。9 (5): 554–61 .土井:10.1038/nm862。hdl : 11380/306172。PMID 12692543。S2CID 2527251 。
- ^ abcdef Gaeta JF (2000). 「17. 外傷と炎症」. Holland-Frei Cancer Medicine . BC Decker. NBK20784.
- ^ ab Tolar J, Neglia JP (2003年6月). 「胎盤経由およびその他の経路による癌の個人間伝播」. Journal of Pediatric Hematology/Oncology . 25 (6): 430–4 . doi :10.1097/00043426-200306000-00002. PMID 12794519.
