クロム水素化物は、クロムと水素、そして場合によっては他の元素からなる化合物です。化学量論量に近い量の水素を含む金属間化合物や、反応性の高い分子も存在します。低濃度で存在する場合、水素やクロムと合金化した他の特定の元素は軟化剤として作用し、クロム原子の結晶格子内で通常は発生しない転位の移動を可能にします。
典型的なクロム水素化物合金中の水素は、室温では重量比でわずか数百ppm(百万分の一)しか含まれません。水素やその他の合金元素の量、そしてそれらのクロム水素化物中における溶質元素または析出相としての形状を変えることで、クロム中の転位運動が促進され、結果として得られるクロム水素化物の硬度、延性、引張強度などの特性を制御できます。
材料特性
水素化クロムを構成する狭い濃度範囲においても、水素とクロムの混合物は様々な構造を形成し、非常に異なる特性を示します。こうした特性を理解することは、高品質の水素化クロムを製造する上で不可欠です。室温では、純粋なクロムの最も安定した形態は、体心立方(BCC)構造のα-クロムです。α-クロムは非常に硬い金属であり、微量の水素しか溶解しません。
鈍い茶色または暗灰色の固体で、2つの異なる結晶形態をとることがあります。1つは面心立方晶系(化学式CrH ~2)で、もう1つは最密六方晶系(化学式CrH ~1)です。クロム水素化物はクロムめっきにおいて重要な元素であり、クロムめっきの形成における中間体として使用されます。
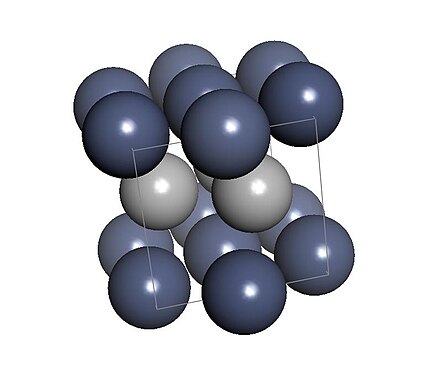

オラードとブラッドリーは、X線結晶構造解析によって、六方晶系におけるクロムの異種同素体について調査したが、水素が含まれていることに気づかなかった。[1]彼らが発見した 六方最密結晶には、実際にはCrH x(xは0.5~1)が含まれていた。[2] 六方晶系の格子の単位格子寸法は、a=0.271 nm、c=0.441 nmであった。[3]この結晶は反NiAs構造 として説明され、β相として知られている。 [4 ] ε-CrHとしても知られ、空間群はFm 3 mで、水素は八面体サイトにのみ存在する。[5]
クロムを電着すると、面心立方(fcc) 相の水素化クロムも生成されます。Cloyd A. Snavely は、約 5 °C に冷却した砂糖シロップ内のクロム酸塩と、1290 アンペア/平方メートルの電流密度を使用しました。材料の単位格子寸法は 0.386 nm でした。この材料は脆く、熱で簡単に分解します。組成は CrH xで、x は 1 ~ 2 です。[2] 1800 アンペア/平方メートルを超える電流密度で低温の場合、六方最密充填形態が生成されましたが、電流が低いか温度が高い場合は、通常の体心立方クロム金属が析出しました。[6] 面心立方クロム水素化物の形成を促進する条件は、高 pH です。[3] CrHのfcc構造はP6 3 /mmc空間群の八面体サイトに水素原子を持つ。[5]

面心立方晶系CrHの組成はCrH 1.7である。[3]しかし、理論的には、物質が純粋で、すべての四面体サイトが水素原子で占められている場合、 CrH 2 となる。固体物質であるCrH 2は、鈍い灰色または茶色を呈する。表面は傷つきやすいが、これは水素化物の脆さによるものである。[3]
面心立方クロム水素化物は、クロム金属を塩酸でエッチングすると一時的に形成される。[7]
六方晶系は室温で40日で通常のクロムに自然に変化するのに対し、もう一方の形態(面心立方晶系)は230日で体心立方晶系クロムに変化する。オラードは既にこの変化の際に水素が発生することに気づいていたが、電着クロムには通常水素が含まれているため、水素が物質の必須成分であるかどうかは確信が持てなかった。コリン・G・フィンクは、六方晶系を炎で加熱すると水素が急速に燃え尽きることを観察した。[6]
クロム酸塩溶液からクロム金属を電気めっきすると、水素化クロムが生成されます。温度が十分に高ければ、水素化クロムは生成と同時に急速に分解し、微結晶の体心立方クロムを生成します。したがって、水素化物が十分に迅速かつスムーズに分解されるようにするには、クロムめっきを適切な高温(条件によって異なりますが、およそ60℃から75℃)で行わなければなりません。水素化物が分解すると、めっき表面にひび割れが生じます。ひび割れは制御可能であり、1ミリメートルあたり最大40個のひび割れが生じる可能性があります。めっき表面の物質(主に三二酸化クロム)は、ひび割れが生じるとそこに吸収されます。ひび割れは治癒し、新しいめっき層は異なるひび割れを呈します。顕微鏡で観察すると、電気メッキされたクロムは120°と60°の角度の結晶のように見えますが、これらは元の水素化物結晶の影であり、最終的にコーティングに形成される実際の結晶ははるかに小さく、体心立方クロムで構成されています。[3]
超六方晶系[と定義されるか? ]クロム水素化物も、高圧高温下でクロム膜を水素にさらすことによって生成される。[8]
1926年、T.ヴァイクセルフェルダーとB.ティーデは、エーテル中で水素と塩化クロムおよび臭化フェニルマグネシウムを反応させて黒色の沈殿物を形成し、固体の三水素化クロムを調製したと主張した。[9] [10]
固体六方晶系CrHは空気中で青みがかった炎を上げて燃焼する。燃えているマッチで着火する。[11]
関連合金
クロム水素化物の水素含有量は、通常のクロム水素合金の場合、重量比で0~数百ppmの範囲です。これらの値は、鉄、マンガン、バナジウム、チタン[12]などの合金元素によって異なります。
数百ppmをはるかに超える水素含有量を持つ合金を形成することは可能ですが、安定させるには極めて高い圧力が必要です。このような条件下では、水素含有量は合金の最大0.96%を占め、その時点で線状化合物相境界と呼ばれる状態に達します。水素含有量が線状化合物相境界を超えると、クロム-水素系は合金としての挙動を停止し、代わりに一連の非金属化学量論的化合物を形成します。これらの化合物は、それぞれが安定させるためにさらに高い圧力を必要とします。最初に発見されたこのような化合物は、水素化二クロム(Cr
2H)、ここでクロムと水素の比は1/0.5で、水素含有量は0.96%に相当する。これらの化合物のうち2つは常圧で準安定であり、瞬時に分解するのではなく、長時間かけて分解する。もう1つの化合物は水素化クロム(I)で、これは数倍安定している。これらの化合物はどちらも極低温でも安定しており、無期限に残存する。ただし、正確な詳細は不明である。[13] -
所望の特性を持つ水素化クロム合金を製造するために、クロム/水素混合物に他の材料が添加されることがよくあります。水素化クロム中のチタンは、クロム水素溶液のβ-クロム形態をより安定させます。[要出典]
参考文献
- ^ Bradley, AJ; EF Ollard (1926). 「クロムの同素体」. Nature . 117 (2934): 122. Bibcode :1926Natur.117..122B. doi : 10.1038/117122b0 . ISSN 0028-0836. S2CID 4131298.
- ^ Poźniak-Fabrowska, J; B Nowak; M Tkacz (2001). 「立方晶系および六方晶系クロム水素化物の磁気特性:53Cr NMRナイトシフトによる磁化率の比較」. Journal of Alloys and Compounds . 322 ( 1– 2): 82– 88. doi :10.1016/S0925-8388(01)01266-X. ISSN 0925-8388.
- ^ ab アントノフ、VE; AIベスクロヴヌイ、VKフェドトフ、ASイワノフ、SSハサノフ、AIコレスニコフ、MKサハロフ、ILサシン、M.トカチ(2007年)。 「水素化クロムの結晶構造と格子動力学」。合金と化合物のジャーナル。430 ( 1–2 ): 22–28 .土井:10.1016/j.jallcom.2006.05.021。ISSN 0925-8388。
{{cite journal}}: CS1 maint: 複数の名前: 著者リスト (リンク) - ^ 佐々木熊蔵、関戸信吉(1931年2月24日)「電解クロムの3つの結晶構造」電気化学会誌59 (1): 437–444 . doi :10.1149 / 1.3497824.全文が閲覧可能
- ^ Smith, WH (1956). 「酸エッチングによる脆性クロムの破壊」. Journal of the Electrochemical Society . 103 (1): 51. doi :10.1149/1.2430232. ISSN 0013-4651.
- ^ Pan, Y; M Takeo; J Dash (1993). 「弾道圧縮機内での高温高圧水素へのクロム薄膜曝露による超六方晶クロム水素化物の形成」. International Journal of Hydrogen Energy . 18 (6): 491– 504. Bibcode :1993IJHE...18..491P. doi :10.1016/0360-3199(93)90006-V. ISSN 0360-3199.
- ^ メラー、ジョセフ・ウィリアム (1948). 「クロムの化学的性質」.無機化学および理論化学に関する包括的論文集. 第11巻. ロングマンズ・グリーン・アンド・カンパニー. p. 160.
- ^ ヴァイヒゼルフェルダー、テオドール;ブルーノ・ティーデ (1926)。 「ニッケル、コバルト、アイゼン、クロムの金属の水素化物を除去する」。ユストゥス・リービッヒの化学アナレン。447 (1): 64–77。土井:10.1002/jlac.19264470107。
- ^ Raub, Christoph J. (1993年9月). 「電気めっきにおける水素:決定的に重要であるにもかかわらず、あまり注目されていない」(PDF) .めっきと表面仕上げ: 35.
- ^ジョンソン, ジョン・R.; ライリー, ジェームズ・J. (1978年11月). 「チタンクロム(TiCr 2)の低温型(C15)と水素の反応」.無機化学. 17 (11): 3103– 3108. doi :10.1021/ic50189a027.
さらに読む
- Wolf, G. (1971). 「クロム水素化物CrHxの11~300 Kにおける比熱」. Physica Status Solidi A. 5 ( 3): 627– 632. Bibcode :1971PSSAR...5..627W. doi :10.1002/pssa.2210050312. ISSN 0031-8965.
- Khan, HR; Ch.J Raub (1976). 「クロム水素化物の特性」. Journal of the Less Common Metals . 49 : 399– 406. doi :10.1016/0022-5088(76)90051-5. ISSN 0022-5088.
- Kerle, Bettina; Mathias Opper; Sigrid Volk (2000年9月6日). 「六価クロムプロセス」(PDF) . SurTec GmbH. 2009年1月8日時点のオリジナル(PDF)からアーカイブ。 2012年8月1日閲覧。
- Stock, Allen D.; Kenneth I. Hardcastle (1970). 「クロム水素化物の相および組成分析」. Journal of Inorganic and Nuclear Chemistry . 32 (4): 1183– 1186. doi :10.1016/0022-1902(70)80113-0. hdl : 10211.2/3846 . ISSN 0022-1902.
- Khan, HR; A. Knödler, Ch.J. Raub, AC Lawson (1974). 「クロム水素化物の電気的および磁気的特性」. Materials Research Bulletin . 9 (9): 1191– 1197. doi :10.1016/0025-5408(74)90037-3. ISSN 0025-5408.
{{cite journal}}: CS1 maint: 複数の名前: 著者リスト (リンク) - Venkatraman, M; JP Neumann (1991). 「Cr-H(クロム-水素)系」. Journal of Phase Equilibria . 12 (6): 672– 677. doi :10.1007/BF02645169. ISSN 1054-9714. S2CID 97887064.