| ネフロン | |
|---|---|
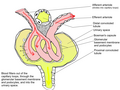
 長い傍髄質ネフロン(左)と短い皮質ネフロン(右)の図。左ネフロンには6つのネフロン節がそれぞれ名前で示されています。集合管はネフロンの最後の部分です。 | |
| 詳細 | |
| 前駆 | 後腎芽(中間中胚葉) |
| システム | 尿路系 |
| 識別子 | |
| メッシュ | D009399 |
| FMA | 17640 |
| 解剖学用語 | |
ネフロンは、腎臓の微細な構造的および機能的な単位で、腎小体と腎尿細管で構成されています。腎小体は、糸球体と呼ばれる毛細血管の房と、ボーマン嚢と呼ばれるカップ状の構造で構成されています。腎尿細管は腎嚢から伸びています。腎嚢と尿細管はつながっており、内腔を持つ上皮細胞で構成されています。健康な成人の腎臓には、100万~150万個のネフロンがあります。[ 1 ]:22 血液は、毛細血管壁の内皮細胞、基底膜、および腎嚢の内層にある足細胞足突起の間の3つの層を通過する際に濾過されます。尿細管には、尿細管の下行部と上行部の間を走る隣接する尿細管周囲毛細血管があります。 [ 2 ]莢膜から尿細管へと流れ落ちる液体は、尿細管の内層を覆う上皮細胞によって処理されます。まず尿細管の外側にある間質液と水分が再吸収され、物質が交換されます(一部は追加され、一部は除去されます)。そして、隣接する尿細管周囲の毛細血管の内層を覆う内皮細胞を通って血漿へと物質が交換されます。このプロセスによって体液量と多くの体内物質のレベルが調節されます。尿細管の末端からは、残りの体液(尿)が排出されます。尿は水、代謝老廃物、そして毒素で構成されています。
The interior of Bowman's capsule, called Bowman's space, collects the filtrate from the filtering capillaries of the glomerular tuft , which also contains mesangial cells supporting these capillaries. These components function as the filtration unit and make up the renal corpuscle . The filtering structure (glomerular filtration barrier) has three layers composed of endothelial cells , a basement membrane , and podocyte foot processes. The tubule has five anatomically and functionally different parts: the proximal tubule , which has a convoluted section called the proximal convoluted tubule followed by a straight section (proximal straight tubule); the loop of Henle , which has two parts, the descending loop of Henle ("descending loop") and the ascending loop of Henle ("ascending loop"); the distal convoluted tubule ("distal loop"); ネフロンには、尿細管と結合する尿細管、そして集合管と呼ばれるネフロンの最後の部分があります。ネフロンには、尿を濃縮する能力が異なる2つの長さ、すなわち長い髄質傍ネフロンと短い皮質ネフロンがあります。
濾液の生成と処理(結果として血液を尿に変換する)に使用される 4 つのメカニズムは、濾過、再吸収、分泌および排泄です。濾過または限外濾過は糸球体で発生し、大部分は受動的で、毛細血管内圧に依存します。血液が糸球体毛細血管を通過する際に、血漿の約 5 分の 1 が濾過され、5 分の 4 が尿細管周囲毛細血管に進みます。通常、ボーマン嚢に濾過されない血液成分は、血液タンパク質、赤血球、白血球、および血小板のみです。成人の糸球体には毎日 150 リットルを超える体液が入ります。濾液中の水分の 99% が再吸収されます。再吸収は腎尿細管で発生し、拡散による受動的、または濃度勾配に逆らうポンプによる能動的のいずれかです。分泌も尿細管と集合管で発生し、能動的です。再吸収される物質には、水、塩化ナトリウム、ブドウ糖、アミノ酸、乳酸塩、マグネシウム、リン酸カルシウム、尿酸、重炭酸塩などがあります。分泌される物質には、尿素、クレアチニン、カリウム、水素、尿酸などがあります。尿細管に再吸収または分泌速度を変えるように信号を送り、それによって恒常性を維持するホルモンには、(影響を受ける物質とともに)抗利尿ホルモン(水)、アルドステロン(ナトリウム、カリウム)、副甲状腺ホルモン(カルシウム、リン酸)、心房性ナトリウム利尿ペプチド(ナトリウム)、脳性ナトリウム利尿ペプチド(ナトリウム)などがあります。腎髄質の向流システムは、高張性間質を生成するメカニズムを提供し、これによりネフロン内から溶質を含まない水を回収し、適切な場合に静脈血管系に戻すことができます。
ネフロンの疾患の中には、主に糸球体または尿細管のいずれかに影響を及ぼすものがあります。糸球体疾患には、糖尿病性腎症、糸球体腎炎、IgA腎症などがあり、尿細管疾患には、急性尿細管壊死や多発性嚢胞腎などがあります。
構造
[編集]
ネフロンは腎臓の機能単位です。[ 3 ] これは、個々のネフロンが腎臓の主な働きを行う場所であることを意味します。
ネフロンは以下からできています。
腎小体
[編集]
.糸球体基底膜:1. 内層軟膜 2. 緻密層 3. 外層軟膜
C. 足細胞:1. 酵素タンパク質および構造タンパク質 2. 濾過スリット 3. 横隔膜
腎小体は血漿の濾過を行う部位である。腎小体は糸球体と糸球体被膜(ボーマン嚢とも呼ばれる)から構成される。[ 4 ] : 1027
腎小体には血管極と尿細管極という二つの極があります。[ 5 ]:397 腎循環からの細動脈は血管極で糸球体に出入りします。糸球体濾液はボーマン嚢から尿細管を経て尿極へと排出されます。
糸球体
[編集]糸球体は、ボーマン嚢内の腎小体の血管極に位置する、房状濾過毛細血管のネットワークです。各糸球体は、腎循環の輸入細動脈から血液供給を受けます。糸球体の血圧は、水と溶質を血漿から濾過し、ボーマン嚢の内部(ボーマン腔)へと送り込む駆動力となります。
糸球体では血漿の約5分の1のみが濾過されます。残りは輸出細動脈へと流れ込みます。輸出細動脈の直径は輸入細動脈の直径よりも小さく、この差によって糸球体内の静水圧が上昇します。
ボーマン嚢
[編集]ボーマン嚢は糸球体嚢とも呼ばれ、糸球体を取り囲んでいます。ボーマン嚢は、有足細胞と呼ばれる特殊な細胞で形成された内臓側の内層と、単純扁平上皮からなる壁側の外層で構成されています。糸球体内の血液は、複数の層で限外濾過され、濾液と呼ばれる物質が生成されます。
濾液はその後、尿細管へと移動し、そこでさらに処理されて尿となります。この液体の様々な段階は、総称して尿細管液と呼ばれます。
腎尿細管
[編集]尿細管は、糸球体で濾過された管状の液体を含む、連続した長いパイプ状の構造です。 [ 6 ]尿細管を通過した濾液は最終的に集合管系で終わります。[ 7 ]
尿細管の構成要素は次のとおりです。
- 近位尿細管: 皮質にあり、吸収のための表面積を大幅に増やす「刷子縁を持つ単純立方上皮」で裏打ちされています。
- ヘンレループ:髄質にあり、U字型(ヘアピンに似ている)
- ヘンレ係蹄下行脚:等厚の1つの部分
- ヘンレ係蹄上行脚:厚さが異なる 2 つの部分(単純扁平上皮で裏打ちされた近位部分は薄いヘンレ係蹄上行脚と呼ばれ、単純立方上皮で裏打ちされた遠位部分は厚いヘンレ係蹄上行脚と呼ばれる)。
- 遠位尿細管:皮質に位置する
- 集合管
これらのネフロンセグメントを形成する上皮細胞は、蛍光ファロイジンの共焦点顕微鏡によって可視化されたアクチン細胞骨格の形状によって区別することができる。[ 8 ]
糸球体で濾過されなかった物質を含む輸出細動脈からの血液は、ヘンレ係蹄と近位尿細管および遠位尿細管を取り囲む細い血管である尿細管周囲毛細血管へと流れ込み、そこで尿細管液が流れます。その後、遠位尿細管から物質が再吸収され、血流に戻ります。
その後、尿細管周囲毛細血管は再結合して輸出細静脈を形成し、輸出細静脈は他のネフロンからの輸出細静脈と結合して腎静脈に入り、主血流に再び合流します。
ネフロンの長さの違い
[編集]皮質ネフロン(ネフロンの大部分)は皮質の高位部から始まり、短いヘンレループを有し、髄質の深部まで到達しない。皮質ネフロンは、表層皮質ネフロンと中層皮質ネフロンに細分される。[ 9 ]
傍髄質ネフロン(詳細な説明が必要)は、髄質に近い皮質の下層から始まり、腎髄質の奥深くまで達する長いヘンレループを有する。傍髄質ネフロン特有の特徴として、ヘンレループは直血管に囲まれている点が挙げられる。これらの長いヘンレループとそれに付随する直血管は、高浸透圧勾配を形成し、濃縮尿の生成を可能にする。[ 10 ]また、ヘアピンベンドは髄質の内層まで達する。[ 11 ]
傍髄質ネフロンは鳥類と哺乳類にのみ見られ、特定の位置にあります。「髄質」は腎髄質を指し、「傍髄質」(ラテン語で「近い」)は、このネフロンの腎小体の相対的な位置、つまり髄質に近い位置にあるものの皮質内にあることを指します。言い換えれば、傍髄質ネフロンは、腎小体が髄質に近く、近位尿細管とそれに関連するヘンレ係蹄が、他のタイプのネフロンである皮質ネフロンよりも髄質のより深い位置にあるネフロンです。
髄質傍ネフロンがヒトの腎臓のネフロンの約15%を占めるに過ぎません。[ 1 ]:24 しかし、ネフロンのイラストで最もよく描かれているのはこのタイプのネフロンです。
ヒトでは、皮質ネフロンの腎小体は皮質の外側3分の2に位置し、髄質近傍ネフロンの腎小体は皮質の内側3分の1に位置している。[ 1 ]:24
機能
[編集]
ネフロンは、血液を尿に変換するために、濾過、再吸収、分泌、排泄という4つのメカニズムを用いています。[ 5 ] : 395–396 これらは多くの物質に当てはまります。ネフロン内腔を覆う上皮細胞の構造と機能は、ネフロンの形成過程において変化し、その位置と機能の違いを反映して、いくつかのセグメントに名称が付けられています。


近位尿細管
[編集]ネフロンの一部である近位尿細管は、最初の湾曲部とそれに続く直線部(下行部)に分けられます。 [ 12 ]近位尿細管に入る濾液は、グルコースの80%、濾過された塩分の半分以上、水、および濾過されたすべての有機溶質(主にグルコースとアミノ酸)を含む尿細管周囲毛細血管に再吸収されます。[ 5 ] : 400–401
ヘンレのループ
[編集]ヘンレ係蹄は、近位尿細管から伸びるU字型の管で、下行脚と上行脚から構成されています。皮質から始まり、近位尿細管からの濾液を受け取り、下行脚として髄質へ伸び、その後上行脚として皮質に戻り、遠位尿細管へと排出されます。ヘンレ係蹄の主な役割は、尿細管の濃度を高めるのではなく、間質液を高張にすることで、生体が濃縮尿を産生できるようにすることです。[ 1 ] : 67
ヘンレ係蹄の下行脚と上行脚を区別するには、かなりの差異が役立ちます。下行脚は水に対しては透過性が高く、塩分に対しては著しく透過性が低いため、間質の濃度には間接的にしか寄与しません。濾液が腎髄質の高張性 間質へと深く下降するにつれて、濾液と間質の張性が平衡するまで、水は浸透圧によって下行脚から自由に流出します。髄質の高張性(ひいては尿の濃度)は、ヘンレ係蹄の大きさによって部分的に決定されます。[ 1 ] : 76
下行脚とは異なり、太い上行脚は水を透過せず、これはループが採用する逆流交換機構の重要な特徴である。上行脚は濾液からナトリウムを能動的に排出し、逆流交換を促進する高張性の間質を生成する。上行脚を通過する際に、濾液はナトリウム含有量の多くを失うため、低張性となる。この低張性濾液は、腎皮質の遠位尿細管へと送られる。 [ 1 ]:72
遠位尿細管
[編集]遠位曲尿細管は、近位曲尿細管とは構造と機能が異なります。尿細管の内壁細胞には、能動輸送に必要なエネルギー( ATP)を産生するミトコンドリアが多数存在します。遠位曲尿細管で行われるイオン輸送の多くは、内分泌系によって制御されています。副甲状腺ホルモンが存在すると、遠位曲尿細管はより多くのカルシウムを再吸収し、より多くのリン酸を分泌します。アルドステロンが存在すると、より多くのナトリウムが再吸収され、より多くのカリウムが分泌されます。選択的再吸収の際には、アンモニアも吸収されます。心房性ナトリウム利尿ペプチドは、遠位曲尿細管からのナトリウムの分泌を促進します。
連結管
[編集]遠位ネフロンの一部。これは尿細管が集合管系に入る前の最後の部分です。水、一部の塩分、そして尿素やクレアチニンなどの窒素性老廃物が集合管へと排出されます。
集合管システム
[編集]
それぞれの遠位曲尿細管は、濾液を集合管系に送り出し、その最初の部分が連絡尿細管である。集合管系は腎皮質から始まり、髄質の深部まで伸びている。尿が集合管系を下降するにつれ、ヘンレの向流倍増管系のループによって高ナトリウム濃度となった髄質間質を通過する。[ 1 ]:67
尿器および生殖器の発達過程において、集合管はネフロンの他の部分とは異なる起源を持つため、ネフロンの一部とはみなされないことがある。集合管は後腎芽からではなく、尿管芽から起源する。[ 13 ] : 50–51
集合管は通常は水を通さないが、抗利尿ホルモン(ADH)の存在下では透過性となる。ADHはアクアポリンの働きに影響を与え、集合管を通過する際に水分子の再吸収を引き起こす。アクアポリンは膜タンパク質であり、イオンやその他の溶質の通過を防ぎながら水分子を選択的に伝導する。尿に含まれる水分の最大4分の3は、浸透圧によって集合管から排出される際に再吸収される。したがって、ADHのレベルによって尿が濃縮されるか希釈されるかが決まる。ADHの上昇は脱水症状の兆候であり、水分が十分にある場合はADHが低下し、尿が希釈される。[ 5 ]:406

集合器官の下部も尿素を透過するため、尿素の一部は髄質に入り込み、高濃度を維持する(これはネフロンにとって非常に重要である)。[ 1 ]:73–74
尿は髄質集合管から腎乳頭を通って腎杯、腎盂に流れ込み、最終的に尿管を経由して膀胱に送られます。[ 5 ]:406–407
傍糸球体装置
[編集]傍糸球体装置(JGA)は、ネフロンと関連しながらもネフロンとは独立した特殊な領域です。JGAはレニン(アンジオテンシノゲナーゼ)という酵素を産生し、循環血中に分泌します。レニンはアンジオテンシノーゲンを分解し、10個のアミノ酸からなるアンジオテンシン-1(A-1)を生成します。A-1はその後、アンジオテンシン変換酵素(ACE)によって2つのアミノ酸が除去され、強力な血管収縮剤であるアンジオテンシン-2に変換されます。この一連の反応は、レニン・アンジオテンシン系(RAS)またはレニン・アンジオテンシン・アルドステロン系(RAAS)と呼ばれます。JGAは、太い上行脚と輸入細動脈の間に位置し、緻密斑、傍糸球体細胞、および糸球体外メサンギウム細胞の3つの構成要素から構成されています。[ 5 ]:404
臨床的意義
[編集]慢性腎臓病の初期段階の患者では、ネフロンの数が約50%減少しており、これは加齢(18~29歳と70~75歳)に伴って起こるネフロンの損失に匹敵します。[ 14 ]
ネフロンの疾患は主に糸球体または尿細管のいずれかに影響を及ぼします。糸球体疾患には糖尿病性腎症、糸球体腎炎、IgA腎症などがあり、尿細管疾患には急性尿細管壊死、尿細管性アシドーシス、多発性嚢胞腎などがあります。
追加画像
[編集]-
腎臓皮質における血管の分布。(図では輸出血管を静脈としているが、実際は細動脈である。)
-
腎臓組織
-
糸球体
-
この画像は、腎臓ネフロンの糸球体部分に存在する細胞の種類を示しています。足細胞、内皮細胞、糸球体メサンギウム細胞が存在します。
参照
[編集]参考文献
[編集]- ^ a b c d e f g h Lote CJ (2012).腎生理学の原理(第5版). Springer.
- ^ Kumaran GK, Hanukoglu I (2024). 「腎臓における尿細管と周囲の尿細管周囲毛細血管の細胞骨格構造のマッピング」Cytoskeleton (Hoboken) . 81 ( 4–5 ): 227–237 . doi : 10.1002/cm.21809 . PMID 37937511 .
- ^ Pocock G, Richards CD (2006). 『人間生理学:医学の基礎』(第3版). オックスフォード:オックスフォード大学出版局. p. 349. ISBN 978-0-19-856878-0。
- ^ a b Tortora GJ, Derrickson BH (2010). 『解剖学と生理学の原理(第12版)』 ホーボーケン, ニュージャージー: John Wiley & Sons. ISBN 978-0-470-23347-4. OCLC 192027371 .
- ^ a b c d e f メッシャー AL (2016). Junqueira の Basic Histology (第 14 版)。ランゲ。ISBN 978-0-07-184268-6。
- ^ 「腎臓の尿細管I:尿の生成」コロラド大学ボルダー校の生態学と進化生物学。 2007年10月2日時点のオリジナルよりアーカイブ。 2007年3月6日閲覧。
- ^ Hook JB, Goldstein RS (1993). 『腎臓の毒性学』 Raven Press. p. 8. ISBN 0-88167-885-6。
- ^ Kumaran GK, Hanukoglu I (2020年3月). 「アクチン細胞骨格パターンによるネフロン分節上皮細胞の同定と分類」 . FEBS J. 287 ( 6): 1176– 1194. doi : 10.1111/febs.15088 . PMC 7384063. PMID 31605441 .
- ^ Nosek TM. 「Section 7/7ch03/7ch03p16」 . 『Essentials of Human Physiology 』. 2016年3月24日時点のオリジナルよりアーカイブ。
- ^ Jameson JL, Loscalzo J (2010). Harrisonの腎臓学と酸塩基平衡障害. McGraw-Hill Professional. p. 3. ISBN 978-0-07-166339-7。
- ^ 「尿濃度の調節」 .解剖学と生理学. CliffsNotes. 2012年10月25日時点のオリジナルよりアーカイブ。 2012年11月27日閲覧。
- ^ Boron WF (2005). 『医学生理学:細胞と分子のアプローチ』 エルゼビア/サンダース. p. 743. ISBN 978-1-4160-2328-9。
- ^ Mitchell B, Sharma R (2009). Embriology (第2版). Churchill Livingstone Elsevier.
- ^ Kuro-O M (2019年1月). 「健康と疾患におけるクロトータンパク質」. Nature Reviews. 腎臓学. 15 (1): 27– 44. doi : 10.1038/s41581-018-0078-3 . PMID 30455427. S2CID 53872296 .