| |||
| 名前 | |||
|---|---|---|---|
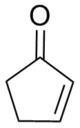
| 推奨IUPAC名
シクロペント-2-エン-1-オン | |||
| 識別子 | |||
3Dモデル(JSmol)
|
| ||
| チェビ |
| ||
| チェムブル | |||
| ケムスパイダー | |||
| ECHA 情報カード | 100.012.012 | ||
PubChem CID
|
| ||
| ユニイ | |||
CompToxダッシュボード (EPA)
|
| ||
| |||
| プロパティ | |||
| C 5 H 6 O | |||
| モル質量 | 82.102 g·mol −1 | ||
| 密度 | 0.98 g·mL −1 | ||
| 沸点 | 150℃(302°F; 423K) | ||
| 水にほとんど溶けない | |||
| 危険 | |||
| 労働安全衛生(OHS/OSH): | |||
主な危険
|
有害 | ||
| 引火点 | 42℃(108℉; 315K) | ||
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。
| |||
2-シクロペンテノンは、化学式(CH 2 ) 2 (CH) 2 COで表される有機化合物です。2-シクロペンテノンは、ケトン基とアルケン基という2つの官能基を有し、無色の液体です。異性体である3-シクロペンテノンはあまり一般的ではありません。
シクロペンテノンという用語は、シクロペンテノン部分がより大きな分子のサブユニットである構造モチーフを指すこともあります。シクロペンテノンは、ジャスモン、アフラトキシン、いくつかのプロスタグランジンなど、多数の天然物に含まれています。[1]
合成
2-シクロペンテノンは様々な方法で合成できます。その一つは、炭酸リチウムを用いたα-ブロモシクロペンタノンの脱離反応[2]と、以下に示すような不飽和ジエステルのクライゼン縮合-脱炭酸-異性化反応の連続反応です[3] 。

シクロペンタンジオールの酸触媒脱水によりシクロペンテノンが得られる。[4]
官能基としての2-シクロペンテノンの合成は、ジビニルケトンからのナザロフ環化反応、シクロペンタノンからの三枝・伊藤酸化、対応するジエンからの閉環メタセシス、対応する環状アリルアルコールの酸化、アルケン、アルキン、一酸化炭素からのパウソン・カンド反応など、さまざまな方法で達成されます。[5]
反応
エノンである2-シクロペンテノンは、求核共役付加、ベイリス・ヒルマン反応、マイケル反応など、α-β不飽和ケトンの典型的な反応を起こす。シクロペンテノンはまた、ディールス・アルダー反応において優れたジエノフィルとして機能し、様々なジエンと反応する。例えば、ダニシェフスキー型ジエンはシクロペンテノンと反応して縮合三環式化合物を生成し、コリオリンの合成に繋がる。[6]

発生
加圧調理した豚レバーから同時水蒸気蒸留と連続溶媒抽出によって単離された。[7] [1]
関連化合物
参考文献
- ^ ab Simeonov、Svilen P.;ヌネス、ジョアン首相。ゲッラ、クラシミラ。クルテバ、ヴァーニャ B.アフォンソ、カルロス AM (2016-05-25)。「キラルシクロペンテノンの合成」。化学レビュー。116 (10): 5744–5893。土井:10.1021/cr500504w。ISSN 0009-2665。PMID 27101336。
- ^ US EP1418166、福島大輔、平田典彦、「2-ブロモシクロペンタノンの製造方法」、2004年5月12日公開
- ^ US EP1422212、Liang, Shelue; Haunert, Andrea & Huber-Dirr, Sylvia et al.、「シクロペンテノンの製造方法」、2004年11月25日公開
- ^ チャールズ・H・デピュイ; KLエイラーズ(1962年)。 「2-シクロペンテノン」。組織シンセ。42 : 38.土井:10.15227/orgsyn.042.0038。
- ^ Müller, Reto. 「シクロペンテノンの合成」.有機化学ポータル. 2015年3月3日閲覧。
- ^ ダニシェフスキー, サミュエル; ザンボニ, ロバート; カーン, マイケル; エサーエッジ, サラ・ジェーン (1980年3月). 「dl-コリオリンの全合成」.アメリカ化学会誌. 102 (6): 2097– 2098. doi :10.1021/ja00526a061.
- ^ ムッシナン、シンシア・J.; ウォルラッド、ジョン・P. (1974年5月). 「圧力調理した豚レバーの揮発性成分」. Journal of Agricultural and Food Chemistry . 22 (5): 827– 831. doi :10.1021/jf60195a002.
- ^ AG Ross, X. Li, SJ Danishefsky (2012). 「シクロブテノンの調製」.有機合成. 89 : 491. doi : 10.15227/orgsyn.089.0491 .
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Y. Ito, S. Fujii, M. Nakatuska, F. Kawamoto, T. Saegusa (1979). 「シクロアルカノンから共役シクロアルケノンへの1炭素環拡大:2-シクロヘプテン-1-オン」. Organic Syntheses . 59 : 113. doi :10.15227/orgsyn.059.0113.
{{cite journal}}: CS1 maint: multiple names: authors list (link)