 | |
| 臨床データ | |
|---|---|
| 商号 | バクスデラ、その他 |
| その他の名前 | ABT-492; RX-3341; WQ-3034 |
| AHFS / Drugs.com | モノグラフ |
| ライセンスデータ |
|
投与経路 | 経口、静脈注射 |
| ATCコード |
|
| 法的地位 | |
| 法的地位 | |
| 識別子 | |
| |
| CAS番号 |
|
| PubChem CID |
|
| ドラッグバンク |
|
| ケムスパイダー |
|
| ユニイ |
|
| ケッグ |
|
| チェムブル |
|
| CompToxダッシュボード (EPA) |
|
| 化学および物理データ | |
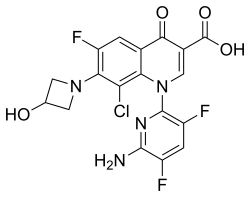
| 式 | C 18 H 12 Cl F 3 N 4 O 4 |
| モル質量 | 440.76 g·mol −1 |
| 3Dモデル(JSmol) |
|
| |
デラフロキサシンは、 Baxdelaなどのブランド名で販売されているフルオロキノロン系 抗生物質で、急性細菌性皮膚感染症および皮膚構造感染症の治療に使用されます。[3]メリンタ・セラピューティクス社によって開発されました。
医療用途
デラフロキサシンは、感受性細菌による急性細菌性皮膚・皮膚構造感染症(ABSSSI)の成人、または感受性細菌による市中感染性細菌性肺炎(CABP)の成人の治療に適応があります。[3]
ABSSSIに感受性のある細菌は以下の通りである: [3]
- グラム陽性菌:黄色ブドウ球菌(メチシリン耐性 [MRSA] およびメチシリン感受性 [MSSA] 分離株を含む)、ブドウ球菌ヘモリティカス、ブドウ球菌ルグドゥネンシス、ストレプトコッカス・アガラクティエ、ストレプトコッカス・アンギノサス群 (ストレプトコッカス・アンギノサス、ストレプトコッカス・インターメディウス、ストレプトコッカス・コンステラトゥスを含む)、ストレプトコッカス・ピオゲネス、エンテロコッカス・フェカリス
- グラム陰性菌:大腸菌、エンテロバクター・クロアカエ、クレブシエラ・ニューモニアエ、および緑膿菌。
CABPに感受性のある細菌は、[3] 肺炎球菌、黄色ブドウ球菌(メチシリン感受性[MSSA]分離株のみ)、肺炎桿菌、大腸菌、緑膿菌、インフルエンザ菌、パラインフルエンザ菌、肺炎クラミジア、レジオネラ・ニューモフィラ、および肺炎マイコプラズマです。
妊婦を対象とした試験は行われていない。[3]
欧州連合では、これらの感染症の初期治療に一般的に推奨される他の抗菌剤の使用が不適切であると考えられる場合、成人の急性細菌性皮膚・皮膚構造感染症(ABSSSI)の治療に適応があります。[5]
副作用
デラフロキサシンは、フルオロキノロン系の他の薬剤と同様に、腱炎、腱断裂、末梢神経障害、中枢神経系への影響、および重症筋無力症の増悪のリスクに関する黒枠警告が記載されています。また、添付文書には、過敏症反応およびクロストリジウム・ディフィシル関連下痢のリスクについても警告が記載されています。 [3]
臨床試験の被験者の2%以上に発生した副作用には、吐き気、下痢、頭痛、トランスアミナーゼの上昇、嘔吐などがありました。[3]
相互作用
他のフルオロキノロン系薬剤と同様に、デラフロキサシンはアルミニウム、マグネシウム、スクラルファート、鉄、亜鉛などの金属や、ジダノシンなどの二価および三価陽イオンをキレートします。この薬剤を制酸剤、一部の栄養補助食品、またはこれらのイオンで緩衝化された薬剤と併用すると、デラフロキサシンの有効量が阻害されます。[3]
薬理学
通常の用量では、半減期は約8時間です。排泄は65%が尿中に排泄され、そのほとんどは未代謝の形で、28%が便中に排泄されます。重度の腎疾患患者ではクリアランスが低下します。[6]
デラフロキサシンは、メチシリン耐性黄色ブドウ球菌(MRSA)などのグラム陽性菌に対して、他のキノロン系薬剤よりも高い活性(MIC90が低い)を示します。承認されているフルオロキノロン系薬剤のほとんどが両性イオン性であるのに対し、デラフロキサシンは陰イオン性であるため、酸性pHにおいて細菌および細胞の両方においてデラフロキサシンの蓄積が10倍に増加します。この特性により、細胞内感染やバイオフィルムを含む酸性環境における黄色ブドウ球菌の除菌において、デラフロキサシンは優れた効果を発揮すると考えられています。[6]デラフロキサシンは、その抗バイオフィルム作用から、ハードウェア関連感染症の治療選択肢としてますます注目されています。[7]
化学
化学名は1-デオキシ-1(メチルアミノ)-D-グルシトール、1-(6-アミノ-3,5-ジフルオロピリジン-2-イル)-8-クロロ-6-フルオロ-7-(3-ヒドロキシアゼチジン-1-イル)-4-オキソ-1,4-ジヒドロキノリン-3-カルボキシレート(塩)である。[3]
デラフロキサシン注射剤は、有効成分のメグルミン 塩として販売されており、米国における正式名称はデラフロキサシンメグルミンです。注射剤にはEDTAとスルホブチルエーテル-β-シクロデキストリンも含まれています。錠剤は、デラフロキサシン、無水クエン酸、クロスポビドン、ステアリン酸マグネシウム、微結晶セルロース、ポビドン、炭酸水素ナトリウム、リン酸二水素ナトリウム一水和物から構成されています。[3]
歴史
デラフロキサシンは開発中はABT-492、RX-3341、WQ-3034として知られていました。[8]
リブエックス・ファーマシューティカルズは2006年にワクナガ製薬からデラフロキサシンを買収した。[9] リブエックスは2013年にメリンタ・セラピューティクスに改名された。[10]デラフロキサシンはメリンタ・セラピューティクス(旧リブエックス・ファーマシューティカルズ)によって開発・販売されたが、 [3]その後、メリンタ・セラピューティクスはセンプラと合併した。[11]
デラフロキサシンの主要な臨床試験は、メリンタ社によって、皮膚および皮膚構造感染症、複雑性細菌感染症、および単純性淋病の適応症に関して実施されました。淋病に関する試験は、データが発表される前に中止されました。[12]
デラフロキサシンは、急性細菌性皮膚・皮膚構造感染症の患者1042名を対象とした2つの試験で、バンコマイシンとアズトレオナムの併用療法に対して非劣性を示した後、2017年6月にFDAの承認を受けました。[13]デラフロキサシン(バクスデラ)450mg錠と300mg注射剤の新薬申請(NDA)は、2017年6月にFDAによって承認されました。[14]
FDAはメリンタに以下の追加研究を実施する義務を課した。[14]
- 耐性が出現するかどうかを決定するための5年間の監視研究。最終報告書は2022年12月に提出予定。
- 生殖管への分布を調べるために妊娠ラットにIV剤を投与する研究が2018年6月に予定されており、有意な分布がある場合はさらなる研究が必要となる。
メリンタは2017年8月にセンプラと合併した。[11]
メリンタは、デラフロキサシンの国際販売に向けて、メナリニ・セラピューティクス(2017年3月)およびユーロファーマ・ラボラトリオス(2015年1月)と販売・流通契約を締結しました。メナリニとの契約により、メリンタは欧州、中国、韓国などを含む68カ国での販売・流通が可能になります。ユーロファーマとの同様の契約により、ブラジルでも販売が可能になります。[12]
参考文献
- ^ 「Baxdelaに関する決定の根拠の概要」. Drug and Health Products Portal . 2025年4月2日. 2025年6月22日閲覧。
- ^ 「革新的医薬品登録簿」カナダ保健省2006年11月3日. 2025年4月17日閲覧。
- ^ abcdefghijkl 「Baxdela- デラフロキサシンメグルミン錠、Baxdela- デラフロキサシンメグルミン注射剤、粉末、凍結乾燥、溶液用」DailyMed、2020年2月12日。 2020年5月12日閲覧。
- ^ 「Quofenix EPAR」.欧州医薬品庁(EMA) . 2019年12月16日. 2024年10月17日閲覧。
- ^ 「Quofenix EPAR」.欧州医薬品庁(EMA) . 2019年10月16日. 2020年5月12日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
- ^ ab Candel FJ, Peñuelas M (2017). 「デラフロキサシン:設計、開発、そして治療における潜在的な位置づけ」. Drug Design, Development and Therapy . 11 : 881– 891. doi : 10.2147/DDDT.S106071 . PMC 5367733. PMID 28356714 .
- ^ Di Bella S, Mearelli F, Gatti M (2025年2月). 「ハードウェア関連感染症における抗バイオフィルム抗生物質の重要性」. Clinical Infectious Diseases ciaf064. doi :10.1093/cid/ciaf064. PMID 39935305.
- ^ 「デラフロキサシン」AdisInsight . 2017年7月10日閲覧。
- ^ Cartwright H (2011年7月12日). 「Rib-X Pharmaceuticals、サノフィとグローバル抗生物質研究提携を締結」. PharmaDeals Review . 第7号. doi :10.3833/pdr.v2011i7.1494 (2025年7月11日現在非公開). 2012年4月25日時点のオリジナルよりアーカイブ。
{{cite news}}: CS1 maint: DOIは2025年7月時点で非アクティブです(リンク) - ^ Stearns J (2016年8月1日). 「Melinta Therapeutics、致死性の薬剤耐性菌に狙いを定める」Hartford Business Journal .
- ^ ab 「CempraとMelinta、垂直統合型商業段階の抗感染薬企業設立に向けた合併を発表」(プレスリリース)。Melinta Therapeutics。2017年8月9日。 2022年11月24日閲覧– GlobeNewswire経由。
- ^ ab Markham A (2017年9月). 「デラフロキサシン:世界初の承認」. Drugs . 77 (13): 1481– 1486. doi :10.1007/s40265-017-0790-5. PMC 6208769. PMID 28748399 .
- ^ Osborne R (2017年6月20日). 「MelintaのIV・経口デラフロキサシンが皮膚感染症でFDAの承認を取得」BioWorld . 2019年8月3日時点のオリジナルよりアーカイブ。 2017年7月10日閲覧。
- ^ ab 「NDA承認書:NDA 208610およびNDA 208611」(PDF)。FDA。2017年6月19日。
