| |
 | |
| 名前 | |
|---|---|
| IUPAC名
ペンタシクロ[7.3.1.1 4,12 .0 2,7 .0 6,11 ]テトラデカン
| |
| その他の名前
コングレッサン、ジアダマンタン、デカヒドロ-3,5,1,7-[1,2,3,4]ブタンテトライルナフタレン
| |
| 識別子 | |
3Dモデル(JSmol)
|
|
| 1904934 | |
| チェビ |
|
| ケムスパイダー |
|
PubChem CID
|
|
| ユニイ | |
CompToxダッシュボード (EPA)
|
|
| |
| |
| プロパティ | |
| C14H20 | |
| モル質量 | 188.314 g·mol −1 |
| 外観 | 固体の白い結晶 |
| 密度 | 1.092 ± 0.06 g cm −3 |
| 融点 | 244.73 °C (472.51 °F; 517.88 K) |
| 沸点 | 269.5 ± 7.0 °C |
| 難溶性(8.1 x 10 −4 g L −1) | |
| ジエチルエーテルへの溶解性 | 可溶性 |
| ログP | 5.556 ± 0.228 |
| 蒸気圧 | 0.0120 トル |
| 危険 | |
| 労働安全衛生(OHS/OSH): | |
主な危険
|
刺激性、水生生物に対する急性毒性 |
| NFPA 704(ファイアダイヤモンド) | |
| 引火点 | 98.1 °C (208.6 °F; 371.2 K) |
| 安全データシート(SDS) | 外部MSDS |
| 構造 | |
| D 3d | |
| 0日 | |
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。
| |

ジアマンタン(コングレッサンとも呼ばれる)は、ダイアモンドイドに属する有機化合物です。ダイアモンドイドは、ダイヤモンド格子のサブユニットに類似した構造を持つ籠型炭化水素です。無色の固体で、石油からの発見や深層天然ガスコンデンセートからの分離以来、研究対象となっています。ジアマンタンなどのダイアモンドイドは、表面エネルギーの低さ、密度の高さ、高い疎水性、耐酸化性など、特異な特性を示します。[1]
発生と経緯
ジアマンタンは原油中に天然に存在します。現在、アダマンタンとジアマンタンは、多環式ナフテン炭化水素の触媒転位によって生成されたと考えられています。ジアマンタンなどのダイアモンドイドは、一般的な石油中には微量しか存在しませんが、その優れた熱力学的安定性により、カタジェネシス(カタジェネシス)によって自然に濃縮され、ノーフレット層、米国メキシコ湾、西カナダ盆地などの天然ガスコンデンセートの重要な構成成分となっています。[2]
ジアマンタンは1963年のロンドンIUPAC会議の大会エンブレムに選ばれ、抄録、プログラム、広報資料の表紙の装飾として掲載されました。大会参加者はジアマンタンの合成に挑戦しました。この化学物質は1965年に、ノルボルネン光二量体混合物のハロゲン化アルミニウム触媒異性化によって1%の収率で初めて合成されました。アダマンタンが最初の化合物であり、後に「コングレッサン」として知られるようになったジアマンタンは、ダイアモンドイドとして知られる化合物群の2番目の化合物でした。1969年にこのシリーズの3番目の化合物が合成されたことで、より一般的な半自明な命名法の必要性が浮き彫りになりました。この化合物は「ジアマンタン」と改名され、3番目の化合物は「トリアマンタン」と命名されました。[3]
1966年は、アダマンタンの発見源であるホドニン原油の高沸点留分からジアマンタンが単離され、その収率が10%へと大幅に向上した年でもありました。これによりジアマンタンの化学的性質の探究が始まりました。しかし、この炭化水素は依然として大量に入手することが困難でした。その後、ジアマンタンはアダマンタンと同様に容易に入手できるようになり、その化学的性質の研究がより容易になりました。[3]
生産
ジアマンタンは、ルイス酸触媒を用いた様々な五環式テトラデカンの転位反応によって合成できます。最も高い収率(84%)は、トランス-テトラヒドロ-ビノル-Sから得られます。以下に詳述する簡便な合成法では、水素化されたビノル-S化合物を転位反応させることで、約70%の収率でジアマンタンが得られます。より高度な歪みを持つ前駆体を用いた場合、不均化反応により、収率は低くなります(1~47%)。[3]
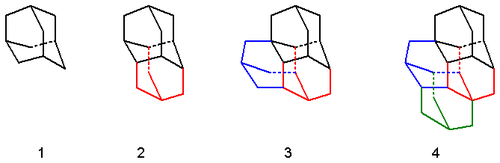
実験室での合成は、臭化コバルト-トリフェニルホスフィンと三フッ化ホウ素エーテルの混合物を触媒とするノルボルナジエン(1 )の二量化から始まる。得られた二量体(2)を水素化してテトラヒドロ-ビノル-S異性体(3a-3d)を得る。立体的相互作用の結果、主に3aと3bが得られる。次のステップは転位反応であり、これはシクロヘキサンまたは二硫化炭素と臭化アルミニウムの熱溶液中で起こり、主生成物であるジアマンタン(4)を生成する。[4] [5] [6]

ジアマンタンは、長鎖n-アルカンの熱分解によって生成できます。この変換の機構は、フリーラジカル付加であると考えられています。この方法ではアルキル化された(メチル基で一置換、二置換、三置換された)ジアマンタンが生成されますが、アダマンタン誘導体は熱力学的安定性が高いため、より多く生成されます。この方法では、最大35個の炭素原子を含むn-アルカンの相同配列とコークスも生成します。ダイヤモンドイド化合物が熱分解によって合成できるという仮説は、さらなる検証が必要です。[7]
プロパティ
ディアマンタンはダイアモンドイド族に属します。これらの元素の構造は、ダイヤモンド結晶格子のセグメントで構成されています。

ジアマンタンは特殊な構造のため、他の炭化水素に比べて融点が高く、化学的および熱的にも高い安定性を有しています。
| 生成エンタルピー | ソース |
|---|---|
| [8] | |
| [8] |
反応
ジアマンタンは、ニトロニウムテトラフルオロボレート(ニトリルを含まないニトロメタン中)で処理することでニトロ化され、2つの異性体ニトロジアマンタンの混合物が得られる。[9]
塩化アルミニウムと塩化アセチルによる塩素化では、1-クロロジアマンタンと4-クロロジアマンタンが等量生成するが、クロロスルホン酸を用いると主に1-クロロ異性体が得られる。塩化物を加水分解すると対応するアルコールが得られ、これはアルミナカラムクロマトグラフィーで分離できる。[10]
参考文献
- ^ シュライナー, ピーター; フォーキン, アンドレイ; フォキナ, ナタリー; トカチェンコ, ボリスラフ; ダール, ジェレミー; カールソン, ロバート (2011). 「ダイアモンドイドカルボン酸の合成」. Synthesis . 2012 (2): 259. doi :10.1055/s-0031-1289617.
- ^ Dahl, JE; Liu, SG; Carlson, RM (2002). 「ナノメートルサイズのダイヤモンド分子、高次ダイヤモンドイドの単離と構造」. Science . 299 (5603): 96–9 . doi : 10.1126/science.1078239 . PMID 12459548.
- ^ abc Gund, Tamara M.; Osawa, Eiji; Williams, Van Zandt; Schleyer, Paul VR (1974). 「ジアマンタン. I. ジアマンタンの調製. 物理的およびスペクトル的性質」. The Journal of Organic Chemistry . 39 (20): 2979. doi :10.1021/jo00934a009.
- ^ Gund, TM; Osawa, E.; Van Zandt, W. Jr.; Schleyer, P. v. R.:ディアマンタン. 1. ジアマンタンの調製. 物理的およびスペクトル的性質. Journal of Organic Chemistry , Band 39, Nr. 20, 1974, S. 2979–2987, doi:10.1021/jo00934a009.
- ^ ガンド、TM;大沢英夫;ヴァン・ザント・W・ジュニア。 Schleyer, P. v. R.:ジアマンタン (コングレサン) の便利な高収率の調製。収録: Tetrahedron Letters、1970、バンド 11、Nr. 44、S. 3877–3880、土井:10.1016/S0040-4039(01)98613-7。
- ^ Gund, TM; Thielecke, W.; Schleyer, P. v. R.: Diamantane : PENTACYCLO[7.3.1.1 4,12 .0 2,7 .0 6,11 ]TETRADECANE[Butanetetraylnaphthalene, 3,5,1,7-[1,2,3,4]-decahydro-]. Organic Syntheses , Band 53, 1973, S. 30, doi:10.15227/orgsyn.053.0030.
- ^ Gordadze, GN; Giruts, MV (2008). 「高級n-アルカンの高温分解によるアダマンタンおよびジアマンタン炭化水素の合成」.石油化学. 48 (6): 414. doi :10.1134/S0965544108060029.
- ^ ab Clark, T.; Knox, TM; McKervey, MA; Mackle, H.; Rooney, JJ:架橋環式物質の熱化学. いくつかのダイアモンドイド炭化水素およびペルヒドロキナセンの生成エンタルピー. 経験的力場計算データとの比較. Journal of the American Chemical Society , Band 101, Nr. 9, 1979, S. 2404–2410, doi:10.1021/ja00503a028.
- ^ Olah, G. A; Ramaiah, P.; Rao, CB; Sandford, G.; Golam, R.; Trivedi, NJ; Olah, JA (1993). 「アダマンタンおよびジアマンタンのニトロニウムテトラフルオロボレートによるニトロ化」J. Am. Chem. Soc . 115 (16): 7246– 7249. doi :10.1021/ja00069a024.
- ^ T. Courtney; DE Johnston; MA McKervey; JJ Rooney (1972). 「ジアマンタンの化学:合成といくつかの官能基化反応」J. Chem. Soc. (1): 2691– 2696. doi :10.1039/P19720002691.