ヌクレオシドおよびヌクレオチド 逆転写酵素阻害剤(NRTIおよびNtRTI) の発見と開発は、エイズ 流行が西洋社会を襲った1980年代に始まりました。NRTIは、ヒト免疫不全ウイルス( HIV )の遺伝物質の複製を制御する酵素である逆転写酵素(RT)を阻害します。最初のNRTIはジドブジンで、1987年に米国食品医薬品局(FDA)によって承認され、HIV治療への第一歩となりました。その後、6種類のNRTIと1種類のNtRTIが開発されました。NRTIとNtRTIは、内因性の2'-デオキシヌクレオシドおよびヌクレオチドの類似体です。薬剤耐性ウイルスは、HIV-1が抗HIV薬に長期間さらされると避けられない結果です。
歴史
1981 年の夏、後天性免疫不全症候群 (AIDS) が初めて報告されました。[1] 2 年後、AIDS との病因的関連として、ヒト免疫不全ウイルス (HIV) が特定されました。[2] [3] HIV が特定されて以来、効果的な抗レトロウイルス薬の開発と HIV 研究における科学的成果は膨大です。[3] [4] HIV 感染症の治療に使用される抗レトロウイルス薬は、ヌクレオシドおよびヌクレオチド逆転写酵素阻害剤、非ヌクレオシド逆転写酵素阻害剤、プロテアーゼ阻害剤、侵入阻害剤、共受容体阻害剤、およびインテグラーゼ阻害剤の 6 つのカテゴリーに分類されます。[4] HIV-1 の逆転写酵素は、抗 HIV 薬開発の主な基礎となっています。[5] in vitro で抗 HIV 活性を示した最初のヌクレオシド逆転写酵素阻害剤はジドブジンでした。[6]ジドブジンが1987年に承認されて以来、6つのヌクレオシドと1つのヌクレオチド逆転写酵素阻害剤(NRTI)がFDAによって承認されています。[6] FDAによって承認されているNRTIは、ジドブジン、ジダノシン、ザルシタビン、スタブジン、ラミブジン、アバカビル、エムトリシタビンであり、承認されている唯一のヌクレオチド逆転写酵素阻害剤(NtRTI)はテノホビルです(表4を参照)。[4] [6]
HIV-1逆転写酵素
関数

標準的なHIV薬物療法のほとんどは、HIV-1ウイルスやその他のレトロウイルスがそのライフサイクルを完了するために必要な酵素である逆転写酵素(RT)を阻害することに重点を置いています。[5] RT酵素には2つの重要な機能があります。まず、ポリメラーゼ活性を介してウイルスの遺伝物質の複製を制御します。ウイルスの一本鎖RNAを組み込み可能な二本鎖DNAに変換します。その後、生成されたDNAは宿主細胞の核に移行し、レトロウイルスインテグラーゼによってゲノムに組み込まれます。RTのもう1つの役割は、 RNAがDNAとヘテロ二本鎖を形成している場合にのみ分解するリボヌクレアーゼH活性です。[7] [8]
構造
HIV-1 RTは、1000アミノ酸長の非対称ヘテロダイマーで、2つのサブユニットから構成されています。大きい方のサブユニットp66は560アミノ酸長で、RTの酵素活性をすべて発揮します。[8]小さい方のサブユニットp51は440アミノ酸長で、ヘテロダイマーを安定化させると考えられていますが、tRNAプライマーの結合にも関与している可能性があります。p66サブユニットには、ポリメラーゼとリボヌクレアーゼHという2つの活性部位があります。ポリメラーゼには4つのサブドメインがあり、「指」、「親指」、「接続部」、「手のひら」と名付けられています。これは右手に例えられているためです。[7] [8] [9]
作用機序
ヌクレオシドおよびヌクレオチド逆転写酵素阻害剤の活性化は、主に受動拡散またはキャリア輸送による細胞内への侵入に依存します。NRTIは親水性が高く、膜透過性が限られているため、このステップは非常に重要です。NRTIは内因性の2'-デオキシヌクレオシドおよびヌクレオチドの類似体です。親化合物のままでは不活性であり、逐次リン酸化が必要です。[6]
ヌクレオシドは三リン酸化される必要があり、一方、1つのホスホン酸基を持つヌクレオチドは二リン酸化される必要がある。[10]この段階的な活性化プロセスは細胞内で起こり、一連の酵素の協調によって媒介される。[11]最初の、そしてしばしば律速段階であるリン酸化ステップ(ヌクレオシド類似体の場合)は、最も一般的にはデオキシヌクレオシドキナーゼによって触媒される。ヌクレオシド一リン酸類似体への2番目のリン酸基の付加は、ヌクレオシド一リン酸キナーゼ(NMPキナーゼ)によって完了する。ヌクレオシド二リン酸キナーゼ(NDPキナーゼ)、ホスホグリセリン酸キナーゼ、ピルビン酸キナーゼ、クレアチンキナーゼなど、さまざまな酵素がNRTIの最終リン酸化ステップを触媒することができ、その結果、それぞれ抗ウイルス活性な三リン酸類似体が形成される。[6] NRTIおよび利用可能な唯一のNtRTIは、それぞれの三リン酸型において、対応する内因性デオキシヌクレオチド三リン酸(dNTP)と競合し、新生DNA鎖への取り込みを巡って競合する(図1参照)。[6] dNTPの基質とは異なり、NRTIはデオキシリボース部位に3'-ヒドロキシル基を持たない。DNA鎖に組み込まれると、通常は次の核酸と5'-から3'-へのリン酸エステル結合を形成する3'-ヒドロキシル基が欠如しているため、逆転写酵素によるDNAのさらなる伸長が阻害され、連鎖終結因子として機能する。[10] [12]
発見と開発
HIV治療への第一歩 - ジドブジン
1964年、ミシガン癌財団のホロウィッツがジドブジン(AZT)を合成した。チミジンのデオキシリボース環の3'ヒドロキシル基がアジド基に置換され、ジドブジンとなる。[13]逆転写の際に成長するDNA鎖の次のヌクレオチドの結合点となる3'ヒドロキシル基がないため、ジドブジンは必須の連鎖終結因子となる。ジドブジンはチミジンの代わりに組み込まれ、HIV複製の極めて強力な阻害剤となる。[14]この化合物は1964年に潜在的な抗癌剤として合成されたが、効果がないことが判明した。[15] 1974年、ジドブジンはレトロウイルスに対して活性があると報告され、その後、1980年代半ばに西洋社会でエイズが流行した際に抗ウイルス薬として再スクリーニングされた。[13] [15]しかし、ジドブジンは細胞酵素によって三リン酸に変換され、感染していない細胞でも活性化されるため、比較的毒性が強い。 [14]
ヌクレオシド類似体のさらなる開発
ジデオキシヌクレオシド
| ジデオキシアデノシン | ジダノシン | |
|---|---|---|
| 化学薬品
構造 |

|

|
ジデオキシヌクレオシドは、糖環の2'-ヒドロキシル基と3'-ヒドロキシル基の両方が欠如したヌクレオシドの類似体である。[9]ジドブジンの合成から3年後、ジェローム・ホロウィッツとシカゴの同僚は、現在ザルシタビン(ddC)として知られる別のジデオキシヌクレオシドを合成した。[16]ザルシタビンは、デオキシシチジンと構造的に関連のある合成ピリミジンヌクレオシド類似体であり、リボース糖部分の3'-ヒドロキシル基が水素で置換されている。[17]ザルシタビンは、1992年6月にFDAによってHIV-1の治療薬として承認された。[3] [18]
2’,3’-ジデオキシイノシンまたはジダノシンは、生体内でジデオキシアデノシンに変換されます。その開発には長い歴史があります。[19] 1964年、ザルシタビンの対応するアデノシン類似体であるジデオキシアデノシンが合成されました。ジデオキシアデノシンは腎障害を引き起こすため、ジデオキシアデノシンから酵素酸化によってジダノシンが調製されました(表1参照)。ジダノシンは腎障害を引き起こすことなくHIVに対して活性があることがわかりました。[16]ジダノシンは1991年10月にFDAによってHIV-1の治療薬として承認されました。[18] ザルシタビンとジダノシンはどちらも必須の連鎖停止剤であり、抗HIV治療薬として開発されました。残念ながら、どちらの薬剤も選択性に欠け、副作用を引き起こします。[14]
| ザルシタビン | ラミブジン | |
|---|---|---|
| 化学薬品
構造 |

|

|
ジデオキシ骨格のさらなる改変により、2’,3’-ジデヒドロ-3’-デオキシチミジン(スタブジン、d4T)が開発されました。スタブジンの活性はジドブジンと類似していることが示されましたが、リン酸化パターンは異なります。
ジドブジンのチミジンキナーゼ(最初のリン酸化を担う酵素)に対する親和性はチミジンと同程度であるのに対し、スタブジンに対する親和性はチミジンの700倍弱いことが示されました。[9]
2',3'-ジデオキシ-3'-チアシチジン(ラミブジン、3TC)は、 ベルナール・ベローによって発見されました。ラミブジンの歴史は、ベルナール・ベローが糖誘導体を研究していた1970年代半ばにまで遡ります。ラミブジンは、ザルシタビンの硫黄類似体として開発されました(表2を参照)。[16]最初はラセミ混合物(BCH-189)として合成され、分析により、BCH-189(2',3'-ジデオキシ-3'-チアシチジン)の正および負の両エナンチオマーがHIVに対してin vitro活性を示したことが示されました。ラミブジンは負のエナンチオマーで、ピリミジンヌクレオシド類似体です。2'-デオキシシチジンのリボース環の3'炭素は、正のエナンチオマーよりも抗HIV活性が高く、毒性が低いため、硫黄原子に置き換えられました。[16] [20] [21]
次に挙げられたのは、ラミブジンの構造相同体である2',3'-ジデオキシ-5-フルオロ-3'-チアシチジン(エムトリシタビン、FTC)です。構造上の違いは、ラミブジンの塩基部分の5-フルオロ修飾です。エムトリシタビンはラミブジンと多くの点で類似しており、HIV-1とB型肝炎ウイルス(HBV)の両方に活性を示します。[21] [22]
炭素環ヌクレオシド
ジデオキシアデノシンの炭素環式類似体の抗HIV活性が検討された。当初はごくわずかな活性しか観察されなかった。多くのヌクレオシド類似体が調製・検討されたが、有意な活性を示し臨床使用の要件を満たしたのは1つだけであった。それはジデオキシアデノシンの2',3'-ジデヒドロ類似体であった。アデニン環の6位アミノ窒素にシクロプロピル基を導入することで親油性が向上し、脳への浸透性が向上した。この化合物はアバカビルとして知られている(表3参照)。[16]アバカビルは、1998年12月にFDAによりHIV-1感染症の治療薬として承認された。[20]
この薬は、生体内でグアノシン類似体として活性を示す唯一の承認済み抗レトロウイルス薬です。まず、アデノシンホスホトランスフェラーゼによって一リン酸化され、次に一リン酸がカルボビル3'-一リン酸に変換されます。その後、完全にリン酸化され、カルボビルは逆転写酵素によってDNA鎖に組み込まれ、連鎖終結剤として作用します。カルボビルは、経口バイオアベイラビリティが低いため、臨床開発から中止された、類似のグアノシン類似体です。[19]
| ジデオキシアデノシン | ジダノシン | アバカビル | |
|---|---|---|---|
| 化学構造 | 
|

|

|
非環式ヌクレオチド - 唯一承認されているNtRTI
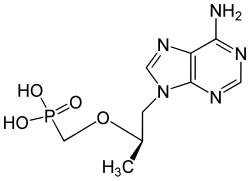
ヌクレオチド類似体はリン酸化ステップが2段階であるのに対し、ヌクレオシド類似体は3段階を必要とする。リン酸化要件の低減により、薬物をより迅速かつ完全に活性代謝物に変換できる可能性がある。このような考慮から、テノホビルなどのホスホネートヌクレオチド類似体が開発された。テノホビルジソプロキシルフマル酸塩(テノホビルDF)はテノホビルのプロドラッグである。テノホビルは非環式アデノシン誘導体である。この化合物の非環式性およびそのホスホネート部分は、承認されているNRTIの中でユニークな構造的特徴である。[21]テノホビルDFは酵素的に加水分解されて抗HIV活性を示すテノホビルになる。[23] [24]これは、2,3-ジヒドロキシプロピルアデニンの合成と広範囲の抗ウイルス活性によって開発された。 [24]テノホビルDFは、2001年10月にFDAによってHIV-1感染症の治療薬として承認された最初のヌクレオチド逆転写酵素阻害剤であった。[18] [23]
ここに何も書かれていないのに、なぜ表が次のセクションの見出しを飲み込んでしまうのでしょうか?
抵抗
現在、薬剤耐性ウイルスの出現は、HIV-1が抗レトロウイルス療法に長期間曝露されることの避けられない結果です。薬剤耐性はウイルス感染症の治療において深刻な臨床的懸念事項であり、特にHIVの治療においては困難な問題となっています。[25]承認されているすべてのNRTIにおいて、耐性変異が知られています。[26]
NRTI薬剤耐性を引き起こす主なメカニズムとして、NRTIの取り込みの妨害と、取り込まれたNRTIの除去の2つが知られています。[26] [27]取り込まれたNRTIの妨害には、RTのp66サブドメインの変異が関与しています。 [27]この変異は立体障害を引き起こし、ラミブジンなどの特定の薬剤が逆転写中に組み込まれるのを防ぎます。取り込まれたNRTIが除去される場合、耐性酵素は阻害剤をDNA鎖への組み込みの基質として容易に受け入れます。[27]その後、RT酵素は重合ステップを逆転させることで、取り込まれたNRTIを除去できます。この除去反応にはピロリン酸供与体が必要で、RTはこれをプライマーDNAの3'末端でNRTIに結合させ、プライマーDNAからNRTIを切り出します。[27] 患者におけるHIV-1複製の効率的な阻害を達成し、薬剤耐性ウイルスの出現を遅らせたり予防したりするために、薬剤の組み合わせが使用されます。HAARTは、高活性抗レトロウイルス療法としても知られ、NRTI、NtRTI、非ヌクレオシド系逆転写酵素阻害剤、プロテアーゼ阻害剤などの抗ウイルス薬の組み合わせで構成されています。[28]
現在の状況
現在、臨床開発および前臨床開発の様々な段階にあるNRTIが複数存在します。HIV-1に対する新たなNRTIの探索を継続する主な理由は、毒性を低減し、耐性ウイルスに対する有効性を高め、抗HIV-1治療を簡素化することです。[6] [26] [29]
アプリシタビン(ATC)
アプリシタビンはデオキシシチジン類似体です。ラミブジンとは構造的に類似しており、酸素と硫黄の位置が本質的に逆になっています。 [21]アプリシタビンは他のNRTIと比較してin vitroでの効力はやや劣るものの、NRTI耐性変異を有するHIV-1変異株の広範囲に対して活性を維持しています。アプリシタビンは、NRTI治療経験のある患者の治療薬として臨床開発の最終段階にあります。[6]
エルブシタビン(L-d4FC)
エルブシタビンは、ジドブジンやラミブジンを含む他のヌクレオシド類似体に耐性を持つHIVに対して活性を持つデオキシシチジン類似体である。[22]これは、細胞内でその三リン酸代謝物の細胞内濃度が高くなることが一因である。[6]エルブシタビンの臨床試験は、一部の患者で骨髄抑制が見られ、投与開始後2日でCD4+細胞数が減少するため、中断されている。 [22] [29]
アムドキソビル(DAPD)
アムドキソビルは、良好なバイオアベイラビリティを有するグアノシンアナログNRTIのプロドラッグである。[6] [22] [29]細胞内でアデノシンデアミナーゼによって脱アミノ化され、ジオキソラングアニン(DXG)となる。この薬剤の活性型であるDXG三リン酸は、DAPD三リン酸よりも高い活性を示す。[22]アムドキソビルは現在、フェーズII臨床試験中である。[24] [29]
ラシビル(RCV)
ラシビルは、エムトリシタビン(FTC)の2つのβ-エナンチオマー((-)-FTCと(+)-FTC)のラセミ混合物です。ラシビルは優れた経口バイオアベイラビリティを有し、1日1回の服用で済むという利点があります。ラシビルは2種類のNRTIとの併用が検討されており、併用時に有望な抗ウイルス活性を示しています。ラシビルは現在、第II相臨床試験中です。[6] [22] [29]
| 薬剤候補 | アプリシタビン | エルブシタビン | アムドキソビル | ラシビル |
|---|---|---|---|---|
| 化学構造 | 
|

|

|

|
| 開発段階 | 臨床開発の最終段階 | 保留中 | フェーズII | フェーズII |
開発中のNRTIは他にもいくつかあります。スポンサーが治験薬(IND)申請を提出しているか、FDAに承認されているか、あるいは臨床試験の様々な段階にあります。開発中のNRTIの中には、様々な魅力的な薬理特性を示すものがあり、新薬を必要とする患者の治療に望ましいものとなる可能性があります。[6] [22] [29]
参照
- 抗レトロウイルス薬
- CCR5受容体拮抗薬の発見と開発
- 非ヌクレオシド系逆転写酵素阻害剤の発見と開発
- HIVプロテアーゼ阻害剤の発見と開発
- CCR5受容体拮抗薬の発見と開発
- HIV/AIDS研究
- 逆転写酵素阻害剤
- プロテアーゼ阻害剤
- エントリーインヒビター
参考文献
- ^ Merson, MD; Michael, H. (2006)、「HIV-AIDSパンデミック25周年 — 世界的な対応」、ニューイングランド医学ジャーナル、354 (23): 2414– 2417、doi : 10.1056/NEJMp068074、PMID 16760441、S2CID 2579436
- ^ Fausi, AS (1999)、「21世紀のエイズ流行に関する考察」、ニューイングランド医学ジャーナル、351 (14): 1046– 1050、doi : 10.1056/NEJM199909303411406、PMID 10502595
- ^ abc Fauci, AS (2003)、「HIVとAIDS:20年の科学」、Nature Medicine、9 (7): 839– 843、doi : 10.1038/nm0703-839、PMID 12835701、S2CID 5472960、ProQuest 223114463
- ^ abc De-Clercq, E. (2009)、「抗HIV薬:HIV発見後25年以内に承認された25種類の化合物」、International Journal of Antimicrobial Agents、33 (4): 307– 320、doi :10.1016/j.ijantimicag.2008.10.010、PMID 19108994
- ^ ab Boyer, PL; Coffin, JM; Delviks_Frankenberry, KA; Hughes, SH; Jeren, A.; Nikolenko, GN; Pathak, VK (2008)「HIV-1逆転写酵素結合サブドメイン変異はテンプレートRNAの分解を減少させ、AZT除去を促進する」米国科学アカデミー紀要、105 (31): 10943– 10948、Bibcode :2008PNAS..10510943D、doi : 10.1073/pnas.0804660105、PMC 2491488、PMID 18667707
- ^ abcdefghijkl Cihlar, T.; Ray, AS (2010)、「ヌクレオシド系およびヌクレオチド系HIV逆転写酵素阻害剤:ジドブジンから25年後」、Antiviral Research、85 (1): 39– 58、doi :10.1016/j.antiviral.2009.09.014、PMID 19887088
- ^ ab Herschorn, A.; Hizi (2008)、「レトロウイルス逆転写酵素(HIV-1およびマウス白血病ウイルスのもの以外):分子および生化学的特性の比較」、Virus Research、134(1–2):203–220、doi:10.1016/j.virusres.2007.12.008、PMID 18291546
- ^ abc Giridhar, R.; Prajapati, DG; Ramajayam, R.; Yadav, MR (2009)「強力な低分子NNRTIの探索:レビュー」、Bioorganic & Medicinal Chemistry、17 (16): 5744– 5762、doi :10.1016/j.bmc.2009.06.060、PMID 19632850
- ^ abc Anderson, KS (2007)、「HIV-1パンデミックの逆転写」、The FASEB Journal、21 (14): 3795– 3808、doi : 10.1096/fj.07-8697rev、PMID 17639073、S2CID 24960391
- ^ ab Goldschmidt, V.; Marquet, R. (2004)、「HIV-1逆転写酵素によるプライマーブロック解除とヌクレオシドRT阻害剤への耐性」、国際生化学・細胞生物学誌、36 (9): 1687– 1705、doi :10.1016/j.biocel.2004.02.028、PMID 15183338
- ^ Kakuda, TN (2010), 「ヌクレオシドおよびヌクレオチド逆転写酵素阻害剤によるミトコンドリア毒性の薬理学」、臨床治療学、22 (6): 2717– 2747、doi :10.1016/S0149-2918(00)90004-3、PMID 10929917
- ^ Herschorn, A.; Hizi, A. (2010)、「レトロウイルス逆転写酵素」、細胞および分子生命科学、67 (16): 2717– 2747、doi :10.1007/s00018-010-0346-2、PMC 11115783、PMID 20358252、S2CID 6954555
- ^ ab Sneader, W. (1996), 『薬物のプロトタイプとその活用』John Wileys & Sons, pp. 448– 450, ISBN 978-0-471-94847-6
- ^ abc Smith, J.; William, Hywel (1998)、Smith and Williams´ Introduction to the fundamentals of drug design and action (3 ed.)、Harwood academic publishers、pp. 247– 250, 486– 490、ISBN 978-90-5702-037-7
- ^ ab Saunders, J. (2000),トップドラッグ:トップ合成ルート、pp. 71– 75
- ^ abcde Sneader, W. (2005), 創薬の歴史, Wiley, pp. 250– 268, ISBN 978-0-471-89979-2
- ^ Georgiev, VS (2009), 国立アレルギー・感染症研究所, NIH, vol. 2, pp. 417– 426, doi :10.1007/978-1-60327-297 (2025年7月12日現在休止), ISBN 978-1-60327-296-4
{{citation}}: CS1 maint: DOI inactive as of July 2025 (link) - ^ abc De-Clercq, E. (2009)、「抗HIV薬:HIV発見後25年以内に承認された25種類の化合物」、International Journal of Antimicrobial Agents、33 (4): 307– 320、doi :10.1016/j.ijantimicag.2008.10.010、PMID 19108994
- ^ ab Brunton, L.; Lazo, J.; Parker, K. (2006), Goodman & Gilman's The Pharmacological Basis of Therapeutics, Eleventh Edition , McGraw-Hill, pp. 1280– 1292, ISBN 978-0-07-142280-2
- ^ ab Ogden, RC; Skowron, G. (2006), HIV/AIDS治療における逆転写酵素阻害剤、Humana press inc、pp. 33– 63、ISBN 978-1-58829-649-8
- ^ abcd LaFemina, RL (2009) 「抗ウイルス薬の発見における抗ウイルス研究戦略」 AMSプレス、pp. 51– 70
- ^ abcdefg Otto, MJ (2003)、「HIV感染症治療のための新規ヌクレオシド逆転写酵素阻害剤」、Current Opinion in Pharmacology、9 (7): 839– 843、doi :10.1016/j.coph.2004.06.001、PMID 15351346
- ^ ab Fung, HB; Piacenti, FJ; Stone, EA (2002)、「テノホビルジソプロキシルフマル酸塩:HIV感染症治療のためのヌクレオチド逆転写酵素阻害剤」、臨床治療学、24 (10): 1515– 1548、doi :10.1016/S0149-2918(02)80058-3、PMID 12462284
- ^ abc Nguyen-Ba, N.; Rando, RF (2000)、「HIV-1の薬剤耐性株に対する新規ヌクレオシド類似体の開発」、Drug Discovery Today、5 (10): 465– 476、doi :10.1016/s1359-6446(00)01558-0、PMID 11018598
- ^ Arnold, E.; Dasa, K.; Hughesc, SH; Lewib, PJ (2005)、「結晶構造解析と抗エイズ薬の設計:非ヌクレオシド系HIV-1逆転写酵素阻害剤の設計における構造柔軟性と位置適応性の重要性」(PDF)、Progress in Biophysics and Molecular Biology、88 (2): 209– 231、doi :10.1016/j.pbiomolbio.2004.07.001、PMID 15572156、 2006年1月30日に オリジナル(PDF)からアーカイブ、 2010年11月3日取得
- ^ abc Delviks-Frankenberry, KA; Nikolenko, GN; Patakar, VK (2010)「HIV薬剤耐性とRNase Hの「関連性」」、ウイルス、2 (7): 1476– 1503、doi : 10.3390/v2071476、PMC 2982141、PMID 21088701
- ^ abcd Kirby, KA; Marchand, B.; Michailidis, E.; Sarafianos, SG; Singh, K. (2010)「薬剤耐性とHIV-1逆転写酵素阻害の構造的側面」、ウイルス、2 (2): 606– 638、doi : 10.3390/v2020606、PMC 2850067、PMID 20376302
- ^ Bowling, TL; Gu, Z.; L´Heureux, L.; Muys, JM; Nguyen-Ba, N.; Rando, RF; Wainberg, MA (1999)「感受性および薬剤耐性ヒト免疫不全ウイルス1型変異体に対する1',3'-ジオキソラニルプリンヌクレオシド類似体の作用機序およびインビトロ活性」Antimicrobial Agents and Chemotherapy , 43 (10): 2376– 2382, doi :10.1128/AAC.43.10.2376, PMC 89486 , PMID 10508010
- ^ abcdef Agrawala, RK; Krishnan, PN; Raman, S.; Ravichandran, S.; Veerasamy, R. (2008)、「HIV-1逆転写酵素阻害剤の概要」(PDF)、Digest Journal of Nanomaterials and Biostructures、3 (4): 171– 187、 2011年7月20日時点のオリジナル(PDF)からアーカイブ