二硫酸
 | |
 | |
| 名前 | |
|---|---|
| IUPAC名 二硫酸[ 1 ] | |
| その他の名前 ピロ硫酸、発煙硫酸 | |
| 識別子 | |
| |
3Dモデル(JSmol) | |
| チェビ |
|
| ケムスパイダー |
|
| ECHA 情報カード | 100.029.069 |
| EC番号 |
|
| メッシュ | ピロ硫酸 |
PubChem CID | |
| ユニイ | |
CompToxダッシュボード(EPA) | |
| |
| |
| プロパティ | |
| H 2 O 7 S 2 | |
| モル質量 | 178.13 g·mol −1 |
| 外観 | 無色 |
| 融点 | 36℃(97℉; 309K) |
| 酸性度( p Ka ) | 2.5 (20 ℃ ;濃硫酸)[ 2 ] |
| 共役塩基 | 二硫酸塩 |
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。 | |
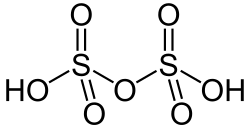
二硫酸(別名:disulphuric acid)またはピロ硫酸(別名: pyrosulphuric acid)は、発煙硫酸とも呼ばれ、硫黄オキソ酸の一種である。[ 3 ]発煙硫酸(発煙硫酸)の主成分であり、多くの化学者はこの名称でこの酸を目にする。X線結晶構造解析によって確認されたように、この分子は一対のSO 2 (OH)基が酸素原子で結合しており、[ 4 ]分子式はH 2 O 7 S 2となる。
反応
また、平衡のため、 液体無水硫酸の微量成分でもある。
- H 2 SO 4 (l) ⇌ H 2 O(l) + SO 3 (g)
- SO 3 (g) + H 2 SO 4 (l) ⇌ H 2 S 2 O 7 (l)
全体的な方程式は次のようになります。
- 2H 2 SO 4 (l) ⇌ H 2 O(l) + H 2 S 2 O 7 (l)
この酸は、過剰の三酸化硫黄(SO 3)と硫酸を反応させることによって製造されます。
- H 2 SO 4 (l) + SO 3 (g) → H 2 S 2 O 7 (l)
二硫酸は、酸無水物の硫酸類似体です。硫酸の各単位が隣接する単位に対して相互に電子吸引作用を及ぼすため、酸性度が著しく高まります。二硫酸は、(無水)硫酸溶媒系中の「通常の」硫酸をプロトン化するのに十分な強さを持っています。二硫酸には、一般にピロ硫酸塩と呼ばれる塩(例えば、ピロ硫酸カリウム)があります。
一般式 H 2 O·(SO 3 ) xで表される他の関連酸も存在しますが、どれも単離することはできません。
参照
参考文献
- ^国際純正応用化学連合(2005).無機化学命名法(IUPAC勧告2005年)ケンブリッジ(英国): RSC – IUPAC . ISBN 0-85404-438-8. p. 130.電子版。
- ^ Perrin, D. D.編 (1982) [1969].水溶液中の無機酸および塩基のイオン化定数. IUPAC化学データ(第2版). オックスフォード:ペルガモン(1984年出版). 62番. ISBN 0-08-029214-3。LCCN 82-16524。
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Chemistry of the Elements (第2版). Butterworth-Heinemann . doi : 10.1016/C2009-0-30414-6 . ISBN 978-0-08-037941-8。
- ^ヴォルフガング・ヘンレ (1991). 「298 KにおけるH2S2O7の結晶構造」。Zeitschrift für Kristallographie - 結晶材料。196 ( 1-4 )。土井:10.1524/zkri.1991.196.14.279。S2CID 101311329。


