酵素触媒
酵素触媒とは、生物学的分子である「酵素」によって、あるプロセスの速度が上昇することです。ほとんどの酵素はタンパク質であり、そのようなプロセスのほとんどは化学反応です。酵素内では、一般的に触媒作用は活性部位と呼ばれる局所的な部位で起こります。
ほとんどの酵素は主にタンパク質で構成されており、単一のタンパク質鎖、または複数のサブユニットからなる複合体を形成しています。酵素は、金属イオンや補因子(例:アデノシン三リン酸)と呼ばれる特殊な有機分子などの非タンパク質成分も組み込むことがよくあります。多くの補因子はビタミンであり、ビタミンとしての役割は、代謝における生物学的プロセスの触媒としての利用に直接結びついています。 細胞内の生化学反応の触媒は極めて重要です。なぜなら、代謝に必須の反応の多くは、触媒されない場合、非常に遅い速度しか示さないからです。タンパク質進化の原動力の一つは、このような触媒活性の最適化ですが、最も重要な酵素のみが触媒効率の限界付近で機能し、多くの酵素は最適な状態からは程遠い状態にあります。酵素触媒における重要な要素には、一般的な酸・塩基触媒、軌道制御、エントロピー制限、配向効果(すなわち、鍵と鍵穴のような触媒作用)、そしてタンパク質のダイナミクスに関わる運動効果などがあります[ 1 ]。
酵素触媒のメカニズムは多岐にわたりますが、反応物(または基質)と生成物を隔てるエネルギー障壁の低減が重要な要素であるという点で、他の種類の化学触媒と原理的にはすべて類似しています。活性化エネルギー(E a )の低減により、この障壁を乗り越えて生成物を形成できる反応物分子の割合が増加します。重要な原則は、酵素は生成物と反応物の間のエネルギー障壁を低減するだけであるため、常に両方向の反応を触媒し、反応を前進させたり平衡位置に影響を与えたりすることはできず、平衡状態が達成される速度のみに影響を与えるという点です。他の触媒と同様に、酵素は(基質のように)反応によって消費または変化せず、単一の酵素が多数回の触媒反応を行うようにリサイクルされます。
酵素は多くの場合、非常に特異性が高く、特定の基質にのみ作用します。場合によっては、1つの基質だけに作用することもあります。また、基特異性を示す酵素もあり、ペプチド結合のように、類似する化学基には作用しますが、同一ではない場合もあります。多くの酵素は立体化学的特異性を有し、ある立体異性体には作用しますが、別の立体異性体には作用しません。[ 2 ]
誘導適合
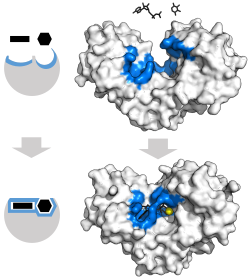

酵素-基質相互作用の古典的なモデルは誘導適合モデルである。[ 3 ]このモデルは、酵素と基質の間の初期の相互作用は比較的弱いが、これらの弱い相互作用が酵素の 構造変化を急速に誘発し、結合を強化すると提唱している。
誘導適合機構の利点は、強力な酵素結合による安定化効果によって生じる。基質結合には、強い基質結合を伴う均一結合と、強い遷移状態結合を伴う差動結合の2つの機構がある。均一結合の安定化効果は基質と遷移状態の両方の結合親和性を高めるのに対し、差動結合は遷移状態結合親和性のみを高める。酵素はどちらも利用しており、反応の活性化エネルギーを最小化するために進化的に選択されたものである。飽和、すなわち基質結合親和性の高い酵素は、活性化エネルギーを低減するために差動結合を必要とするが、基質結合の小さい酵素は差動結合または均一結合のいずれかを利用する可能性がある。[ 4 ]
これらの効果により、ほとんどのタンパク質は活性化エネルギーを低減するために差動結合機構を利用するようになり、そのためほとんどの基質は遷移状態において酵素に対して高い親和性を示します。差動結合は誘導適合機構によって行われます。つまり、基質は最初に弱く結合し、その後酵素は構造を変化させて遷移状態への親和性を高め、遷移状態を安定化させます。これにより、遷移状態に到達するための活性化エネルギーが低下します。
しかし、誘導適合の概念は触媒作用を合理化するために用いることはできないことを明確にしておくことが重要です。つまり、化学触媒作用は、水中(酵素なし)での無触媒反応におけるE a ‡に対するE a ‡(系が既にES ‡にある場合)の減少として定義されます。誘導適合は、酵素の閉環体では障壁が低いことを示唆するだけで、障壁減少の理由を説明できません。
誘導適合は、競合やノイズが存在する状況でも、コンフォメーション校正機構を介して分子認識の忠実性を高めるのに役立つ可能性がある。[ 5 ]
代替反応経路のメカニズム
これらの構造変化により、活性部位の触媒残基は、反応中に変化する基質の化学結合に近づきます。結合後、1つまたは複数の触媒機構が反応の遷移状態のエネルギーを低下させ、反応に代替の化学経路を提供します。「障壁を越える」触媒機構と「障壁を通り抜ける」触媒機構には、以下の6つの可能性が考えられます。
近接性と方向
酵素-基質相互作用は、反応性化学基を最適な形状に整列させ、近接させ、反応速度を高めます。これにより反応物のエントロピーが低下し、2つの反応物が1つの生成物となることで全体のエントロピーが減少するため、付加反応や転移反応の不利な点が軽減されます。しかし、これは一般的な効果であり、非付加反応や転移反応においても、試薬の「有効濃度」の増加によって生じます。濃度の増加が反応速度の増加につながる仕組みを考えれば、このことが理解できます。基本的に、反応物がより濃縮されると、それらはより頻繁に衝突し、したがってより頻繁に反応します。酵素触媒において、試薬が酵素に結合することで、反応物の配座空間が制限され、それらは「適切な配向」で互いに近接した状態に保たれます。その結果、それらはより頻繁に、そして正しい形状で衝突し、目的の反応が促進されます。「有効濃度」とは、反応物が溶液中で自由状態にある場合に、同じ衝突頻度を経験するために必要な濃度です。多くの場合、このような理論上の有効濃度は非物理的であり、現実には実現不可能です。これは、多くの酵素の触媒力が優れており、触媒されていない状態に比べて速度が大幅に増加していることを証明しています。
| 例えば: |
| 反応が分子内であれば、同様の反応がはるかに速く起こります。 |
 |
| 分子内反応における酢酸の有効濃度は、 k 2 /k 1 = 2 x 10 5モルと推定できます。 |
しかし、状況はより複雑である可能性がある。なぜなら、現代の計算研究では、近接効果の従来の例は酵素のエントロピー効果に直接関連付けることはできないことが確立されているからである。[ 6 ] [ 7 ] [ 8 ]また、当初のエントロピー提案[ 9 ]は、触媒に対する配向エントロピーの寄与を大幅に過大評価していることが判明している。[ 10 ]
プロトン供与体または受容体
プロトン供与体と受容体、すなわち酸と塩基は、遷移状態において発生する電荷を安定化するためにプロトンを供与したり受容したりします。これは、エネルギー障壁を低減するという触媒作用の全体的原理に関連しています。なぜなら、一般的に遷移状態は高エネルギー状態であり、遷移状態を安定化させることでこの高エネルギーが低下し、障壁が低下するからです。多くの非生物触媒に対する酵素触媒の重要な特徴は、酸触媒と塩基触媒の両方を同じ反応で組み合わせることができることです。多くの非生物系において、酸(大きな[H+])または塩基(高濃度のH+シンク、または電子対を持つ種)は反応速度を上昇させます。しかし、当然のことながら、環境は全体的なpH(酸性度または塩基性度(アルカリ度)の尺度)を1つしか持ちません。しかし、酵素は大きな分子であるため、活性部位に酸性基と塩基性基の両方を配置して基質と相互作用することができ、バルクpHに依存せずに両方のモードを利用することができます。
求核基および/または求電子基を活性化するため、あるいは脱離基を安定化するために、一般的な酸触媒または塩基触媒がしばしば用いられます。グルタミン酸、アスパラギン酸、ヒスチジン、シスチン、チロシン、リジン、アルギニン、セリン、スレオニンなど、酸性または塩基性基を持つ多くのアミノ酸が活性部位でこの触媒作用を受けます。さらに、カルボニル基およびアミド基を持つペプチド骨格もよく用いられます。シスチンとヒスチジンは、どちらもpKaが中性pHに近いため、プロトンの受容と供与の両方が可能であるため、非常によく利用されます。
酸塩基触媒を伴う多くの反応機構は、pKaが大きく変化すると想定しています。このpKaの変化は、残基の局所環境によって可能になります。
| 条件 | 酸 | 基地 |
|---|---|---|
| 疎水性環境 | pKaを上げる | pKaを下げる |
| 同じ電荷を持つ隣接する残基 | pKaを上げる | pKaを下げる |
| 塩橋(および水素結合)の形成 | pKaを下げる | pKaを上げる |
pKa は周囲の環境によっても大きく影響され、溶液中で塩基性を示す残基がプロトン供与体として作用する可能性があり、その逆も同様です。
| 例えば: |
| セリンプロテアーゼの触媒三元 |
 |
| セリンプロテアーゼの触媒機構の最初のステップは、活性部位のヒスチジンがセリン残基からプロトンを受け取ることです。これにより、セリンは求核剤として準備され、基質のアミド結合を攻撃します。この機構には、塩基の局所的環境によって可能となる、セリン(塩基、pKa 14)からヒスチジン(酸、pKa 6)へのプロトン供与が含まれます。 |
pKaの変化は静電的メカニズムの純粋な一部である。[ 11 ]上記の例における触媒効果は、主にオキシアニオンのpKaの低下とヒスチジンのpKaの上昇に関連しており、セリンからヒスチジンへのプロトン移動は律速障壁ではないため、顕著に触媒されない。[ 12 ]示された例では、ヒスチジン共役酸が、その後の四面体中間体からのアミンの脱離に対する一般的な酸触媒として作用することに注意されたい。しかしながら、この提案されたメカニズムを支持する証拠(文献13の図4)[ 13 ]は、異論が唱えられている。[ 14 ]
静電触媒
荷電遷移状態の安定化は、活性部位の残基が中間体とイオン結合(または部分的なイオン電荷相互作用)を形成することによっても起こり得ます。これらの結合は、リジン、アルギニン、アスパラギン酸、グルタミン酸などのアミノ酸に見られる酸性または塩基性側鎖、あるいは亜鉛などの金属補因子に由来します。金属イオンは特に効果的で、水のpKaを十分に低下させ、効果的な求核剤とすることができます。
体系的なコンピュータシミュレーション研究により、静電効果が触媒作用に最も大きく寄与していることが明らかにされており[ 11 ]、反応速度を最大10 7倍まで増加させることができる[ 15 ]。特に、酵素は水よりも極性の高い環境を提供し、イオン性の遷移状態は固定された双極子によって安定化されることが分かっている。これは、水分子がイオン状態と荷電状態を安定化するために「再配置エネルギー」[ 16 ]を支払わなければならない水中の遷移状態の安定化とは大きく異なる。したがって、触媒作用は酵素の極性基が事前に配置されているという事実と関連している。[ 17 ]
酵素の活性部位によって及ぼされる静電場の大きさは、酵素の触媒速度の増大と高い相関関係にあることが示されている。[ 18 ]
基質の結合は通常、活性部位から水を排除し、局所的な誘電率を有機溶媒の誘電率まで低下させます。これにより、荷電/極性基質と活性部位との間の静電相互作用が強化されます。さらに、活性部位周辺の電荷分布は、触媒反応の遷移状態を安定化するように配置されていることが研究で示されています。いくつかの酵素では、これらの電荷分布が極性基質を結合部位へと誘導する役割を果たし、その結果、酵素反応の速度が見かけ上の拡散律速限界を超えていると考えられます。
| 例えば: |
| カルボキシペプチダーゼの触媒機構 |
 |
| 四面体中間体は、Zn 2+イオンと酸素の負電荷との間の部分的なイオン結合によって安定化されます。 |
共有結合触媒
共有結合触媒は、基質が酵素活性部位の残基または補因子と一時的な共有結合を形成する反応である。これにより、反応に新たな共有結合中間体が追加され、反応の後の遷移状態のエネルギーを低下させる。反応の後の段階で、この共有結合は酵素を再生するために切断されなければならない。この機構は、キモトリプシンやトリプシンなどのプロテアーゼなどの触媒三位一体の酵素によって利用され、アシル酵素中間体が形成される。別の機構としては、解糖系におけるアルドラーゼ酵素に見られるように、リジン残基からの遊離アミンを用いたシッフ塩基形成がある。
一部の酵素は、ピリドキサールリン酸(PLP)やチアミンピロリン酸(TPP)などの非アミノ酸補因子を利用して、反応分子と共有結合中間体を形成します。 [ 19 ] [ 20 ]このような共有結合中間体は、活性部位のアミノ酸残基と形成された共有結合中間体が安定化を可能にするのと同様に、後の遷移状態のエネルギーを低下させる働きがありますが、補因子の能力により、酵素はアミノ酸側鎖残基だけでは不可能な反応を行うことができます。このような補因子を利用する酵素には、PLP依存性酵素アスパラギン酸トランスアミナーゼやTPP依存性酵素ピルビン酸脱水素酵素などがあります。[ 21 ] [ 22 ]
共有結合触媒は、反応経路の活性化エネルギーを下げるのではなく、反応の代替経路(共有結合中間体経由)を提供するため、真の触媒とは異なる。 [ 11 ]例えば、キモトリプシン中のセリン分子への共有結合のエネルギー特性は、触媒されていない溶液反応におけるよく知られた求核剤への共有結合と比較されるべきである。真の共有結合触媒(障壁が溶液中の対応する障壁よりも低い)は、例えば、酵素基による遷移状態への部分的な共有結合(例えば、非常に強い水素結合)を必要とするが、そのような効果は触媒に大きく寄与しない。
金属イオン触媒
活性部位の金属イオンは、電荷安定化と遮蔽を協調させることで触媒作用に関与する。金属は正電荷を持つため、金属イオンを介して安定化できるのは負電荷のみである。[ 23 ]しかし、金属イオンはpH変化の影響を受けないため、生物学的触媒作用において有利である。[ 24 ]金属イオンはルイス酸として作用し、水をイオン化する作用もある。[ 25 ]金属イオンは酸化還元剤としても作用する。[ 26 ]
結合ひずみ
これは誘導適合結合の主な効果であり、酵素の遷移状態への親和性が基質自体への親和性よりも高い場合に生じます。これにより構造再配置が誘発され、基質結合は遷移状態の立体配座に近い位置へと変形します。これにより、基質と遷移状態の間のエネルギー差が低下し、反応の触媒作用が促進されます。
しかし、歪み効果は、実際には、遷移状態の安定化効果ではなく、基底状態の不安定化効果である。[ 11 ] [ 27 ]さらに、酵素は非常に柔軟であり、大きな歪み効果を適用することができない。[ 28 ]
基質内の結合ひずみに加えて、活性部位の残基を活性化するために酵素自体内でも結合ひずみが誘発される可能性があります。
| 例えば: |
| リゾチームの基質、結合基質、および遷移状態の立体配座。 |
 |
| 基質は結合すると、ヘキソース環の半椅子型配座(タンパク質のアミノ酸の立体障害により赤道位のc6が軸方向に位置するため)から椅子型配座へと変形し、[ 29 ]遷移状態と形状が類似する。 |
量子トンネル効果
これらの従来の「障壁越え」機構は、「障壁通過」機構(量子トンネル効果)のモデルや観測によって、いくつかのケースで疑問視されてきました。一部の酵素は、古典的なΔG ‡によって予測されるよりも速い速度で作用します。「障壁通過」モデルでは、プロトンまたは電子が活性化障壁をトンネルすることができます。[ 30 ] [ 31 ]プロトンの量子トンネル効果は、芳香族アミン脱水素酵素によるトリプタミン酸化において観察されています。[ 32 ]
量子トンネル効果は、溶液中の触媒反応と非触媒反応におけるトンネル効果の寄与が同程度であることから、大きな触媒的利点をもたらすようには見えない。[ 31 ] [ 33 ] [ 34 ] [ 35 ]しかし、トンネル効果の寄与(典型的には、古典的な「障壁を越える」経路の反応速度と比較して、反応速度定数を約1000倍に高める[ 32 ])は、生物の生存にとって非常に重要であると考えられる。これは、生物学におけるトンネル反応の一般的な重要性を強調するものである。
1971年から1972年にかけて、酵素触媒の最初の量子力学モデルが策定されました。[ 36 ] [ 37 ]
活性酵素
酵素-基質複合体の結合エネルギーは、基質活性化に必要な外部エネルギーとはみなせない。高エネルギー酵素は、まず特定のエネルギー基X 1を酵素の触媒部位から最初の結合反応物の最終部位へ転移させ、次に2番目の結合反応物(あるいは単独反応物の2番目の基)から別の基X 2を活性部位へ転移させ、基質から生成物への変換と酵素再生を完了させる必要がある。[ 38 ]
酵素反応全体を 2 つのカップリング反応として表すことができます。
| S 1 + EX 1 → S 1 EX 1 → P 1 + EP 2 | 1 |
| S 2 + EP 2 → S 2 EP 2 → P 2 + EX 2 | 2 |
反応( 1 )から、活性酵素の基X 1が生成物中に現れるのは、酵素内部での交換反応の可能性により、静電阻害と原子間の反発を回避するためであることが分かる。したがって、活性酵素を酵素反応の強力な反応物として表す。反応( 2 )では、基質の基X 2が酵素内部に残留しているため、基質の不完全な変換を示している。このアプローチは、仮説的な極めて高い酵素変換率(触媒的に完全な酵素)に依拠するものとして以前に提案されていた。[ 39 ]
本アプローチの検証において極めて重要な点は、触媒が酵素と反応の転移基との複合体でなければならないという点である。この化学的側面は、いくつかの酵素反応のよく研究された機構によって裏付けられている。セリンプロテアーゼファミリーのよく研究されているメンバーである、純粋タンパク質α-キモトリプシン(補因子なしで作用する酵素)によって触媒されるペプチド結合加水分解反応を考えてみよう([ 40 ]参照)。
この反応の実験結果を 2 つの化学ステップとして示します。
| S 1 + EH → P 1 + EP 2 | 3 |
| EP 2 + H−O−H → EH + P 2 | 4 |
ここで、S 1はポリペプチド、P 1およびP 2は生成物である。最初の化学ステップ(3)では、共有結合したアシル酵素中間体の形成が行われる。2番目のステップ(4)は脱アシル化ステップである。ここで重要なのは、酵素には存在するが水中には存在しないH+基が、加水分解ステップの前に生成物中に出現することである。したがって、これは酵素反応における追加の基とみなすことができる。
したがって、反応(3)は、酵素が反応の強力な反応物として作用することを示しています。提案された概念によれば、酵素からのH輸送は、最初の反応物の変換、すなわち最初の初期化学結合(P 1基とP 2基の間)の分解を促進します。加水分解の段階は、2番目の化学結合の分解と酵素の再生をもたらします。
提案された化学機構は、媒体中の基質や生成物の濃度に依存しない。しかし、濃度の変化は主に反応(1)と(2)の第一段階と最終段階で自由エネルギー変化を引き起こす。これは、水溶液中のS分子であれP分子であれ、あらゆる分子の自由エネルギー含量の変化によるものである。このアプローチは、以下の筋収縮機構と一致している。骨格筋におけるATP加水分解の最終段階は、ミオシン頭部とアクチンの会合によって引き起こされる生成物の放出である。[ 41 ]会合反応中のアクチン結合溝の閉鎖は、ミオシン活性部位のヌクレオチド結合ポケットの開口と構造的に連動している。[ 42 ]
特に、ATP加水分解の最終段階には、リン酸の急速な放出とADPの緩やかな放出が含まれる。[ 43 ] [ 44 ] リン酸アニオンは分子量が小さいため、結合したADPアニオンから水溶液へのリン酸アニオンの放出は、発熱反応と考えられる。
したがって、無機リン酸H 2 PO 4 −の一次放出は、ATP加水分解の自由エネルギーの大部分を溶媒和リン酸の運動エネルギーに変換し、能動流動を生み出すという結論に達する。この局所的な機械化学的変換の仮定は、筋力がATP加水分解によって生じる能動流動の統合作用から生じるというティロシュの筋収縮メカニズムと一致する。[ 45 ] [ 46 ]
触媒機構の例
実際には、ほとんどの酵素機構はいくつかの異なるタイプの触媒の組み合わせを伴います。
トリオースリン酸イソメラーゼ
トリオースリン酸イソメラーゼ(EC 5.3.1.1)は、2つのトリオースリン酸異性体であるジヒドロキシアセトンリン酸とD-グリセルアルデヒド3-リン酸の可逆的な相互変換を触媒します。
トリプシン
トリプシン(EC 3.4.21.4)は、共有結合触媒を実行する触媒トライアドと遷移状態での電荷蓄積を安定させるオキシアニオンホールを使用して、リジンまたはアルギニン残基の後のタンパク質基質を切断するセリンプロテアーゼです。
アルドラーゼ
アルドラーゼ(EC 4.1.2.13 )は、フルクトース1,6-ビスリン酸(F-1,6-BP)をグリセルアルデヒド3-リン酸とジヒドロキシアセトンリン酸(DHAP )に分解する反応を触媒します。
酵素の拡散率
2010年代に単一分子研究が始まったことで、基質濃度と反応エンタルピーの上昇に伴って、非結合酵素の運動が増加することが観察されました。[ 47 ]その後の観察では、この拡散率の増加は酵素の質量中心の一時的な変位によって引き起こされ、「酵素を推進する反動効果」をもたらすことが示唆されています。[ 48 ]
反応の類似性
酵素反応間の類似性(EC )は、結合変化、反応中心、または部分構造メトリクス( EC-BLAST Archived 30 May 2019 at the Wayback Machine )を使用して計算できます。[ 49 ]
参照
- 触媒三位一体
- 酵素アッセイ
- 酵素阻害剤
- 酵素反応速度論
- 酵素の乱交
- タンパク質ダイナミクス
- 擬酵素は、触媒活性がないにもかかわらず、その普遍性からオーミックな意味合いを示唆している。
- 量子トンネル効果
- タンパク質分解マップ
- 時間分解結晶構造解析
参考文献
- ^ Kamerlin SC, Warshel A (2010年5月). 「21世紀の幕開け:ダイナミクスは酵素触媒を理解するためのミッシングリンクか?」 . Proteins . 78 ( 6): 1339– 1375. doi : 10.1002/prot.22654 . PMC 2841229. PMID 20099310 .
- ^ Laidler KJ (1978).物理化学とその生物学的応用. Benjamin/Cummings. p. 427. ISBN 978-0-8053-5680-9。
- ^ Koshland DE (1958年2月). 「酵素特異性理論のタンパク質合成への応用」 .米国科学アカデミー紀要. 44 (2): 98–104 . Bibcode : 1958PNAS...44...98K . doi : 10.1073 /pnas.44.2.98 . PMC 335371. PMID 16590179 .

- ^アンスリンEV、ダハティDA(2006年)『現代の物理有機化学』大学科学図書。ISBN 978-1-891389-31-3。
- ^ Savir Y, Tlusty T (2007年5月). Scalas E (編). 「コンフォメーション校正:コンフォメーション変化が分子認識の特異性に与える影響」 . PLOS ONE . 2 (5): e468. Bibcode : 2007PLoSO...2..468S . doi : 10.1371/journal.pone.0000468 . PMC 1868595. PMID 17520027 .

- ^ Stanton RV, Peräkylä M, Bakowies D, Kollman PA (1998). 「酵素と溶液中の反応を研究するためのab initio法と自由エネルギー計算の組み合わせ:トリプシンと水溶液中のアミド加水分解」. J. Am. Chem. Soc . 120 (14): 3448– 3457. Bibcode : 1998JAChS.120.3448S . doi : 10.1021/ja972723x .
- ^ Kuhn B, Kollman PA (2000). 「カテコールO-メチルトランスフェラーゼのQM-FEおよび分子動力学計算:酵素および水溶液中の活性化自由エネルギーと酵素触媒反応の位置選択性」J. Am. Chem. Soc . 122 (11): 2586– 2596. doi : 10.1021/ja992218v .
- ^ Bruice TC, Lightstone FC (1999). 「分子内反応および酵素反応の速度に対する基底状態と遷移状態の寄与」. Acc. Chem. Res . 32 (2): 127– 136. doi : 10.1021/ar960131y .
- ^ Page MI, Jencks WP (1971年8月). 「酵素反応および分子内反応における速度加速へのエントロピー寄与とキレート効果」 .米国科学アカデミー紀要. 68 (8): 1678–1683 . Bibcode : 1971PNAS...68.1678P . doi : 10.1073 /pnas.68.8.1678 . PMC 389269. PMID 5288752 .
- ^ Warshel A, Parson WW (2001年11月). 「生化学および生物物理学的反応のダイナミクス:コンピュータシミュレーションからの洞察」. Quarterly Reviews of Biophysics . 34 (4): 563– 679. doi : 10.1017/s0033583501003730 . PMID 11852595. S2CID 28961992 .
- ^ a b c d Warshel A, Sharma PK, Kato M, Xiang Y, Liu H, Olsson MH (2006年8月). 「酵素触媒の静電的基礎」. Chemical Reviews . 106 (8): 3210– 3235. Bibcode : 2006ChRv..106.3210W . doi : 10.1021/cr0503106 . PMID 16895325 .
- ^ Warshel A, Naray-Szabo G, Sussman F, Hwang JK (1989年5月). 「セリンプロテアーゼは実際どのように機能するのか?」生化学. 28 (9): 3629– 3637. doi : 10.1021/bi00435a001 . PMID 2665806 .
- ^ Fersht AR, Requena Y (1971年12月). 「α-キモトリプシン触媒によるアミドの加水分解機構.kcとKmのpH依存性.中間体の速度論的検出」. Journal of the American Chemical Society . 93 (25): 7079– 7087. doi : 10.1021/ja00754a066 . PMID 5133099 .
- ^ Zeeberg B, Caswell M, Caplow M (1973年4月). 「キモトリプシン触媒における律速段階の変化に関する報告について」. Journal of the American Chemical Society . 95 (8): 2734– 2735. Bibcode : 1973JAChS..95.2734Z . doi : 10.1021/ja00789a081 . PMID 4694533 .
- ^ Voet D、Voet JG (2011).生化学。ジョン・ワイリー&サンズ。OCLC 808679090。
- ^ Marcus RA (1965). 「電子移動反応の理論について. VI. 均一系反応と電極反応の統一的取り扱い」(PDF) . J. Chem. Phys . 43 (2): 679– 701. Bibcode : 1965JChPh..43..679M . doi : 10.1063/1.1696792 .
- ^ Warshel A (1978年11月). 「酵素触媒のエネルギー論」 .米国科学アカデミー紀要. 75 (11): 5250–5254 . Bibcode : 1978PNAS...75.5250W . doi : 10.1073 / pnas.75.11.5250 . PMC 392938. PMID 281676 .
- ^ Fried SD, Bagchi S, Boxer SG (2014年12月). 「極限電界がケトステロイドイソメラーゼの活性部位における触媒作用を促進する」 . Science . 346 ( 6216). ニューヨーク, NY: 1510–4 . Bibcode : 2014Sci...346.1510F . doi : 10.1126/science.1259802 . PMC 4668018. PMID 25525245 .
- ^ Toney, MD「ピリドキサール酵素の反応特異性」生化学・生物理学アーカイブ(2005)433: 279-287
- ^ “Micronutrient Information Center, Oregon State University” . 2015年3月21日時点のオリジナルよりアーカイブ。2009年9月30日閲覧。
- ^ Voet D、Voet JG (2004)。生化学。 John Wiley & Sons Inc.、 986 ~ 989ページ 。ISBN 978-0-471-25090-6。
- ^ Voet D、Voet JG (2004)。生化学。 John Wiley & Sons Inc.、 604 ~ 606ページ 。ISBN 978-0-471-25090-6。
- ^ Piccirilli JA, Vyle JS, Caruthers MH, Cech TR (1993年1月). 「テトラヒメナリボザイム反応における金属イオン触媒作用」. Nature . 361 ( 6407): 85– 88. Bibcode : 1993Natur.361...85P . doi : 10.1038/361085a0 . PMID 8421499. S2CID 4326584 .
- ^ Bender ML (1962年1月1日). 「溶液中における求核有機反応の金属イオン触媒作用」.配位子の反応. 化学の進歩. 第37巻. アメリカ化学会. pp. 19– 36. doi : 10.1021/ba-1963-0037.ch002 . ISBN 978-0-8412-0038-8。
{{cite book}}:ISBN / 日付の非互換性(ヘルプ) - ^ Fife TH, Przystas TJ (1985年2月1日). 「ピコリン酸エステルの加水分解における二価金属イオン触媒作用。金属イオン促進水酸化物イオンおよび水触媒反応」. Journal of the American Chemical Society . 107 (4): 1041– 1047. Bibcode : 1985JAChS.107.1041F . doi : 10.1021/ja00290a048 . ISSN 0002-7863 .
- ^ Stadtman ER (1990年1月1日). 「金属イオン触媒によるタンパク質の酸化:生化学的メカニズムと生物学的影響」 .フリーラジカル生物学&医学. 9 (4): 315– 325. doi : 10.1016/0891-5849(90)90006-5 . PMID 2283087 .
- ^ Jencks WP (1987) [1969].触媒化学と酵素学. McGraw-Hillシリーズ先端化学(復刻版). ニューヨーク: Dover Publications . ISBN 978-0-486-65460-7。
- ^ Warshel A, Levitt M (1976年5月). 「酵素反応の理論的研究:リゾチーム反応における炭酸イオンの誘電的、静電的、および立体的安定化」. Journal of Molecular Biology . 103 (2): 227– 249. doi : 10.1016/0022-2836(76)90311-9 . PMID 985660 .

- ^ Voet D, Voet JG, Pratt CW (2013). 『生化学の基礎:分子レベルでの生命』(第4版). ホーボーケン, ニュージャージー: Wiley. ISBN 978-0-470-54784-7。
- ^ Garcia-Viloca M, Gao J, Karplus M, Truhlar DG (2004年1月). 「酵素の働き:現代速度論とコンピュータシミュレーションによる解析」. Science . 303 ( 5655): 186– 195. Bibcode : 2004Sci...303..186G . doi : 10.1126/science.1088172 . PMID 14716003. S2CID 17498715 .
- ^ a b Olsson MH, Siegbahn PE, Warshel A (2004年3月). 「リポキシゲナーゼにおける水素原子移動の大きな運動学的同位体効果と温度依存性のシミュレーション」アメリカ化学会誌. 126 (9): 2820– 2828. Bibcode : 2004JAChS.126.2820O . doi : 10.1021/ja037233l . PMID 14995199 .
- ^ a b Masgrau L, Roujeinikova A, Johannissen LO, Hothi P, Basran J, Ranaghan KE, et al. (2006年4月). 「プロトントンネル効果によって支配される酵素反応の原子論的記述」. Science . 312 ( 5771): 237– 241. Bibcode : 2006Sci...312..237M . doi : 10.1126/science.11 26002. PMID 16614214. S2CID 27201250 .
- ^ Hwang JK, Warshel A (1996). 「酵素触媒における量子力学的核運動の重要性」. J. Am. Chem. Soc . 118 (47): 11745– 11751. Bibcode : 1996JAChS.11811745H . doi : 10.1021/ja962007f .
- ^ Ball P (2004年9月). 「酵素:偶然か、それとも設計によるものか?」 . Nature . 431 ( 7007): 396– 397. Bibcode : 2004Natur.431..396B . doi : 10.1038/431396a . PMID 15385982. S2CID 228263 .
- ^ Olsson MH, Parson WW, Warshel A (2006年5月). 「酵素触媒への動的寄与:一般的な仮説の批判的検証」. Chemical Reviews . 106 (5): 1737– 1756. doi : 10.1021/cr040427e . PMID 16683752 .
- ^ Vol'kenshtein MV, Dogonadze RR, Madumarov AK, Urushadze ZD, Kharkats YI (1972). 「酵素触媒の理論」.分子生物学. 6 (3). モスクワ: 347– 353. PMID 4645409 .
- ^ Volkenshtein MV、Dogonadze RR、Madumarov AK、Urushadze ZD、Kharkats Yu I (1973)。 「酵素触媒における電子的および立体的相互作用」。Konformatsionnie Izmenenia Biopolimerov v Rastvorakh。モスクワ:ナウカ出版社。153~ 157ページ 。
- ^ Foigel AG (2011年6月) . 「酵素は生化学反応の強力な反応物か?」分子細胞生化学. 352 ( 1–2 ): 87– 89. doi : 10.1007/s11010-011-0742-4 . PMID 21318350. S2CID 11133081 .
- ^ Fogel AG (1982年8月). 「酵素反応の協同性とエネルギー変換の分子的側面」.分子細胞生化学. 47 (1): 59– 64. doi : 10.1007/bf00241567 . PMID 7132966. S2CID 21790380 .
- ^ Hengge AC, Stein RL (2004年1月). 「酵素触媒におけるタンパク質立体配座移動の役割:特定のペプチド基質によるα-キモトリプシンのアシル化」.生化学. 43 (3): 742– 747. doi : 10.1021/bi030222k . PMID 14730979 .
- ^ Lymn RW, Taylor EW (1971年12月). 「アクトミオシンによるアデノシン三リン酸の加水分解のメカニズム」.生化学. 10 (25): 4617– 4624. doi : 10.1021/bi00801a004 . PMID 4258719 .
- ^ Holmes KC, Angert I, Kull FJ, Jahn W, Schröder RR (2003年9月). 「電子クライオ顕微鏡法は、ミオシンとアクチンの強力な結合がヌクレオチドを放出する様子を示している」. Nature . 425 ( 6956): 423– 427. Bibcode : 2003Natur.425..423H . doi : 10.1038/nature02005 . PMID 14508495. S2CID 2686184 .
- ^ Siemankowski RF, Wiseman MO, White HD (1985年2月). 「アクトミオシンサブフラグメント1からのADP解離は、脊椎動物の筋肉における無負荷時の短縮速度を制限するのに十分遅い」 . Proceedings of the National Academy of Sciences of the United States of America . 82 (3): 658– 662. Bibcode : 1985PNAS ...82..658S . doi : 10.1073/pnas.82.3.658 . PMC 397104. PMID 3871943 .
- ^ White HD, Belknap B, Webb MR (1997年9月). 「ウサギ骨格筋アクトミオシンによるヌクレオシド三リン酸の切断とリン酸放出の速度論、新規リン酸蛍光プローブを用いて測定」.生化学. 36 (39): 11828– 11836. doi : 10.1021/bi970540h . PMID 9305974 .
- ^ Tirosh R, Low WZ, Oplatka A (1990年3月). 「レーザー光散乱のドップラー広がり測定による、重メロミオシンおよびMgATP存在下におけるアクチンフィラメントの並進運動」Biochimica et Biophysica Acta (BBA) - タンパク質構造と分子酵素学. 1037 (3): 274– 280. doi : 10.1016/0167-4838(90)90025-b . PMID 2178685 .
- ^ Tirosh R (2006). 「生体エネルギー変換における弾道プロトンとマイクロ波誘起水溶液(ソリトン)」 . Int. J. Mol. Sci . 7 (9): 320– 345. doi : 10.3390/i7090320 .
- ^ Muddana HS, Sengupta S, Mallouk TE, Sen A, Butler PJ (2010年2月). 「基質触媒作用による単一酵素拡散の促進」. Journal of the American Chemical Society . 132 (7): 2110– 2111. Bibcode : 2010JAChS.132.2110M . doi : 10.1021/ja908773a . PMC 2832858. PMID 20108965 .

- ^ Riedel C, Gabizon R, Wilson CA, Hamadani K, Tsekouras K, Marqusee S, et al. (2015年1月). 「触媒回転中に放出される熱は酵素の拡散を促進する」 . Nature . 517 (7533): 227– 230. Bibcode : 2015Natur.517..227R . doi : 10.1038/nature14043 . PMC 4363105. PMID 25487146 .

- ^ Rahman SA, Cuesta SM, Furnham N, Holliday GL, Thornton JM (2014年2月). 「EC-BLAST:酵素反応を自動検索・比較するツール」 . Nature Methods . 11 (2): 171– 174. doi : 10.1038/nmeth.2803 . PMC 4122987. PMID 24412978 .
さらに読む
- Fersht A (1998). 『タンパク質科学における構造と機構:酵素触媒とタンパク質フォールディングへのガイド』ニューヨーク:WH Freeman. ISBN 978-0-7167-3268-6。
- Sutcliffe M, Munro A (2006年8月). 「酵素における量子触媒作用 ― 遷移状態理論を超えて」 . Philosophical Transactions B. 361 ( 1472): 1291–1455 . doi : 10.1098/rstb.2006.1879 . PMC 1647302 .
外部リンク
 ウィキメディア・コモンズの酵素触媒関連メディア
ウィキメディア・コモンズの酵素触媒関連メディア


