妊娠免疫寛容、あるいは母体免疫寛容とは、妊娠中に胎児と胎盤に対して示される免疫寛容のことです。この寛容は、自然流産の場合のように、通常は体内の異物に対する拒絶反応を引き起こす免疫反応に対抗します。[1] [2]これは生殖免疫学の分野で研究されています。
メカニズム
胎盤のメカニズム
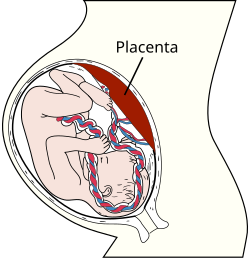
胎盤は母体と胎児の間に免疫学的バリアとして機能し、免疫学的に特権的な部位を形成します。この目的のために、胎盤はいくつかのメカニズムを用いています。
- ホスホコリン分子を含むニューロキニンBを分泌する。これは寄生性線虫が宿主の免疫系による検出を回避するために用いるのと同じメカニズムである。[3]
- また、胎児には小さなリンパ球抑制細胞が存在し、インターロイキン2への反応を阻害することで母体の細胞傷害性T細胞を阻害します。[2]
- 胎盤栄養芽細胞は、体内の他のほとんどの細胞とは異なり、古典的なMHCクラスIアイソタイプであるHLA-AおよびHLA-Bを発現しません。これは、胎児のHLA-AおよびHLA-B分子を異物と認識する母体細胞傷害性T細胞による破壊を防ぐためだと考えられています。一方、胎盤栄養芽細胞は非典型的なMHCクラスIアイソタイプであるHLA-EおよびHLA-Gを発現しており、これは母体ナチュラルキラー細胞による破壊を防ぐためだと考えられています。ナチュラルキラー細胞は、MHCクラスIを発現していない細胞を破壊するためです。 [4]しかし、栄養芽細胞はむしろ典型的なHLA-Cを発現します。[4]
- 発育中の胎児と母体との間の遊走性免疫細胞の交換を制限するため、細胞間に細胞外空間のない合胞体を形成する(上皮細胞だけでは不十分で、特定の血液細胞は隣接する上皮細胞の間に挿入できるように特殊化している)。細胞の融合は、共生する内因性レトロウイルスのウイルス融合タンパク質によって引き起こされると思われる。[5]免疫回避作用は、ウイルスタンパク質の初期の正常な挙動であり、感染した細胞と融合するだけでウイルスが他の細胞に拡散できるようにするためであった。現代の胎生哺乳類の祖先はこのウイルスに感染した後に進化し、胎児が母親の免疫系に抵抗できるようにしたと考えられている。[6]
それでも、胎盤は母体の免疫グロブリン G (IgG) が胎児に移行して感染から保護することを可能にします。しかし、これらの抗体は胎児細胞を標的としません。ただし、胎児の物質が胎盤を通過して母体のB 細胞と接触し、それらの B 細胞が胎児の標的に対する抗体を産生し始めるような場合は別です。母親は異種のABO 血液型に対する抗体を産生し、胎児の血液細胞が標的となる可能性がありますが、これらの既成の抗体は通常免疫グロブリン M型であるため、[7]、通常は胎盤を通過しません。それでも、まれに、ABO 不適合によって胎盤を通過する IgG 抗体が生じることがあり、これは母親 (通常は血液型 O) が A 抗原および B 抗原と相同性のある食品または細菌中の抗原に感作されることによって引き起こされます。[8]
その他のメカニズム
しかし、胎盤関門は免疫系を回避する唯一の手段ではなく、胎盤関門の反対側の母体循環にも胎児の外来細胞が残存している。[9]
胎盤は母親のIgG抗体をブロックしないため、IgG抗体はヒトの胎盤を通過し、胎児に感染症に対する免疫保護を提供します。
妊娠の非常に初期に寛容を誘導するモデルの一つに、真獣類胎児胚防御システム(eu-FEDS)仮説がある。[10] eu-FEDS仮説の基本的な前提は、生殖系に存在し配偶子に発現する可溶性糖タンパク質と細胞表面結合糖タンパク質の両方が、起こりうる免疫反応を抑制し、胎児の拒絶反応を阻害するというものである。[10] eu-FEDSモデルはさらに、特定の炭水化物配列(オリゴ糖)がこれらの免疫抑制性糖タンパク質に共有結合し、免疫反応を抑制する「官能基」として機能することを示唆している。ヒトのeu-FEDSモデルに関連する主要な子宮と胎児の糖タンパク質には、α-フェトプロテイン、CA125、グリコデリンA(胎盤タンパク質14としても知られる)などがある。
制御性T細胞も役割を果たしている可能性が高い。[11]
また、細胞性免疫から体液性免疫への移行が起こると考えられています。[12]
不十分な許容度
自然流産の多くは母体移植拒絶反応と同様に説明でき[2]、慢性的な免疫寛容不全は不妊症を引き起こす可能性がある。妊娠中の免疫寛容不全の他の例としては、 Rh疾患や妊娠中毒症が挙げられる。
- Rh疾患は、母親が胎児の赤血球上のRhD抗原に対する抗体(IgG抗体を含む)を産生することで発症します。母親がRh陰性で胎児がRh陽性で、以前の妊娠で少量のRh陽性血液が母親の循環系に入り、母親の体内でD抗原に対するIgG抗体(抗D抗体)が産生された場合に発症します。母親のIgG抗体は胎盤を通過して胎児に移行し、IgG抗体の量が十分であればD陽性胎児赤血球の破壊を引き起こし、胎児・新生児溶血性疾患(HDFN)の抗Rh型を発症します。一般的に、HDFNはRh不適合妊娠を繰り返すごとに悪化します。
- 子癇前症の原因の一つは、胎盤に対する異常な免疫反応です。パートナーの精液への曝露が子癇前症の予防に有効であるという確固たる証拠があり、これは主に精液中に存在するいくつかの免疫調節因子の吸収によるものです。[13] [14]
卵子提供による妊娠では、卵子提供者が実母よりも胎児との遺伝的類似性が低いため、妊娠高血圧症候群や胎盤病変の発生率が高くなります。[15]局所的および全身的な免疫学的変化も通常の妊娠よりも顕著であるため、卵子提供におけるいくつかの疾患の頻度が高いのは、母親の免疫寛容性の低下が原因である可能性が示唆されています。[15]
不妊と流産
免疫学的反応は、多くの不妊症や流産の原因となる可能性があります。不妊症に寄与する免疫学的因子としては、生殖自己免疫不全症候群、抗リン脂質抗体、抗核抗体などが挙げられます。
抗リン脂質抗体は細胞膜のリン脂質を標的としています。研究により、ホスファチジルセリン、ホスファチジルコリン、ホスファチジルグリセロール、ホスファチジルイノシトール、ホスファチジルエタノールアミンに対する抗体は、前胚を標的とすることが示されています。ホスファチジルセリンとホスファチジルエタノールアミンに対する抗体は、栄養膜を標的としています。[16] これらのリン脂質は、胎児の細胞が着床時に子宮の細胞に付着し続けるために不可欠です。女性がこれらのリン脂質に対する抗体を持っている場合、免疫反応によって破壊され、最終的に胎児は子宮に付着し続けることができなくなります。また、これらの抗体は子宮への血流を変化させ、子宮の健康を危険にさらします。 [16]
抗核抗体は子宮に炎症を引き起こし、胚の着床に適した環境を阻害します。ナチュラルキラー細胞は胎児細胞を癌細胞と誤認して攻撃します。生殖自己免疫不全症候群を呈する人は、体内の抗核抗体値の上昇により、原因不明の不妊症、子宮内膜症、反復流産を経験します。 [16]抗リン脂質抗体と抗核抗体はどちらも胚の着床に毒性作用を及ぼします。これは抗甲状腺抗体には当てはまりません。抗体値の上昇は毒性作用を及ぼしませんが、流産のリスクを示唆します。抗甲状腺抗体値の上昇は、 Tリンパ球機能不全の女性を示す指標となります。なぜなら、これらの値は、子宮壁に炎症を誘発するサイトカインを大量に分泌しているT細胞を示しているからです。[16]
しかし、現在のところ、母体の免疫反応を阻害することで流産を予防するという証拠のある薬剤は存在せず、アスピリンもこの場合には効果がありません。[17]
感染感受性の増加
免疫寛容度の増加は、妊娠中の感染症に対する感受性と重症度の増加に大きく寄与すると考えられています。[18]妊婦は、例えばインフルエンザ、E型肝炎、単純ヘルペス、マラリアなどの感染症にかかりやすく、重症化しやすい傾向があります。[18]コクシジオイデス症、麻疹、天然痘、水痘については、証拠が限られています。[18]妊娠はワクチン接種の予防効果に変化をもたらさないようです。[18]
異種間妊娠
胎児の拒絶免疫のメカニズムが解明されれば、例えば人間の代理母の代わりに豚が人間の胎児を妊娠するといった異種間妊娠が可能になるかもしれない。[19]
参考文献
- ^ Williams, Zev (2012年9月20日). 「妊娠に対する寛容性の誘導」. New England Journal of Medicine . 367 (12): 1159– 1161. doi :10.1056/NEJMcibr1207279. PMC 3644969. PMID 22992082 .
- ^ abc Clark DA, Chaput A, Tutton D (1986年3月). 「妊娠マウスにおける宿主対移植片反応の能動的抑制 VII. CBA/Jマウスの子宮内における同種CBA/J x DBA/2胎児の自然流産は、非T細胞抑制細胞の活性低下と相関する」J. Immunol . 136 (5): 1668–75 . doi : 10.4049/jimmunol.136.5.1668 . PMID 2936806. S2CID 22815679.
- ^ 「胎盤は体の防御を欺く」BBCニュース、2007年11月10日。
- ^ ab 母体・胎児医学:原理と実践 31~32ページ。編集者:Robert K. Creasy、Robert Resnik、Jay D. Iams。ISBN 978-0-7216-0004-8発行:2003年9月
- ^ Mi S, Lee X, Li X, et al. (2000年2月). 「Syncytinはヒト胎盤形態形成に関与するレトロウイルスエンベロープタンパク質である」. Nature 403 ( 6771): 785–9 . Bibcode :2000Natur.403..785M. doi :10.1038/35001608. PMID 10693809. S2CID 4367889.
- ^ Luis P. Villarreal (Sep 2004). "Can Viruses Make Us Human?" (PDF). Proceedings of the American Philosophical Society. 148 (3): 314. Archived from the original (PDF) on 2005-03-02.
- ^ Magnetic immunodiagnostic method for the demonstration of antibody/antigen complexes especially of blood groups Archived 2012-02-29 at the Wayback Machine Yves Barbreau, Olivier Boulet, Arnaud Boulet, Alexis Delanoe, Laurence Fauconnier, Fabien Herbert, Jean-Marc Pelosin, Laurent Soufflet. October 2009
- ^ MSD manuals > Perinatal Anemia Last full review/revision Oct 2020
- ^ Williams Z, Zepf D, Longtine J, et al. (March 2008). "Foreign fetal cells persist in the maternal circulation". Fertil. Steril. 91 (6): 2593–5. doi:10.1016/j.fertnstert.2008.02.008. PMID 18384774.
- ^ a b Clark GF, Dell A, Morris HR, Patankar MS, Easton RL (2001). "The species recognition system: a new corollary for the human fetoembryonic defense system hypothesis". Cells Tissues Organs (Print). 168 (1–2): 113–21. doi:10.1159/000016812. PMID 11114593. S2CID 22626737.
- ^ Trowsdale J, Betz AG (March 2006). "Mother's little helpers: mechanisms of maternal-fetal tolerance". Nat. Immunol. 7 (3): 241–6. doi:10.1038/ni1317. PMID 16482172. S2CID 33530468.
- ^ Jamieson DJ, Theiler RN, Rasmussen SA. Emerging infections and pregnancy. Emerg Infect Dis. 2006 Nov. Available from https://www.cdc.gov/ncidod/EID/vol12no11/06-0152.htm
- ^ Robertson, Sarah. "Research Goals / Role of seminal fluid signalling in the female reproductive tract". Archived from the original on 2012-03-29.
- ^ Sarah A. Robertson; John J. Bromfield; Kelton P. Tremellen (August 2003). "Seminal 'priming' for protection from pre-eclampsia—a unifying hypothesis". Journal of Reproductive Immunology. 59 (2): 253–265. doi:10.1016/S0165-0378(03)00052-4. PMID 12896827.
- ^ a b Van Der Hoorn, M. L. P.; Lashley, E. E. L. O.; Bianchi, D. W.; Claas, F. H. J.; Schonkeren, C. M. C.; Scherjon, S. A. (Nov–Dec 2010). "Clinical and immunologic aspects of egg donation pregnancies: a systematic review". Human Reproduction Update. 16 (6): 704–12. doi:10.1093/humupd/dmq017. PMID 20543201.
- ^ a b c d Gronowski, Ann M (2004), Handbook of Clinical Laboratory Testing During Pregnancy, Humana Press, ISBN 978-1-58829-270-4
- ^ Kaandorp, S. P.; Goddijn, M. T.; Van Der Post, J. A. M.; Hutten, B. A.; Verhoeve, H. R.; Hamulyák, K.; Mol, B. W.; Folkeringa, N.; Nahuis, M.; Papatsonis, D. N. M.; Büller, H. R.; Van Der Veen, F.; Middeldorp, S. (29 April 2010). "Aspirin plus Heparin or Aspirin Alone in Women with Recurrent Miscarriage". New England Journal of Medicine. 362 (17): 1586–1596. doi:10.1056/NEJMoa1000641. PMID 20335572.
- ^ a b c d Kourtis, Athena P.; Read, Jennifer S.; Jamieson, Denise J. (5 June 2014). "Pregnancy and Infection". New England Journal of Medicine. 370 (23): 2211–2218. doi:10.1056/NEJMra1213566. ISSN 0028-4793. PMC 4459512. PMID 24897084.
- ^ Darwin's children LeVay, Simon. (1997, October 14). from The Free Library. (1997). Retrieved March 06, 2009