多成分系におけるギブス吸着等温線は、表面と接触する成分の濃度変化と表面張力の変化(表面エネルギーの変化に対応)を関連付ける式である。二成分系の場合、表面過剰に関するギブス吸着式は次のようになる。
どこ
吸着
[編集]界面における様々な影響により、表面近傍の層の構成が変化する可能性がある。[ 1 ] 物質は表面近くに蓄積するか、逆にバルク内に移動する。[ 1 ]分子の動きは吸着 現象の特徴である。吸着は表面張力とコロイドの安定性の変化に影響を与える。液体分散媒質の表面にある吸着層は、媒質中の分散粒子の相互作用に影響を与える可能性があり、その結果、これらの層はコロイドの安定性に重要な役割を果たす可能性がある。[ 2 ]液相分子の界面への吸着は、この液相が他の混和しない相(気体、液体、固体など)と接触しているときに起こる。[ 3 ]
方程式の概念的説明
[編集]表面張力は、表面の面積を(引き伸ばしたり歪ませたりすることで)広げることの難しさを表します。表面張力が高い場合、表面積を増やすには大きな自由エネルギーが必要となるため、表面は収縮してゴムシートのようにくっついてしまう傾向があります。
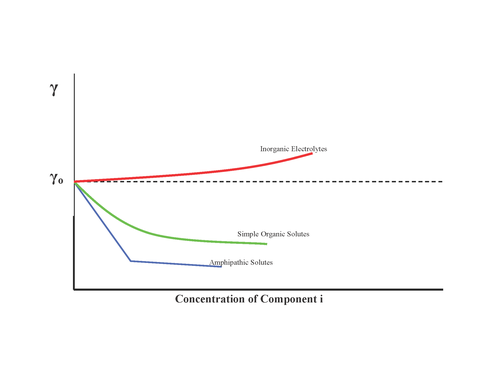
表面張力に影響を与える要因は様々ですが、その一つは、表面の組成がバルクと異なる場合があることです。例えば、水に少量の界面活性剤(例えばハンドソープ)を混ぜると、バルクの水は99%が水分子、1%が石鹸分子で構成されますが、水の最表面は50%が水分子、50%が石鹸分子で構成されることがあります。この場合、石鹸は大きく正の「表面過剰」を持ちます。他の例では、表面過剰は負になる場合があります。例えば、水に塩化ナトリウムなどの無機塩を混ぜると、水の表面は平均してバルク平均よりも塩分が 少なく、より純粋になります。
少量の石鹸を含む水の例をもう一度考えてみましょう。水面は全体よりも高い石鹸濃度を持つ必要があるため、水の表面積が増加するたびに、石鹸分子を全体から取り除き、新しい表面に追加する必要があります。石鹸の濃度が少しでも高くなると、石鹸分子はより容易に利用できる(化学ポテンシャルが高い)ため、新しい表面を作るために石鹸分子を全体から引き抜きやすくなります。新しい表面を作りやすくなるため、表面張力は低下します。一般的な原理は次のとおりです。
- 成分の表面過剰が正の場合、その成分の化学ポテンシャルが増加すると表面張力が低下します。
次に、塩を含む水の例を考えてみましょう。水の表面積は水全体よりも塩分濃度が低いため、水の表面積が増加すると、新しい表面から塩分子を取り除き、水全体へと押し込む必要があります。塩濃度が少しでも高まると(塩の化学ポテンシャルが上昇すると)、塩分子を押し出すのが難しくなります。新しい表面を作りにくくなるため、表面張力は高くなります。一般的な原理は以下のとおりです。
- 成分の表面過剰が負の場合、その成分の化学ポテンシャルが増加すると表面張力が増加します。
ギブス等温線方程式は、これらの傾向の正確な定量的関係を示します。
表面の位置と表面過剰の定義
[編集]
表面の位置
[編集]2 つの相 ( αとβ )が存在する場合、表面 ( 表面相 ) は相 αと相βの間に位置します。実験的には、複数の溶質を含むバルク液相と接触している不均一な表面相の正確な構造を決定することは困難です。[ 2 ] 表面相の不均一性は、モル比の変化によって生じます。[ 1 ]ジョサイア・ウィラード・ギブス が提唱したモデルでは、表面相は厚さがゼロの理想化されたモデルであると提案されました。実際には、α 相とβ相のバルク領域は一定ですが、界面領域の成分の濃度は距離 x にわたってαのバルク濃度からβのバルク濃度まで徐々に変化します。これは、距離 x が値 0 になる理想化されたギブス モデルとは対照的です。右の図は、実際のモデルと理想化されたモデルの違いを示しています。
表面過剰の定義
[編集]理想化されたモデルでは、α相とβ相の化学成分は、分割面に近づくときを除いて変化しません。[ 3 ]実際のシステムモデルでは、バルク相で は任意の成分(例:水、エチレングリコールなど)の総モル数は一定ですが、以下に示すように表面相では変化します。

しかし、実際の系では、成分の総モル数は分割面の任意の配置によって変化する。i番目の成分の吸着の定量的な尺度は、表面過剰量によって捉えられる。[ 1 ]表面過剰量は、系中のi番目の成分 の総モル数と特定の相(αまたはβ )中のi番目の成分のモル数との差を表し、以下のように表される。
ここで、Γ iはi番目の成分の表面積、nはモル、αとβは位相、Aは分割面積です。
Γは、バルク濃度が表面まで均一に存在すると仮定した場合の、表面単位面積あたりの溶質過剰量を表し、正、負、またはゼロの値をとります。単位はmol/m 2です。
相対的表面過剰
[編集]相対表面過剰量は、任意の表面過剰量よりも有用である。[ 3 ] 相対表面過剰量は、バルク相中の溶媒への界面吸着を関連付ける。相対表面過剰量を使用する利点は、分離面の位置に依存しないことである。したがって、種iと溶媒1の相対表面過剰量は以下の通りである。
ギブスの吸着等温線式
[編集]ギブス吸着式の導出
[編集]α相とβ相が平衡状態にあり、面Sによって相が分割されている2相系の場合、系の 全ギブス自由エネルギーは次のように表すことができます。
ここで、Gはギブスの自由エネルギーです。
ギブスの吸着等温線の式は、「均質な一次形式におけるオイラーの定理の熱力学への特殊化」から導くことができる。[ 4 ] 各相α、相β、表面相のギブスの自由エネルギーは、次の式で表すことができる。
ここで、 Uは内部エネルギー、pは圧力、Vは体積、Tは温度、Sはエントロピー、μ iはi番目の成分の化学ポテンシャルです。
α相、β相、表面相 のギブス方程式のオイラー形の全微分をとると、次の式が得られます。
ここで、 Aは分割面積、γは表面張力です。
可逆プロセスの場合、熱力学の第一法則により次のことが求められます。
ここで、qは熱エネルギー、wは仕事です。
上記の式をギブスエネルギー方程式の全微分に代入し、その結果γd Aを利用すると、表面エネルギーを考慮した場合の非圧力体積仕事に等しくなります。
多成分系のギブスエネルギーの基本方程式を利用することによって:
α相、β相、表面相 を関係付ける式は次のようになります。
バルク相(α相、β相)を考慮すると、一定の温度と圧力での平衡において、ギブス・デュエムの式は次のようになります。
結果として得られる式はギブスの吸着等温線式です。
ギブスの吸着等温線は、溶液の表面張力と溶質の濃度を 結び付ける吸着等温線と考えることができる方程式です。
2 つの成分を含む 2 成分系の場合、表面過剰に関するギブス吸着方程式は次のようになります。
表面張力と表面過剰濃度の関係
[編集]溶液中の種iの化学ポテンシャルは、その活性に応じて次の式で表される:[ 2 ]
ここで 、 は基準状態におけるi番目の成分の化学ポテンシャル、 Rは気体定数、Tは温度です。
化学ポテンシャル方程式を微分すると次のようになります。
ここで、 fは成分iの活量係数、Cはバルク相中の 種iの濃度です。
α相とβ相の溶液が希薄(特定の成分iが豊富)な場合、成分iの活性係数は1に近づき、ギブス等温線は次のようになります。
上記の式はインターフェースが二次元であると仮定していますが、これは必ずしも正しくありません。グッゲンハイムなどの他のモデルでは、この欠陥が修正されています。
イオン解離効果
[編集]電解質吸着に関するギブス方程式
[編集]次のように完全に解離する有機電解質 RNaz と無機電解質 NaCl を含む水で構成されたシステムを考えます。
相対表面過剰に関するギブス吸着方程式は次のようになります。
表面張力と表面過剰濃度の関係は次のようになります。
ここで、mはギブス吸着係数である。[ 3 ] m の値はヘルムホルツ、グイ、スターンの二重層(界面)モデルを用いて計算される。
したがって、ギブス等温線は無機塩の表面濃度が負であると予測します。しかしながら、この見解は近年、より精密な界面感受性実験と理論モデルの組み合わせによって広く疑問視されています。どちらの実験でも、ハロゲン化物のサイズと分極率の増加に伴い、表面への吸着傾向が増加すると予測されています。[ 5 ]そのため、表面張力は、空気と水の界面に向かうイオンの相対的な吸着傾向を決定するための信頼できる方法ではありません。
モデルの妥当性を証明するには、表面濃度を決定する方法が必要です。通常は、偏光解析法と界面活性剤分子内に存在する 14 Cの崩壊を追跡するという2 つの異なる手法が使用されます。
イオン界面活性剤のギブス等温線
[編集]- 余分な電解質がない場合
ここで、は対イオンを考慮に入れない界面活性剤分子の表面濃度を指します。
- 電解質を添加した場合
実験方法
[編集]
液体界面における吸着の程度は、表面張力濃度データとギブスの吸着式を用いて評価することができる。[ 3 ]ミクロトームブレード法は、界面の重量とモル濃度を決定するために使用される。この方法では、ミクロトームブレードを用いて二成分溶液の気液界面の1平方メートル部分を採取する。
空気と水の界面での吸着の程度を測定するもう一つの方法はエマルジョン法であり、これを用いて水に対する相対的な表面積過剰を推定することができる。[ 3 ]
さらに、水溶液中の表面活性成分のギブス表面積過剰は、放射性トレーサー法を用いて測定することができます。表面活性成分は通常、炭素14または硫黄35で標識されます。[ 3 ]
参考文献
[編集]- ^ a b c d Shchukin、ED、Pertsov、AV、Amelina EA および Zelenev、AS コロイドおよび表面化学。第1版メビウス D. とミラー R. Vol. 12. アムステルダム: Elsevier Science BV 2001。
- ^ a b c Hiemenz, Paul C.およびRajagopalan, Raj. コロイドおよび表面化学の原理. 第3版. ニューヨーク: Marcel Dekker, Inc, 1997.
- ^ a b c d e f g Chattoraj, DKおよびBirdi, KS「吸着とギブス表面過剰」ニューヨーク:Plenum Publishing Company、1984年。
- ^ Callen, Herbert B. 『熱力学とサーモスタティックス入門』第2版、カナダ:John Wiley & Sons, Inc, 1985年。
- ^ Petersen, Poul B.; Saykally, Richard J. (2006). 「液体水表面におけるイオンの性質について」. Annual Review of Physical Chemistry . 57 (1): 333– 364. doi : 10.1146/annurev.physchem.57.032905.104609 .