有機化学において、イミドは窒素に結合した2つのアシル基からなる官能基です。[1]これらの化合物は構造的に酸無水物に関連していますが、イミドは加水分解に対してより耐性があります。商業用途では、イミドはポリイミドと呼ばれる高強度ポリマーの成分として最もよく知られています。無機イミドは固体または気体化合物としても知られており、イミド基(=NH)は配位子としても機能します
例
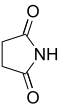
簡単な例としては、化学式HN(COCH 3 ) 2で表されるジアセトアミドが挙げられます。これは正式にはアンモニアのジアセチル化誘導体です。しかし、一般的に見られるイミドは環状であり、ジカルボン酸から誘導されます。一般的な例としては、コハク酸とアンモニアから誘導されるスクシンイミドがあります。これらの環状イミドの名前は、親酸を反映しています。[2]
多くのイミドは、アンモニアではなく第一級アミンから誘導されます。これらは接頭辞にN置換基が付くことで示されます。例えば、N-エチルコハク酸イミドは、コハク酸とエチルアミンから誘導されます。
環状イミド[3] n 一般名 系統名 構造 PubChem 親酸 構造 2 コハク酸イミド ピロリジン-2,5-ジオン 
11439 コハク酸 
2つの不飽和、シス型の炭素-炭素二重結合 マレイミド ピロール-2,5-ジオン 
10935 マレイン酸 
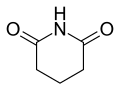
3 グルタルイミド ピペリジン-2,6-ジオン 
70726 グルタル酸 
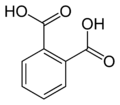
6 フタルイミド イソインドール-1,3-ジオン 
6809 フタル酸 
性質
イミドは極性が高いため、極性有機溶媒によく溶けます。構造的に近い酸無水物とは異なり、加水分解に強く、沸騰水から 再結晶できるものもあります
アンモニア由来のイミドのN-H中心は酸性であり、水素結合に関与することができる。NH基はマレイミドの場合と同様に弱酸性であり、pKaは10と推定される。[4]
発生と応用
多くの高強度または導電性ポリマーは、イミドサブユニット、すなわちポリイミドを含んでいます。一例として、カプトンが挙げられます。カプトンでは、繰り返し単位が芳香族テトラカルボン酸由来の2つのイミド基で構成されています。[5]ポリイミドのもう1つの例として、ポリグルタルイミドが挙げられます。これは通常、ポリメチルメタクリレート(PMMA)とアンモニアまたは第一級アミンを原料とし、高温高圧下でのPMMAのアミノリシスと環化反応によって、通常は押出機を用いて製造されます。この技術は反応性押出と呼ばれます。PMMAのメチルアミン誘導体をベースとした市販のポリグルタルイミド製品であるKamaxは、ローム・アンド・ハース社によって製造されました。これらの材料の靭性は、イミド官能基の剛性を反映しています。
イミド含有化合物の生理活性への関心は、シクロヘキシミドが特定の生物におけるタンパク質生合成阻害剤として高い生理活性を示すという初期の発見に端を発しています。副作用で知られるサリドマイドは、この研究の成果の一つです。多くの殺菌剤や除草剤にもイミド基が含まれています。例えば、特定の条件下で発がん性があるとされるキャプタンやプロシミドンなどが挙げられます。[6]

21 世紀には、サリドマイドの免疫調節効果に新たな関心が寄せられ、免疫調節イミド薬(IMiD)として知られる免疫調節剤のクラスが誕生しました。
製造
最も一般的なイミドは、ジカルボン酸またはその無水物とアンモニアまたは第一級アミンを加熱することによって製造されます。その結果、縮合反応が起こります。[7]
- (RCO) 2 O + R′NH 2 → (RCO) 2 NR′ + H 2 O
これらの反応はアミドを介して進行します。カルボン酸とアミドの分子内反応は、まれにしか見られない分子間反応よりもはるかに速いです。
これらはまた、特にラクタムから出発してアミドの酸化によって生成されることもある。[8]
- R(CO)NHCH 2 R' + 2 [O] → R(CO)N(CO)R' + H 2 O
特定のイミドはイソイミドからイミドへのマム転位で製造することもできます。
反応
アンモニア由来のイミドでは、N-H中心は弱酸性です。そのため、イミドのアルカリ金属塩は、水酸化カリウムなどの従来の塩基を用いて調製できます。フタルイミドの共役塩基はフタルイミドカリウムです。これらのアニオンはアルキル化されてN-アルキルイミドとなり、さらに分解されて第一級アミンが放出されます。この放出段階では、水酸化カリウムやヒドラジンなどの強力な求核剤が使用されます
イミドをハロゲンと塩基で処理すると、N-ハロ誘導体が得られます。有機合成において有用な例としては、N-クロロコハク酸イミドとN-ブロモコハク酸イミドが挙げられます。これらはそれぞれ有機合成において「Cl +」と「Br +」の供給源として機能します。
塩基、続いて酸の作用により、環状イミドは開環してアミド酸となる。例えば、マレイミドからマレアミド酸(HO 2 CCH=CHC(O)NH 2)が、スクシンイミドからスクシナミック酸( HO 2 CCH 2 CH 2 C(O)NH 2)が、フタルイミドからフタルイミド酸(HO 2 CC 6 H 4 C(O)NH 2 )が生成される。[3]
イソイミド
イソイミドはイミドと異性体であり、化学式RC(O)OC(NR′)R″で表されます。これらはしばしば中間体となり、より対称性の高いイミドへと変換されます。イソイミドは加熱によりイミドへと転位します。[8]
- RC(O)OC(NR′)R → [RC(O)] 2 NR′
関連化合物
カルボジイミドと呼ばれる有機化合物は、R N = C = NRという化学式で表されます。イミドとは無関係です
参考文献
- ^ 「イミド」。IUPAC化学用語集。2009年。doi : 10.1351 /goldbook.I02948。ISBN 978-0-9678550-9-7。
- ^ Martynov, AV (2005-12-06). 「トランス-アコニット酸イミドの合成への新しいアプローチ」. ChemInform . 36 (49) chin.200549068: no. doi :10.1002/chin.200549068. ISSN 1522-2667
- ^ ab Hargreaves, Michael K.; Pritchard, JG; Dave, HR (1970). 「環状カルボン酸モノイミド」. Chemical Reviews . 70 (4): 439– 469. doi :10.1021/cr60266a001.
- ^ Barradas, Remigio Germano; Fletcher, Stephen; Porter, John Douglas (1976). 「アルカリ溶液中におけるマレイミドの加水分解」. Canadian Journal of Chemistry . 54 (9): 1400– 1404. doi :10.1139/v76-200.
- ^ Walter W. WrightとMichael Hallden-Abberton「ポリイミド」、Ullmann's Encyclopedia of Industrial Chemistry、2002年、Wiley-VCH、Weinheim。doi : 10.1002/14356007.a21_253
- ^ Peter Ackermann, Paul Margot, Franz Müller「農業用殺菌剤」Ullmann's Encyclopedia of Industrial Chemistry、2002年、Wiley-VCH、Weinheim。doi : 10.1002/14356007.a12_085
- ^ Vincent Rodeschini、Nigel S. Simpkins、Fengzhi Zhangi (2009). 「アミンと無水物からのイミド形成の具体例」Organic Syntheses
{{cite journal}}: CS1 maint: 複数の名前: 著者リスト (リンク);集成巻、第11巻、1028ページ。 - ^ ab Sperry, Jonathan (2011). 「アミドからイミドへの酸化:強力な合成変換」Synthesis (22): 3569–3580 . doi :10.1055/s-0030-1260237
外部リンク
- IUPAC:イミド