分子間力
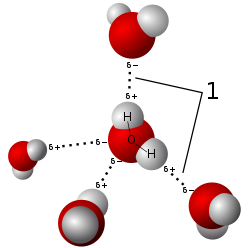
分子間力(IMF、二次力とも呼ばれる)は、分子間の相互作用を媒介する力であり、原子と他の種類の隣接粒子(原子やイオンなど)間に働く電磁気的な引力や反発力も含まれます。分子間力は、分子を結合させる力である分子内力に比べて弱いです。例えば、原子間で電子対を共有する共有結合は、隣接する分子間に働く力よりもはるかに強いです。[ 1 ]どちらの力も、分子力学で頻繁に使用される力場の重要な要素です。
微視的力の性質に関する最初の言及は、1743年にパリで出版されたアレクシ・クレローの著書「地球図理論」に見られる。[ 2 ]微視的力の研究に貢献した他の科学者には、ラプラス、ガウス、マクスウェル、ボルツマン、ポーリングなどがいる。
分子間引力は次の種類に分類されます。
分子間力に関する情報は、粘度、圧力、体積、温度(PVT)データといったマクロな特性値の測定によって得られます。ミクロな側面との関連は、ビリアル係数や、ミーポテンシャル、バッキンガムポテンシャル、レナード・ジョーンズポテンシャルといった分子間対ポテンシャルによって示されます。
最も広い意味では、化学結合(つまり、イオン結合、共有結合、金属結合)が形成されない、あらゆる粒子(分子、原子、イオン、分子イオン)間の相互作用として理解できます。言い換えれば、これらの相互作用は共有結合による相互作用よりも著しく弱く、相互作用する粒子の電子構造に大きな変化をもたらさない相互作用です。 (これは部分的にしか当てはまりません。例えば、すべての酵素反応や触媒反応は、基質と酵素、または分子と触媒との間の弱い分子間相互作用で始まりますが、酵素の活性中心の必要な空間配置とのそのような弱い相互作用がいくつか発生すると、分子または基質のエネルギー状態が大幅に再構築され、最終的にはいくつかの結合が切断され、他の共有化学結合が形成されます。厳密に言えば、すべての酵素反応は基質と酵素の分子間相互作用で始まるため、これらの相互作用の重要性は特に生化学と分子生物学で大きく、[ 3 ]酵素学の基礎となっています。)。
水素結合
水素結合とは、高い電気陰性度を持つ元素(通常は窒素、酸素、フッ素)に共有結合した水素原子と、別の高い電気陰性度を持つ原子との間の引力のことである。[ 4 ]水素結合はしばしば強い静電相互作用として説明される。しかし、共有結合の特徴もいくつか持っている。方向性があり、ファンデルワールス力による相互作用よりも強く、ファンデルワールス半径の合計よりも短い原子間距離を生み出し、通常は相互作用パートナーの数が限られており、これは一種の原子価として解釈できる。分子間に形成される水素結合の数は、活性対の数に等しい。水素を供与する分子はドナー分子と呼ばれ、水素結合に関与する孤立電子対を含む分子はアクセプター分子と呼ばれる。活性対の数は、ドナーが持つ水素の数とアクセプターが持つ孤立電子対の数の共通数に等しい。

図には描かれていないが、水分子には4つの活性結合がある。酸素原子の2つの孤立電子対はそれぞれ水素原子と相互作用し、さらに2つの水素結合を形成する。また、2つ目の水素原子も隣接する酸素原子と相互作用する。分子間水素結合は、水素結合能がほとんどない他の16族水素化物と比較して、水の沸点(100℃)が高い理由である。分子内水素結合は、タンパク質や核酸の二次、三次、四次構造に部分的に関与している。また、合成ポリマーと天然ポリマーの両方の構造においても重要な役割を果たしている。[ 5 ]
塩橋
陽イオン部位と陰イオン部位の間の引力は非共有結合、すなわち分子間相互作用であり、通常はイオン対形成または塩橋と呼ばれます。[ 6 ] これは基本的に静電気力によるものですが、水性媒体中では結合はエントロピーによって駆動され、しばしば吸熱反応ですらあります。ほとんどの塩は、イオン間に特徴的な距離を持つ結晶を形成します。他の多くの非共有結合相互作用とは対照的に、塩橋は方向性がなく、固体状態では通常、イオンのファンデルワールス半径によってのみ決定される接触を示します。無機イオンも有機イオンも、中程度のイオン強度Iの水中で、結合と同様の塩橋を形成し、陰イオンと陽イオンが1:1の組み合わせの場合、ΔG値が約5~6 kJ/molで、イオンの性質(サイズ、分極率など)にはほとんど依存しません。[ 7 ] ΔG値は電荷の線形関数として加法的に作用し、例えば二価リン酸アニオンと一価アンモニウムカチオンとの相互作用は約2x5 = 10 kJ/molとなる。ΔG値は溶液のイオン強度Iに依存し、これはデバイ・ヒュッケルの式で表され、イオン強度がゼロの場合にはΔG = 8 kJ/molとなる。
双極子間相互作用および類似の相互作用
双極子間相互作用(またはキーソム相互作用)は、永久双極子を持つ分子間の静電相互作用です。この相互作用はロンドン力よりも強いですが、部分電荷のみが関与するため、イオン間相互作用よりも弱いです。これらの相互作用は、分子を整列させて引力を高める(位置エネルギーを低下させる)傾向があります。双極子間相互作用の例として、塩化水素(HCl)が挙げられます。極性分子の正極端は、もう一方の分子の負極端を引きつけ、その位置に影響を与えます。極性分子同士の間には、正味の引力があります。極性分子の例としては、塩化水素(HCl)やクロロホルム(CHCl 3)などが挙げられます。
分子は双極子を持つ原子群を含むことが多いものの、分子全体としては双極子モーメントを持ちません。これは、分子内に対称性があり、双極子が互いに打ち消し合う場合に発生します。これは、テトラクロロメタンや二酸化炭素などの分子で発生します。原子が永久双極子を持つことは稀であるため、2つの個々の原子間の双極子間相互作用は通常ゼロです。
キーソム相互作用はファンデルワールス力の一種です。「ファンデルワールス力」のセクションでさらに詳しく説明します。
イオン双極子力とイオン誘起双極子力
イオン-双極子力とイオン誘起双極子力は、双極子-双極子相互作用および双極子誘起双極子相互作用に似ていますが、極性分子と非極性分子だけでなく、イオンも関与します。イオン-双極子力とイオン誘起双極子力は、イオンの電荷が双極子モーメントの電荷よりもはるかに大きいため、双極子-双極子相互作用よりも強くなります。イオン-双極子結合は水素結合よりも強いです。[ 8 ]
イオン-双極子力は、イオンと極性分子の相互作用によって生じます。正イオンと負イオンが隣り合うように整列することで、最大の引力が得られます。この相互作用の重要な例として、水中のイオンの水和が挙げられます。この水和は水和エンタルピーを生じます。極性水分子は水中のイオンを取り囲み、この過程で放出されるエネルギーは水和エンタルピーとして知られています。この相互作用は、水中の 様々なイオン(Cu 2+など)の安定性を正当化する上で非常に重要です。
イオン誘起双極子力は、イオンと非極性分子の相互作用によって生じます。双極子誘起双極子力と同様に、イオンの電荷は非極性分子上の電子雲に歪みを引き起こします。[ 9 ]
ファンデルワールス力
ファンデルワールス力は、電荷を持たない原子や分子間の相互作用から生じ、凝縮相の凝集や気体の物理的吸収などの現象を引き起こすだけでなく、巨視的物体間の普遍的な引力にもつながります。[ 10 ]
キーソム力(永久双極子-永久双極子)
ファンデルワールス力への最初の寄与は、回転する永久双極子、四極子(立方対称性よりも低い対称性を持つすべての分子)、および多重極子間の静電相互作用によるものです。これはウィレム・ヘンドリック・キーソムにちなんでキーソム相互作用と呼ばれています。[ 11 ]これらの力は永久双極子(双極性分子)間の引力に起因し、温度に依存します。[ 10 ]
キーソム相互作用は、双極子間の引力相互作用から成り、これらの相互作用は、双極子の異なる回転方向にわたってアンサンブル平均されます。分子は常に回転しており、所定の位置に固定されることはないと仮定されます。これは適切な仮定ですが、ある時点で分子は所定の位置に固定されます。キーソム相互作用のエネルギーは距離の 6 乗の逆数に依存しますが、空間的に固定された 2 つの双極子の相互作用エネルギーは距離の 3 乗の逆数に依存します。キーソム相互作用は、永久双極子モーメントを持つ分子、つまり 2 つの極性分子の間でのみ発生します。また、キーソム相互作用は非常に弱いファンデルワールス相互作用であり、電解質を含む水溶液では発生しません。角度平均相互作用は次の式で表されます。
ここで、 d = 電気双極子モーメント、= 自由空間の誘電率、= 周囲の物質の誘電率、T = 温度、= ボルツマン定数、r = 分子間の距離です。
デバイ力(永久双極子-誘起双極子)
2つ目の寄与は誘導(分極とも呼ばれる)またはデバイ力であり、回転する永久双極子間の相互作用と原子および分子の分極率(誘導双極子)から生じる。これらの誘導双極子は、永久双極子を持つ分子が別の分子の電子を反発するときに発生する。永久双極子を持つ分子は、同様の隣接分子に双極子を誘導し、相互に引力を引き起こすことができる。デバイ力は原子間では発生しない。誘導双極子と永久双極子間の力は、誘導双極子が極性分子の周囲を自由に移動および回転するため、キーソム相互作用ほど温度に依存しない。デバイ誘導効果とキーソム配向効果は極性相互作用と呼ばれる。[ 10 ]
誘導双極子力は誘導(分極とも呼ばれる)から生じ、これはある分子上の永久多極子と別の分子上の(前の双極子/多極子によって)誘導された多極子との間の引力相互作用である。[ 12 ] [ 13 ] [ 14 ]この相互作用はピーター・J・W・デバイにちなんでデバイ力と呼ばれている。
永久双極子と誘導双極子間の誘導相互作用の一例としては、HClとArの相互作用が挙げられます。この系では、Arの電子がHClによって引き寄せられる(HClの水素側へ)、または反発される(HClの塩素側へ)ため、Arは双極子を形成します。[ 12 ] [ 13 ]角度平均相互作用は次式で与えられます。
ここで= 分極率。
このような相互作用は、あらゆる極性分子と非極性/対称分子の間で予想されます。誘導相互作用力は双極子間相互作用よりもはるかに弱いですが、ロンドン分散力よりも強いです。
ロンドン分散力(変動双極子誘起双極子相互作用)
3番目かつ支配的な寄与は、分散力またはロンドン力(変動双極子誘起双極子)です。これは、すべての原子および分子の瞬間的な双極子モーメントがゼロではないために生じます。このような分極は、極性分子によって、または非極性分子中の負に帯電した電子雲の反発によって誘起されます。したがって、ロンドン相互作用は、電子雲内の電子密度のランダムな変動によって引き起こされます。電子数の多い原子は、電子数の少ない原子よりも大きなロンドン力を持ちます。すべての物質は分極可能であるのに対し、キーソム力とデバイ力は永久双極子を必要とするため、分散力(ロンドン力)は最も重要な要素です。ロンドン相互作用は普遍的であり、原子間相互作用にも存在します。様々な理由から、ロンドン相互作用(分散)は凝縮系における巨視的物体間の相互作用に関連すると考えられてきました。ハマカーは1937年に巨視的物体間のファンデルワールス力の理論を発展させ、これらの相互作用の加法的性質によって、相互作用の範囲が著しく長くなることを示しました。[ 10 ]
力の相対的な強さ
| 債券の種類 | 解離エネルギー(kcal/mol)[ 15 ] | 解離エネルギー (kJ/モル) | 注記 |
|---|---|---|---|
| イオン格子 | 30-145 | 127-610 [ 16 ] | |
| 共有結合 | 8~170 | 33-715 [ 17 ] | |
| 共有結合 | 14~203 | 60-850 [ 18 ] | |
| 水素結合 | 1~12 | 4~50 | 水中では約5 kcal/mol(21 kJ/mol) |
| 双極子-双極子 | 0.5~2 | 2~8 | |
| ロンドン分散力 | 1~15歳未満 | 4歳未満から63歳 | 炭化水素の蒸発エンタルピーから推定[ 19 ] |
この比較は近似値です。実際の相対的な強さは関与する分子によって異なります。例えば、水が存在すると競合する相互作用が生じ、イオン結合と水素結合の両方の強さが大幅に弱まります。[ 20 ]静的なシステムでは、イオン結合と共有結合は常に、特定の物質において分子間力よりも強いと考えられます。しかし、酵素分子が基質分子と相互作用するような大きな運動システムではそうではありません。[ 21 ]ここでは、多数の分子内結合(ほとんどの場合は水素結合)が活性な中間状態を形成し、分子間結合によって一部の共有結合が切断され、残りの結合が形成されます。このようにして、生体にとって非常に重要な何千もの酵素反応が可能になります。
気体の挙動への影響
分子間力は短距離では反発力、長距離では引力として働く(レナード・ジョーンズポテンシャル参照)。[ 1 ] [ 22 ]気体中では、反発力は主に2つの分子が同じ体積を占有するのを防ぐ作用を持つ。このため、同じ温度・圧力下では、実在気体は理想気体よりも大きな体積を占有する傾向がある。引力は分子同士を引き寄せるため、実在気体は理想気体よりも小さな体積を占有する傾向がある。どちらの相互作用がより重要かは、温度と圧力に依存する(圧縮率を参照)。
気体中では、分子間の距離は一般的に大きいため、分子間力の影響は小さくなります。引力は斥力ではなく、分子の熱エネルギーによって打ち消されます。温度は熱エネルギーの尺度であるため、温度が上昇すると引力の影響は減少します。一方、斥力の影響は温度の影響を受けません。
気体を圧縮して密度を高めると、引力の影響が増大します。気体の密度が十分に高まると、引力は分子を分散させようとする熱運動の傾向を克服できるほど大きくなります。すると、気体は凝縮して固体または液体、すなわち凝縮相を形成します。温度が低いほど、凝縮相の形成は容易になります。凝縮相では、引力と斥力はほぼ均衡しています。
量子力学理論
原子や分子の間で観察される分子間力は、上で概説したように、永久双極子と瞬間双極子の間で生じるものとして現象的に説明することができます。あるいは、水素結合、[ 23 ]ファンデルワールス力[ 24 ]双極子間相互作用などのさまざまな種類の相互作用を説明できる基本的な統一理論を求めることもできます。通常、これは量子力学の考え方を分子に適用することによって行われ、レイリー–シュレーディンガー摂動法はこの点で特に効果的でした。既存の量子化学方法に適用すると、分子間相互作用のこのような量子力学的説明は、分子間相互作用を分析するために使用できる一連の近似方法を提供します。[ 25 ] 量子化学で見られるこの種の分子間相互作用を視覚化する最も役立つ方法の1つは、系の電子密度に基づく非共有相互作用指数です。これにはロンドン分散力が大きな役割を果たします。
電子密度トポロジーに関しては、電子密度勾配法に基づく最近の手法が最近登場しており、特にIBSI(固有結合強度指数)の開発が顕著である[ 26 ]。これはIGM(独立勾配モデル)手法に依存している[ 27 ] [ 28 ] [ 29 ] 。
参照
参考文献
- ^ a b Fischer, Johann ; Wendland, Martin (2023年10月). 「主要な経験的分子間ポテンシャルの歴史について」 . Fluid Phase Equilibria . 573-113876 . Bibcode : 2023FlPEq.57313876F . doi : 10.1016/j.fluid.2023.113876 .
- ^ Margenau H, Kestner NR (1969).分子間力の理論. 国際自然哲学モノグラフシリーズ. 第18巻(第1版). オックスフォード: ペルガモン・プレス. ISBN 978-0-08-016502-8。
- ^ 「生化学と分子生物学 - ペーパーバック - デスポ・パパクリストドゥロウ、アリソン・スネイプ、ウィリアム・H・エリオット、ダフネ・C・エリオット - オックスフォード大学出版局」global.oup.com . 2024年1月4日閲覧。
- ^ IUPAC ,化学用語大全、第5版(「ゴールドブック」)(2025年)。オンライン版:(2006年以降)「水素結合」。doi: 10.1351/goldbook.H02899
- ^ Lindh U (2013)、「元素の生物学的機能」、Selinus O (編)、医地質学の要点(改訂版)、Dordrecht: Springer、pp. 129–177、doi : 10.1007/978-94-007-4375-5_7、ISBN 978-94-007-4374-8
- ^ Ciferri A, Perico A編 (2012).天然および合成高分子におけるイオン相互作用. ホーボーケン, ニュージャージー州: John Wiley & Sons, Inc. ISBN 978-0-470-52927-0。
- ^ Biedermann F, Schneider HJ (2016年5月). 「超分子複合体における実験的結合エネルギー」. Chemical Reviews . 116 (9): 5216– 5300. doi : 10.1021/acs.chemrev.5b00583 . PMID 27136957 .
- ^ Tro N (2011).化学:分子アプローチ. 米国: ピアソン・エデュケーション社. p. 466. ISBN 978-0-321-65178-5。
- ^ Blaber M (1996). 「分子間力」 . mikeblaber.org . 2020年8月1日時点のオリジナルよりアーカイブ。 2011年11月17日閲覧。
- ^ a b c d Leite FL, Bueno CC, Da Róz AL, Ziemath EC, Oliveira ON (2012年10月). 「表面力と接着の理論モデルと原子間力顕微鏡を用いた測定」 . International Journal of Molecular Sciences . 13 (10): 12773– 12856. doi : 10.3390/ ijms131012773 . PMC 3497299. PMID 23202925 .
- ^ Keesom WH (1915). 「中心に置かれた四重項分子の引力と等価な相互引力を持つ剛体球状分子の第二ビリアル係数」(PDF) .オランダ王立芸術科学アカデミー紀要. 18 : 636– 646.
- ^ a b Blustin PH (1978). 「塩酸アルゴン(Ar·HCl)の浮動ガウス軌道計算」. Theoretica Chimica Acta . 47 (3): 249– 257. doi : 10.1007/BF00577166 . S2CID 93104668 .
- ^ a b Roberts JK, Orr WJ (1938). 「誘導双極子とイオン結晶へのアルゴンの吸着熱」.ファラデー協会紀要. 34 : 1346. doi : 10.1039/TF9383401346 .
- ^ Sapse AM, Rayez-Meaume MT, Rayez JC, Massa LJ (1979). 「イオン誘起双極子H−nクラスター」. Nature . 278 (5702): 332– 333. Bibcode : 1979Natur.278..332S . doi : 10.1038/278332a0 . S2CID 4304250 .
- ^ Eğe SN (2004).有機化学:構造と反応性(第5版). ボストン:ホートン・ミフリン社. pp. 30– 33, 67. ISBN 978-0-618-31809-4。
- ^ 1モルの原子を放出するために必要なエネルギーに基づいて計算されます。つまり、格子エンタルピーからイオン化エネルギーと電子親和力を引いたものです。例: 1 / 5 Al 2 O 3 (s) → 2 / 5 Al(g) + 3 / 5 O(g) 610 kJ/mol
- ^ 1 モルの原子を放出するために必要なエネルギーに基づいて計算されます。たとえば、KrF 2の Kr-F 結合は50 kJ/mol であり、2 つの Kr-F 結合が壊れて 3 つの原子が放出されます。
- ^金属の原子化エンタルピー。例:W(s) → W(g) 850 kJ/mol
- ^ Majer V, Svoboda V (1985).有機化合物の蒸発エンタルピー. オックスフォード: ブラックウェル・サイエンティフィック. ISBN 978-0-632-01529-0。
- ^アルバーツ、ブルース;他。 (2015年)。細胞の分子生物学(第 6 版)。ニューヨーク州ニューヨーク:ガーランド サイエンス-テイラー & フランシス。ISBN 978-0-8153-4432-2. OCLC 887605755 .
- ^ Savir Y, Tlusty T (2007年5月). 「コンフォメーション校正:コンフォメーション変化が分子認識の特異性に与える影響」 . PLOS ONE . 2 (5): e468. Bibcode : 2007PLoSO...2..468S . doi : 10.1371/journal.pone.0000468 . PMC 1868595. PMID 17520027 .
- ^レンハルト、ヨハネス、ステファン、サイモン、ハッセ、ハンス(2024年6月)。「レナード・ジョーンズポテンシャルの歴史について」。アンナレン・デア・フィジック。536 (6)。doi : 10.1002 / andp.202400115。ISSN 0003-3804。
- ^ Arunan E、Desiraju GR、Klein RA、Sadlej J、Sheiner S、Alkorta I、他。 (2011-07-08)。「水素結合の定義 (IUPAC 勧告 2011)」。純粋化学と応用化学。83 (8): 1637 ~ 1641 年。doi : 10.1351 /PAC-REC-10-01-02。ISSN 1365-3075。S2CID 97688573。
- ^ Landau LD, Lifshitz EM (1960).連続媒体の電気力学. オックスフォード: ペルガモン. pp. 368–376 .
- ^ King M (1976). 「化学結合の理論」.アメリカ化学会誌. 98 (12): 3415– 3420. doi : 10.1021/ja00428a004 .
- ^ Klein J、Khartabil H、Boisson JC、Contreras-García J、Piquemal JP、Hénon E (2020 年 3 月)。「接着強度を調査する新しい方法」(PDF)。物理化学ジャーナル A。124 (9): 1850–1860。Bibcode : 2020JPCA..124.1850K。土井:10.1021/acs.jpca.9b09845。PMID 32039597。S2CID 211070812。
- ^ Lefebvre C, Rubez G, Khartabil H, Boisson JC, Contreras-García J, Hénon E (2017年7月). 「還元密度勾配対電子密度のNCIプロットにおける分子間相互作用の特徴の正確な抽出」(PDF) . Physical Chemistry Chemical Physics . 19 (27): 17928– 17936. Bibcode : 2017PCCP...1917928L . doi : 10.1039/C7CP02110K . PMID 28664951 .
- ^ Lefebvre C, Khartabil H, Boisson JC, Contreras-García J, Piquemal JP, Hénon E (2018年3月). 「独立勾配モデル:波動関数計算による分子内の強い相互作用と弱い相互作用の探究のための新たなアプローチ」(PDF) . ChemPhysChem . 19 (6): 724– 735. doi : 10.1002/cphc.201701325 . PMID 29250908 .
- ^ Ponce-Vargas M, Lefebvre C, Boisson JC, Hénon E (2020年1月). 「ホスト-ゲストアセンブリへの非共有結合相互作用の原子分解スキームの適用」. Journal of Chemical Information and Modeling . 60 (1): 268– 278. doi : 10.1021/acs.jcim.9b01016 . PMID 31877034. S2CID 209488458 .






