等吸収点
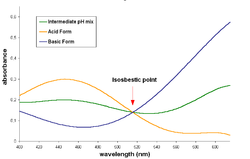
分光法において、等吸収点とは、試料の化学反応または物理的変化において、試料の全吸光度が変化しない特定の波長、波数、または周波数を指します。この語は、ギリシャ語の「iso」(等しい)と「sbestos」(消せる)という2つの単語に由来しています。[ 1 ]
解釈
等吸収点は、一定波長における吸光度に対応し、その吸光度は一定のままである[ 1 ]。吸光度は、各種の吸光度の和として表される(ランベルト・ビールの法則) 。 ここで、種iの濃度は光路長である。定義上、等吸収点は種濃度の固定された線形結合として解釈でき、 すなわち等吸収点は保存則である[ 2 ] 。
IUPACゴールドブック[ 1 ] では、等吸収点に至る 反応の例が示されている 。
等吸収点は様々な手法[ 3 ](例えば、UV-VIS、IR、NMR)で観測できます。UV-VISでは、等吸収点は単一の線形独立反応の発生を示唆すると解釈されることが多いです。
等吸収点の最も単純な例では2つの種のみが関与しているが、等吸収点は2つの種のみが関与していることを意味するわけではない(例えばIUPACの例では5つの種が関与している)。これはよくある誤解である[ 1 ]。
等吸収線図
2 つの種の吸収スペクトルを重ね合わせて等吸収線図を作成する場合(モル吸光係数を使用して表現するか、吸光度を使用して両方の種のモル濃度を同じに保つかに関係なく)、等吸収点はこれらのスペクトルが交差する波長に対応します。
一対の物質は、そのスペクトル内に複数の等吸収点を持つことができます。
1対1(反応物1モルから生成物1モルが生成する)の化学反応(平衡を含む)において、等吸収点を持つ2つの物質が反応する場合、反応の進行度(または化学平衡の位置)に関わらず、この波長における反応混合物の吸光度は一定です。これは、2つの物質がその特定の波長の光を同じ程度吸収し、分析濃度が一定であるためです。
反応について:
分析濃度は反応のどの時点でも同じです。
- 。
反応混合物の吸光度(XとYのみに依存すると仮定)は次のとおりです。
- 。
しかし、等吸収点では、両方のモル吸光係数は同じになります。
- 。
したがって、吸光度
反応の程度(つまり、XとYの特定の濃度)に依存しない
この例において等吸収点が生じるための条件は、関係する2つの化学種が化学量論的に直線関係にあり、特定の波長において吸光度が一定であることです。また、連続する2つの反応において等吸収点が期待できないことも容易に理解できます。
そうすると、3 つのスペクトルが同時に交差する波長が必要になります。
- 。
3つの化合物の吸光係数が偶然にこのように直線関係にあるということは、非常に考えにくい。[ 4 ]
アプリケーション

化学反応速度論では、等吸収点は反応速度の研究における基準点として用いられる。これは、それらの波長における吸光度が反応全体を通して一定であるためである。[ 1 ]
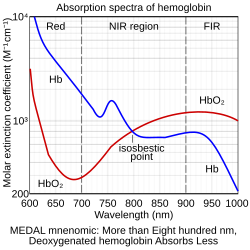
等吸収点は、医療分野において、酸素測定法と呼ばれる実験技術で、ヘモグロビンの飽和度に関わらず濃度を測定するために使用されます。オキシヘモグロビンとデオキシヘモグロビンは、586 nmと808 nm付近に(必ずしもそうとは限りませんが)等吸収点を持ちます 。
等吸収点は、臨床化学においても分光光度計の波長精度を検証するための品質保証方法として用いられます。これは、標準溶液のスペクトルを2つの異なるpH条件(物質のpK aの上下)で測定することによって行われます。使用される標準物質には、二クロム酸カリウム(等吸収点: 339 nmおよび445 nm)、ブロモチモールブルー(325 nmおよび498 nm)、コンゴーレッド(541 nm)などがあります。測定された等吸収点の波長は、使用される物質の濃度に依存せず、非常に信頼性の高い基準となります。
有機合成における等吸収点の利用例としては、光化学的A/D-コリン環異性化閉環反応が挙げられます。この反応は、エッシェンモーザーとチューリッヒ工科大学によるビタミンB12の全合成における重要なステップでした。[ 5 ] [ 6 ]等吸収点は、セコ-コリン錯体が中間体や副産物なしで金属を含まないコリン配位子に直接変換されることを証明しています( UV/VIS分光法の検出限界内)。[ 5 ]
参考文献
- ^ a b c d e IUPAC , Compendium of Chemical Terminology , 5th ed. (the "Gold Book") (2025). オンライン版: (2006–) " isosbestic point ". doi : 10.1351/goldbook.I03310
- ^ Blokhuis, Alex; Pollice, Robert (2025). 「化学データにおける次元性のケーススタディ」 . Eur. J. Org. Chem. e202400949. doi : 10.1002/ejoc.202400949 .
- ^ Kaspar, Felix (2023). 「複雑なスペクトルから得られる質の高いデータ:重なり合うスペクトルにおいて等尺点がどのように情報量を増加させるか」 . ChemBioChem : e202400949. doi : 10.1002/cbic.202200744 .
- ^ジョン・W・ムーア、ラルフ・G・ピアソン、アーサー・アトウォーター・フロスト著『運動学とメカニズム』(第3版、ジョン・ワイリー・アンド・サンズ、1981年) の49ページISBN 0-471-03558-0、ISBN 978-0-471-03558-9
- ^ a bウォルター総統 (1973)。Totalsynthese von Vitamin B 12 : Der photochemische Weg [ Total Synthesis of Vitamin B 12 : The Photochemical Route ] (PDF) (PhD) (ドイツ語)。チューリッヒ工科大学(プロモーション番号 5158)。土井:10.3929/ethz-a-000086601。hdl : 20.500.11850/131362。
- ^ Eschenmoser, A. ; Wintner, CE (1977). 「天然物合成とビタミンB12 :ビタミンB12の全合成は、有機化学の様々な分野における探究の枠組みを提供した」. Science . 196 (4297): 1410– 1420. Bibcode : 1977Sci...196.1410E . doi : 10.1126/science.867037 . PMID 867037 .
















