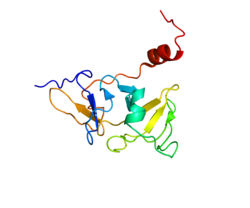
ATP依存性RNAヘリカーゼDHX58は、 RIG-I様受容体3 (RLR-3)またはRIG-I様受容体LGP2 (RLR)としても知られ、ヒトではDHX58 遺伝子によってコードされている RIG-I様受容体 dsRNA ヘリカーゼ 酵素 です。[ 5 ] [ 6 ] DHX58 遺伝子によってコードされている タンパク質はLGP2 として 知られています(遺伝学・生理学第2研究室)。[ 5 ] [ 7 ] [ 8 ]
構造と機能 LGP2は2001年に乳腺組織 において初めて同定され、その特徴が明らかにされましたが[ 5 ] 、その機能は自然抗ウイルス免疫の 分野により関連していることが判明しています。LGP2は、 RIG-I およびMDA5 によって認識される多くのウイルスに対する効果的な抗ウイルス応答を生成するために必須であることが判明しています[ 9 ]
LGP2はCARD ドメインを欠いているため、下流の抗ウイルスシグナル伝達に対するその効果は、dsRNAウイルスリガンド または他のRLR(RIG-IおよびMDA5)との相互作用によるものと考えられる。 [ 10 ]
LGP2はC末端リプレッサードメイン(RD)を介してRIG-Iと直接相互作用することが示されている[ 10 ] 。この相互作用における主要な接触部位は、RIG-Iの自己会合で見られるように、LGP2のRDとRIG-IのCARDまたはヘリカーゼドメインの間である可能性が高いが [ 10 ] [ 9 ] 。LGP2の過剰発現は 、ウイルスリガンドの存在下でも非存在下でも、RIG-Iを介した抗ウイルスシグナル伝達を阻害することができる[ 10 ] 。 [ 11 ] [ 12 ] [ 7 ] [ 13 ] [ 12 ] [ 9 ] [ 7 ] ノックダウン 研究では[ 14 ]
参考文献 ^ a b c GRCh38: Ensemblリリース89: ENSG00000108771 – Ensembl 、2017年5月^ a b c GRCm38: Ensemblリリース89: ENSMUSG00000017830 – Ensembl 、2017年5月^ 「ヒトPubMedリファレンス:」 。米国国立医学図書館、国立生物工学情報センター 。^ 「マウスPubMedリファレンス:」 米国 国立医学図書館、国立生物工学情報センター 。 ^ a b c Cui Y, Li M, Walton KD, Sun K, Hanover JA, Furth PA, Hennighausen L (2001年12月). 「Stat3/5遺伝子座は、正常および腫瘍性乳腺組織で優先的に発現する新規小胞体およびヘリカーゼ様タンパク質をコードする」 Genomics . 78 (3): 129–34 . doi : 10.1006/geno.2001.6661 . hdl : 2027.42/175385 . PMID 11735219 . ^ 「Entrez Gene: LGP2はマウスD11lgp2のおそらく相同遺伝子」 。 ^ a b c Childs K, Randall R, Goodbourn S (2012年4月). 「パラミクソウイルスVタンパク質はRNAヘリカーゼLGP2と相互作用し、RIG-I依存性インターフェロン誘導を阻害する」 . J. Virol . 86 (7): 3411–21 . doi : 10.1128/JVI.06405-11 . PMC 3302505. PMID 22301134 . ^ Matsumiya T, Stafforini DM (2010). 「 レチノイン酸誘導遺伝子-Iの機能と制御」 . Crit. Rev. Immunol . 30 (6): 489– 513. doi : 10.1615/critrevimmunol.v30.i6.10 . PMC 3099591. PMID 21175414 . ^ a b c 佐藤徹、加藤英、熊谷裕、米山正人、佐藤真、松下和、辻村隆、藤田拓、明S、竹内央 (2010年1月)。 「LGP2 は、RIG-I および MDA5 媒介抗ウイルス応答の正の制御因子です 。 」 手順国立アカド。科学。アメリカ 。 107 (4): 1512– 7. Bibcode : 2010PNAS..107.1512S 。 土井 : 10.1073/pnas.0912986107 。 PMC 2824407 。 PMID 20080593 。 ^ a b c d Saito T, Hirai R, Loo YM, Owen D, Johnson CL, Sinha SC, Akira S, Fujita T, Gale M (2007年1月). 「RIG-IとLGP2の共有リプレッサードメインを介した自然抗ウイルス防御の制御」 . Proc . Natl. Acad. Sci. USA . 104 (2): 582–7 . Bibcode : 2007PNAS..104..582S . doi : 10.1073/pnas.0606699104 . PMC 1766428. PMID 17190814 . ^ Rothenfusser S, Goutagny N, DiPerna G, Gong M, Monks BG, Schoenemeyer A, Yamamoto M, Akira S, Fitzgerald KA (2005年10月). 「RNAヘリカーゼLgp2はレチノイン酸誘導性遺伝子IによるTLR非依存性ウイルス複製感知を阻害する」 . J. Immunol . 175 (8): 5260–8 . doi : 10.4049/jimmunol.175.8.5260 . PMID 16210631 . ^ a b 米山 正之、菊池 正之、松本 健、今泉 剛志、宮岸 正之、平 健、Foy E、Loo YM、Gale M、Akira S、米原 聡、加藤 明、藤田 剛志 (2005年9月). 「抗ウイルス自然免疫におけるDExD/HボックスヘリカーゼRIG-I、MDA5、LGP2の共通機能と独自機能」 . J. Immunol . 175 (5): 2851–8 . doi : 10.4049/jimmunol.175.5.2851 . PMID 16116171 . ^ Wang Y, Ludwig J, Schuberth C, Goldeck M, Schlee M, Li H, Juranek S, Sheng G, Micura R, Tuschl T, Hartmann G, Patel DJ (2010年7月). 「自然免疫受容体RIG-Iによる5'-ppp RNAパターン認識の構造的・機能的知見」 Nat . Struct. Mol. Biol . 17 (7): 781–7 . doi : 10.1038 / nsmb.1863 . PMC 3744876. PMID 20581823 . ^ Burel SA, Machemer T, Ragone FL, Kato H, Cauntay P, Greenlee S, Salim A, Gaarde WA, Hung G, Peralta R, Freier SM, Henry SP (2012年7月). 「ユニークなO-メトキシエチルリボース-DNAキメラオリゴヌクレオチドは、非典型性黒色腫分化関連遺伝子5依存性のI型インターフェロン応答を誘導する」. J. Pharmacol. Exp. Ther . 342 (1): 150– 62. doi : 10.1124/jpet.112.193789 . PMID 22505629. S2CID 1899247 .
さらに読む 丸山 憲治, 菅野 誠 (1994). 「オリゴキャッピング:真核生物mRNAのキャップ構造をオリゴリボヌクレオチドで置換する簡便法」.遺伝子 . 138 ( 1–2 ): 171–4 . doi : 10.1016/0378-1119(94)90802-8 . PMID 8125298 . Bonaldo MF, Lennon G, Soares MB (1997). 「正規化と減算:遺伝子発見を促進する2つのアプローチ」 Genome Res 6 ( 9): 791–806 . doi : 10.1101/gr.6.9.791 PMID 8889548 . 鈴木雄三、中川吉智、丸山健、他 (1997). 「全長エンリッチドcDNAライブラリーおよび5'末端エンリッチドcDNAライブラリーの構築と特性解析」. Gene . 200 ( 1– 2): 149– 56. doi : 10.1016/S0378-1119(97)00411-3 . PMID 9373149 . Strausberg RL, Feingold EA, Grouse LH, et al. (2003). 「15,000以上のヒトおよびマウスの完全長cDNA配列の生成と初期解析」 . Proc . Natl. Acad. Sci. USA . 99 (26): 16899–903 . Bibcode : 2002PNAS...9916899M . doi : 10.1073/pnas.242603899 PMC 139241. PMID 12477932 . 太田 剛志、鈴木 雄志、西川 剛志、他 (2004). 「21,243個の完全長ヒトcDNAの完全配列決定と特性解析」 Nat . Genet . 36 (1): 40–5 . doi : 10.1038/ng1285 PMID 14702039 . Rual JF, Venkatesan K, Hao T, et al. (2005). 「ヒトタンパク質間相互作用ネットワークのプロテオームスケールマップの構築に向けて」Nature . 437 (7062): 1173–8 . Bibcode : 2005Natur.437.1173R . doi : 10.1038/nature04209 . PMID 16189514 . S2CID 4427026 . Komuro A, Horvath CM (2007). 「RNAヘリカーゼLGP2によるRNAおよびウイルス非依存性抗ウイルスシグナル伝達阻害」 . J. Virol . 80 (24): 12332–42 . doi : 10.1128/JVI.01325-06 . PMC 1676302. PMID 17020950 .