 | |
| 臨床データ | |
|---|---|
投与経路 | 外用薬(軟膏、点眼薬) |
| ATCコード |
|
| 法的地位 | |
| 法的地位 |
|
| 識別子 | |
| |
| CAS番号 | |
| PubChem CID |
|
| ケムスパイダー | |
| ユニイ |
|
| ケッグ | |
| CompToxダッシュボード (EPA) |
|
| ECHA 情報カード | 100.217.969 |
| 化学および物理データ | |
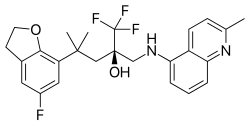
| 式 | C 25 H 26 F 4 N 2 O 2 |
| モル質量 | 462.489 g·mol −1 |
| 3Dモデル(JSmol) |
|
| |
 北 北 はい (これは何ですか?)(確認) はい (これは何ですか?)(確認) | |
マプラコラット(INN、コード名BOL-303242-X、ZK-245186 [1])は、選択的グルココルチコイド受容体作動薬(SEGRA)の実験的クラスに属する抗炎症薬です。アトピー性皮膚炎[2]、白内障手術後の炎症[3]、アレルギー性結膜炎[4]の局所治療薬として臨床試験が行われています。乾性角結膜炎の治療薬として、細胞モデルを用いた予備的な研究が行われています。[1]
臨床試験
マプラコラットの第II相臨床試験は2009年夏に開始された。1つの試験は、アトピー性皮膚炎に対する軟膏の用量設定を二重盲検法で検討した。約64人の患者を対象に、4週間にわたり0.01%、0.03%、0.1%の濃度をプラセボと比較した。この試験は、バイエル ヘルスケア・ファーマシューティカルズ傘下の皮膚科専門企業インテンディス社によって実施され、2010年9月または10月に完了した。[2]もう1つの試験も二重盲検法で、白内障手術後の炎症治療のための点眼懸濁液を評価した。約550人の患者を対象に、様々な濃度と投与量をプラセボと比較した。この試験はボシュロム社によって実施され、2010年9月に完了した。[3]その後継試験である第III相試験は、2010年11月に開始され、2011年8月に完了した。[5]
2017 年 1 月現在、[アップデート]研究結果は入手できていません。
参照
参考文献
- ^ ab Cavet ME, Harrington KL, Ward KW, Zhang JZ (2010年9月). 「新規選択的グルココルチコイド受容体作動薬マプラコラットは、ヒト角膜上皮細胞における高浸透圧誘導性サイトカイン放出およびMAPK経路を阻害する」. Molecular Vision . 16 : 1791–800 . PMC 2932489. PMID 20824100 .
- ^ ab ClinicalTrials.govの「アトピー性皮膚炎におけるZK 245186の異なる濃度の用量漸増」に関する臨床試験番号NCT00944632
- ^ ab ClinicalTrials.govの「白内障手術後の炎症治療におけるBOL-303242-Xと基剤の比較」の臨床試験番号NCT00905450
- ^ ClinicalTrials.govにおける「アレルギー性結膜炎患者に対するマプラコラット点眼薬」の臨床試験番号NCT01289431
- ^ ClinicalTrials.govにおける「白内障手術後の眼炎症治療のためのマプラコラット点眼懸濁液」の臨床試験番号NCT01230125


