| |
| 臨床データ | |
|---|---|
| 発音 | / ˌ m ɔː l n u ˈ p ɪər ə v ɪər / MAWL -noo- PEER -ə-veer |
| 商号 | ラジェヴリオ |
| その他の名前 | MK-4482、EIDD-2801 |
| AHFS / Drugs.com | モノグラフ |
| メドラインプラス | a622027 |
| ライセンスデータ |
|
| 妊娠 カテゴリー |
|
投与経路 | 経口摂取 |
| ATCコード |
|
| 法的地位 | |
| 法的地位 | |
| 識別子 | |
| CAS番号 |
|
| PubChem CID |
|
| ドラッグバンク |
|
| ケムスパイダー |
|
| ユニイ |
|
| ケッグ |
|
| チェビ |
|
| チェムブル |
|
| CompToxダッシュボード (EPA) |
|
| ECHA 情報カード | 100.310.497 |
| 化学および物理データ | |
| 式 | C 13 H 19 N 3 O 7 |
| モル質量 | 329.309 g·mol −1 |
| 3Dモデル(JSmol) |
|
| |
モルヌピラビルは、ラジェヴリオというブランド名で販売されており、特定のRNAウイルスの複製を阻害する抗ウイルス薬です。[6] SARS-CoV-2に感染したCOVID-19の治療に使用されます。[6]経口摂取します。[6]
モルヌピラビルは合成ヌクレオシド誘導体N4-ヒドロキシシチジンのプロドラッグであり、ウイルスRNA複製中にコピーエラーを導入することで抗ウイルス作用を発揮します。[ 12] [13]
モルヌピラビルはもともとエモリー大学の創薬イノベーション企業であるDrug Innovation Ventures at Emory(DRIVE)によってインフルエンザ治療薬として開発されましたが、変異原性への懸念から開発中止になったと報じられています。[ 14 ] [ 15 ]その後、マイアミに拠点を置くRidgeback Biotherapeutics社に買収され、同社は後にメルク社と提携してモルヌピラビルの開発をさらに進めました。[16]
プラセボ対照二重盲検ランダム化臨床試験での肯定的な結果に基づき、[17] [18]モルヌピラビルは2021年11月に英国で医療用として承認されました。 [6] [19] [20] [21] 2021年12月、米国食品医薬品局(FDA)は、他の治療法が実行不可能な特定の集団で使用するために、モルヌピラビルの緊急使用許可(EUA)を付与しました。 [9]緊急使用許可は、有効性に関する疑問と、モルヌピラビルの変異原性作用によって免疫を回避し、 COVID-19パンデミックを長引かせる新しい変異体が生じる可能性があるという懸念から、わずかな差で承認されました(13–10)。[22] [23] [24] 2023年9月、2022年以降の世界中のSARS-CoV-2分離株の研究で、モルヌピラビルのウイルス変異原性がSARS-CoV-2のゲノム変異に寄与していることが確認されました。モルヌピラビルに特有のゲノム変化は、特にモルヌピラビルが使用されていた場所でより一般的でした。[25]
医療用途
英国では、モルヌピラビルは、SARS-COV-2診断検査が陽性で、重症化のリスク因子を少なくとも1つ有する成人の軽度から中等度のCOVID-19の治療に適応があります。 [6]
米国ではモルヌピラビルは未承認であるが、入院や死亡を含む重症COVID-19への進行リスクが高く、FDAによって承認または認可されたCOVID-19の代替治療法が利用できない、または臨床的に適切でない軽症から中等症のCOVID-19成人の治療のための緊急使用許可(EUA)に基づいて承認されている。[8] [9] [11]
禁忌
妊娠中の使用は推奨されません。[3]妊娠中の使用に関する、母体または胎児への有害事象のリスクを評価するためのヒトにおけるデータはありません。[3]動物実験データに基づくと、この薬は胎児に害を及ぼす可能性があります。[3]
副作用
第III相MOVe-OUT試験で観察された副作用には、下痢(2%)、吐き気(1%)、めまい(1%)などがあり、いずれも軽度または中等度であった。[11]
米国FDAの処方箋ラベルには警告枠が記載されている。[8]
ラットでは、反復投与後に骨および軟骨の毒性が観察された。[11]
過剰摂取
過剰摂取の影響は不明であり、治療は臨床状態のモニタリングなどの一般的な支持療法で構成される。[11]
薬物相互作用
入手可能な限られたデータに基づくと、薬物相互作用はない。[11]
作用機序
モルヌピラビルは、RNA標的RNAポリメラーゼによるウイルスRNAの複製において広範な変異を促進することで、ウイルスの増殖を阻害する。[26]モルヌピラビルは、シチジンに似たリボヌクレオシド類似体、β- D - N 4 -ヒドロキシシチジン5'-三リン酸(EIDD-1931 5'-三リン酸またはNHC-TPとも呼ばれる)に代謝される。[27] [28] [29]複製中に、ウイルスの酵素は、実際のシチジンを使用する代わりに、 NHC-TPを新しく生成されたRNAに組み込む。 [29]

モルヌピラビルは2つの形態(互変異性体)の間で交換することができ、1つはシチジン(C)を模倣し、もう1つはウリジン(U)を模倣する。[30] NHC-TPは、変異したヌクレオチドを正しいバージョンに置き換えることができるウイルスの校正エキソヌクレアーゼ酵素によってエラーとして認識されない。[26]ウイルスのRNAポリメラーゼがモルヌピラビルを含むRNAをコピーしようとすると、時にはCとして解釈され、時にはUとして解釈される。これにより、下流のすべてのコピーで、ウイルスが生き残ることができるよりも多くの変異が発生し、ウイルスエラーカタストロフィーまたは致死的突然変異と呼ばれる効果が発生する。[30]
化学
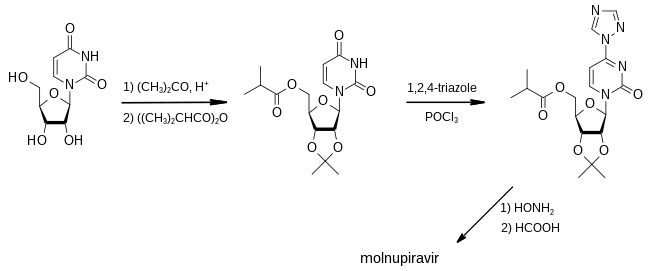
モルヌピラビルの最初の合成は、2018年にエモリー大学によって提出された特許で公開されました。[31]
第一段階では、アセトンを保護基として用い、ウリジンの3つのヒドロキシ基のうち2つをイソ酪酸の酸無水物で処理して不活性にし、3つ目のヒドロキシ基をエステルに変換する。1,2,4-トリアゾールと塩化ホスホリルで処理すると、トリアゾール部分をヒドロキシルアミンに置換できる反応性中間体が得られる。最後に、ギ酸を用いて保護基を除去することで、モルヌピラビルに変換される。[31] : 93–95
歴史
モルヌピラビルは、エモリー大学の医薬品イノベーション企業であるDrug Innovation Ventures at Emory(DRIVE)によって開発されました。 [16] DRIVEは2014年に国防脅威削減局の資金提供を受けて、ベネズエラ馬脳炎ウイルス(VEEV)を標的とした抗ウイルス薬のスクリーニングプロジェクトを開始し、EIDD-1931の発見につながりました。[32] [信頼できない医療情報源? ]プロドラッグEIDD-2801(モルヌピラビル)に変換されたこの化合物は、インフルエンザ、エボラ、チクングニア、さまざまなコロナウイルスなどの他のRNAウイルスに対しても活性を示しました。[32]
この薬の国際一般名は、トールのハンマー「ミョルニル」に由来しています。雷神の強大な一撃のように、この薬がウイルスを打ち倒すというイメージです。[29]
2019年、国立アレルギー感染症研究所(NIAID)は、モルヌピラビルをインフルエンザの第I相臨床試験に移行することを承認した。[32]
2020年3月、研究チームはSARS-CoV-2の研究に方向転換し、モルヌピラビルを用いて新型コロナウイルスに感染したヒト細胞の治療に成功しました。[32] [信頼できない医学的情報源? ]ある研究では、フェレットのSARS-CoV-2に対して経口投与が有効であることがわかりました。[33]
DRIVE社はその後、マイアミに拠点を置くリッジバック・バイオセラピューティクス社にモルヌピラビルのヒト臨床試験のライセンスを供与し、同社は後にメルク社と提携してこの薬のさらなる開発を行った。[32] [16]
米国食品医薬品局(FDA)によるモルヌピラビルの緊急使用許可を裏付ける主要なデータは、MOVe-OUT試験から得られたものである。これは、重症化および/または入院のリスクが高い、軽症から中等症のCOVID-19に罹患し入院していない参加者の治療にモルヌピラビルを使用するランダム化二重盲検プラセボ対照臨床試験である。[9] [34]参加者は、事前に指定された慢性疾患を有する、または他の理由でSARS-CoV-2感染リスクが高い、COVID-19ワクチンを接種していない18歳以上の成人であった。[9]この試験で測定された主要な結果は、29日間の追跡調査中に入院または何らかの原因で死亡した人の割合であった。[9]モルヌピラビルを投与された709人のうち、この期間内に入院または死亡した人は6.8%であったのに対し、プラセボを投与された699人では9.7%であった。[9]
2022年11月、英国国立医療技術評価機構(National Institute for Health and Care Excellence)は、モルヌピラビルをCOVID-19の治療に日常的に使用すべきではないと決定しました。これは、研究により、モルヌピラビルは入院率や死亡率に有意な変化をもたらさず、費用対効果も低いことが示されたためです。[35]この薬剤は、COVID-19治療ガイドライン草案において、協議のための「非推奨」リストに追加されました。[36] [35]
社会と文化
経済
2021年9月、メルク社は医薬品特許プール(MPP)と自主ライセンス契約を締結しました。この契約により、MPPはモルヌピラビルのサブライセンスを取得し、COVID-19経口薬を105の低所得国および中所得国に供給することができます。米国政府による当初の購入費用は1回の治療コースあたり約712ドルでした。一方、発展途上国ではジェネリック医薬品による治療はわずか20ドルで済みます。[37] [38]
モルヌピラビルの売上高は2021年第4四半期に9億5,200万ドルでした。[39]
法的地位
2021年10月、メルク社はFDAに緊急使用許可(EUA)申請書を提出し、2021年11月、FDAの医薬品評価研究センターの抗菌薬諮問委員会(AMDAC)が申請書について議論するために会合を開いた。[40] [41]委員会は賛成13票、反対10票という僅差で、COVID-19の重症化リスクが高い軽度から中等度の成人への使用許可を推奨した。[42]死亡予防効果の低さ(最終試験ではわずか30%)や、薬剤の変異率上昇(理論的にはより危険な変異体の進化を促しパンデミックを悪化させる可能性がある)への懸念が表明された。[42] [15] 2021年12月、米国食品医薬品局(FDA)は、SARS-CoV-2ウイルスの直接検査で陽性反応が出た成人で、入院や死亡を含む重症COVID-19への進行リスクが高く、FDAが承認したCOVID-19の代替治療法が利用できない、または臨床的に適切でない患者を対象に、軽症から中等症のCOVID-19の治療薬としてモルヌピラビルの緊急使用許可(EUA)を発行した。[9]
2021年10月、欧州医薬品庁(EMA)のヒト用医薬品委員会は、モルヌピラビルのローリングレビューを開始しました。[43] 2023年2月、EMAはモルヌピラビルの販売承認を拒否するよう勧告しました。[44] 2023年6月、メルク・シャープ・アンド・ドーム社はモルヌピラビルの販売承認申請を取り下げました。[45]
2021年11月、モルヌピラビルは英国で医薬品・医療製品規制庁(MHRA)により、COVID-19の既往感染症の治療薬として承認されました。[6] MHRAは、英国で適用される条件付き販売承認と、北アイルランドに対する緊急使用許可を発行しました。[6] [19] [46] [47]
2021年11月、バングラデシュ医薬品管理総局(DGDA)はモルヌピラビルの緊急使用を承認した。[48] [49]
2022年1月にはイスラエルでモルヌピラビルが医療用として承認され[50]、2022年2月にはロシアでも承認された[51] 。
ブランド名
モルヌピラビルは国際的な一般名である。[52] [53]
ジェネリック医薬品は、Molulife( Mankind)[54] 、 Molena(Emcure)[55] 、 Esplevir(Promomed)[51]などのブランド名で販売されています。
公衆衛生上の懸念
2021年11月のAMDAC会議では、複数のアドバイザーがモルヌピラビルが懸念される変異株の出現を加速させる可能性があるという懸念を表明した。[56] [57]他の科学者も会議の前後に同様の懸念を表明した。[58] [24] [59] [23]これらの懸念は、2023年9月に発表された世界中の1500万のSARS-CoV-2配列の研究によって確認された。モルヌピラビルが2022年に導入された後、特にモルヌピラビルが使用された場所ではゲノム変化がより一般的になった。[25]
研究
モルヌピラビルの代替となる特許取得済みの投与経路が検討されている。[60]
モルヌピラビルはCOVID-19の症状の重症度を軽減する可能性について調査されているが、有意な効果は認められなかった。[61]
参考文献
- ^ abc "Lagevrio APMDS". Therapeutic Goods Administration (TGA) . 2022年1月21日. 2022年2月5日時点のオリジナルよりアーカイブ。 2022年2月5日閲覧。
- ^ 「妊娠中の処方薬データベースの更新」Therapeutic Goods Administration (TGA) 2022年5月12日. 2022年4月3日時点のオリジナルよりアーカイブ。 2022年5月13日閲覧。
- ^ abcd “TGA eBS - 製品および消費者向け医薬品情報ライセンス”. 2022年2月5日時点のオリジナルよりアーカイブ。 2022年2月5日閲覧。
- ^ “AusPAR: Molnupiravir”. Therapeutic Goods Administration (TGA) . 2022年2月8日. 2022年3月24日時点のオリジナルよりアーカイブ。 2022年3月23日閲覧。
- ^ Anvisa (2023 年 3 月 31 日)。 「RDC No. 784 - Listas de Substâncias Entorpecentes、Psicotropicas、Precursoras e Outras sob Controle Especial」[大学理事会決議 No. 784 - 特別管理下の麻薬、向精神薬、前駆体、およびその他の物質のリスト]。Diario Oficial da União (ブラジルポルトガル語) (2023 年 4 月 4 日発行)。 2023年8月3日のオリジナルからアーカイブ。2023 年8 月 16 日に取得。
- ^ abcdefgh 「Lagevrioの製品特性概要」。医薬品・医療製品規制庁(MHRA) . 2021年11月4日. 2021年11月4日時点のオリジナルよりアーカイブ。 2021年11月4日閲覧。
- ^ “Lagevrio(モルヌピラビル)の規制当局による承認”.医薬品・医療製品規制庁(MHRA) . 2021年11月4日. オリジナルより2021年11月4日時点のアーカイブ。 2021年11月4日閲覧。
- ^ abc 「モルヌピラビルカプセル」DailyMed . 2024年1月14日時点のオリジナルよりアーカイブ。 2023年10月3日閲覧。
- ^ abcdefgh 「コロナウイルス(COVID-19)最新情報:FDA、特定の成人におけるCOVID-19治療薬として追加の経口抗ウイルス薬を承認」米国食品医薬品局(FDA)(プレスリリース)。2021年12月23日。2021年12月23日時点のオリジナルよりアーカイブ。 2021年12月23日閲覧。
 この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
この記事には、パブリック ドメインであるこのソースからのテキストが組み込まれています。
- ^ O'Shaughnessy JA (2022年3月22日). 「緊急使用許可108」. Merck Sharp & Dohme Corp. 宛ての書簡. 米国食品医薬品局(FDA). 2021年12月23日時点のオリジナルよりアーカイブ。
- ^ abcdef 「医療従事者向けファクトシート:モルヌピラビルの緊急使用許可」(PDF) .米国食品医薬品局(FDA) . Merck & Co., Inc. 2023年10月23日. 2024年1月14日時点のオリジナルよりアーカイブ。 2024年1月14日閲覧。
- ^ Toots M, Yoon JJ, Cox RM, Hart M, Sticher ZM, Makhsous N, 他 (2019年10月). 「フェレットおよびヒト気道上皮における高抵抗バリアを有する経口有効性インフルエンザ薬の特性評価」. Science Translational Medicine . 11 (515) eaax5866. doi :10.1126/scitranslmed.aax5866. PMC 6848974. PMID 31645453 .
- ^ Toots M, Yoon JJ, Hart M, Natchus MG, Painter GR, Plemper RK (2020年4月). 「フェレットモデルにおけるインフルエンザ臨床薬候補EIDD-2801の定量的有効性パラダイム」.トランスレーショナル・リサーチ. 218 : 16– 28. doi :10.1016/j.trsl.2019.12.002. PMC 7568909. PMID 31945316 .
- ^ Cohen B, Piller C (2020年5月). 「COVID-19治療薬開発の背後に隠された縁故主義を告発した内部告発者へのメール調査が示唆」『サイエンス』 . doi : 10.1126/science.abc7055 .
- ^ ab Cully M (2022年1月). 「2つの抗ウイルス標的とそれらに結合するCOVID-19治療薬の物語」. Nature Reviews. Drug Discovery . 21 (1): 3– 5. doi : 10.1038/d41573-021-00202-8 . PMID 34857884. S2CID 244851870.
- ^ abc Aleccia J (2021年9月29日). 「Daily pill to treat COVID could be just months away」ABCニュース. カイザーヘルスニュース. 2021年9月29日時点のオリジナルよりアーカイブ。 2021年9月29日閲覧。
- ^ ジェイク・ベルナルA、ゴメス・ダ・シルバMM、ムスンガイDB、コバルチュクE、ゴンザレスA、デロス・レイエスV、他。 (2021年12月)。 「入院していない患者における新型コロナウイルス感染症(COVID-19)の経口治療のためのモルヌピラビル」。ニューイングランド医学ジャーナル。386 (6): 509–520。土井: 10.1056/NEJMoa2116044。PMC 8693688。PMID 34914868。
- ^ Singh AK, Singh A, Singh R, Misra A (2021年11月). 「COVID-19におけるモルヌピラビル:文献の系統的レビュー」. Diabetes & Metabolic Syndrome . 15 (6) 102329. doi :10.1016/j.dsx.2021.102329. PMC 8556684. PMID 34742052 .
- ^ ab 「COVID-19に対する初の経口抗ウイルス薬、Lagevrio(モルヌピラビル)、MHRAの承認」(プレスリリース)。医薬品・医療製品規制庁(MHRA)。2021年11月4日。2022年1月5日時点のオリジナルよりアーカイブ。 2021年11月4日閲覧。
- ^ 「メルクとリッジバックのCOVID-19経口抗ウイルス薬モルヌピラビルが世界初の認可を取得」メルク社(プレスリリース)2021年11月4日。2021年11月4日時点のオリジナルよりアーカイブ。 2021年11月4日閲覧。
- ^ Robbins R, Khan AJ, Specia M (2021年11月4日). 「英国、新型コロナウイルス感染症(COVID-19)の抗ウイルス薬を初めて承認」 . The New York Times . 2021年11月28日時点のオリジナルよりアーカイブ。 2021年11月27日閲覧。
- ^ Kimball S (2021年11月30日). 「FDA諮問委員会、メルク社の新型コロナウイルス感染症経口治療薬を僅差で承認、有効性と安全性への疑問も」CNBC . 2022年1月1日時点のオリジナルよりアーカイブ。 2022年1月1日閲覧。
- ^ ab Lin MZ (2021年12月24日). 「新型コロナウイルス感染症(COVID-19)治療の新薬が変異ウイルスの温床となる可能性」ワシントン・ポスト. 2021年12月30日時点のオリジナルよりアーカイブ。 2022年1月1日閲覧。
- ^ ab Service RF (2021年11月). 「著名なウイルス学者がCOVID-19の薬が危険な変異株を放出する可能性があると警告。一方で、警戒する必要はほとんどないと考える者もいる」. Science . doi : 10.1126/science.acx9591 .
- ^ ab Sanderson T, Hisner R, Donovan-Banfield I, Hartman H, Løchen A, Peacock TP, et al. (2023年9月). 「SARS-CoV-2ゲノム全体におけるモルヌピラビル関連変異シグネチャー」. Nature . 623 (7987): 594– 600. Bibcode :2023Natur.623..594S. doi : 10.1038/s41586-023-06649-6 . PMC 10651478. PMID 37748513. S2CID 262748823 .
- ^ ab Lowe D (2021年10月13日). 「モルヌピラビルの変異」. Science (ブログ). 2021年12月21日時点のオリジナルよりアーカイブ。 2021年10月13日閲覧。
- ^ Painter WP, Holman W, Bush JA, Almazedi F, Malik H, Eraut NC, et al. (2021年3月). 「SARS-CoV-2に対する活性を有する新規広域スペクトル経口抗ウイルス剤モルヌピラビルのヒト安全性、忍容性、および薬物動態」. 『抗菌剤と化学療法』 . 65 (5). doi :10.1128/AAC.02428-20. PMC 8092915. PMID 33649113 .
- ^ Amara A, Penchala SD, Else L, Hale C, FitzGerald R, Walker L, et al. (2021年9月). 「ヒト血漿および唾液中のモルヌピラビルとその代謝物β-d-N4-ヒドロキシシチジンの同時定量のための新規LC-MS/MS法の開発と検証」. Journal of Pharmaceutical and Biomedical Analysis . 206 114356. doi :10.1016/j.jpba.2021.114356. PMC 7611757. PMID 34509661. S2CID 237493842 .
- ^ abc Mole B (2021年10月). 「メルク社が開発、トールに着想を得たCOVID-19治療薬モルヌピラビル」Ars Technica . 2021年10月2日時点のオリジナルよりアーカイブ。 2021年10月2日閲覧。
- ^ abc Malone B, Campbell EA (2021年9月). 「モルヌピラビル:大惨事のコーディング」. Nature Structural & Molecular Biology . 28 (9): 706– 708. doi : 10.1038/s41594-021-00657-8 . PMID 34518697. S2CID 237507937.
- ^ ab US application 20200276219、Painter GR、Bluemling GR、Natchus MG、Guthrie D、「N4-ヒドロキシシチジンおよび誘導体、ならびにそれに関連する抗ウイルス用途」、2020年9月3日公開、エモリー大学に譲渡。Wayback Machine で2021年10月5日にアーカイブ。
- ^ abcde Halford B. 「COVID-19に狙いを定める新興抗ウイルス薬」Chemical & Engineering News . 2020年8月2日時点のオリジナルよりアーカイブ。 2021年10月2日閲覧。
- ^ Cox RM, Wolf JD, Plemper RK (2021年1月). 「治療的に投与されたリボヌクレオシド類似体MK-4482/EIDD-2801はフェレットにおけるSARS-CoV-2の伝播を阻止する」Nature Microbiology . 6 (1): 11– 18. doi : 10.1038/s41564-020-00835-2 . PMC 7755744. PMID 33273742 .
- ^ CDERの緊急使用許可(報告書)を支持する科学的レビュー。医薬品評価研究センター。 2022年2月16日時点のオリジナル(PDF)からアーカイブ。 2022年2月16日閲覧。
- ^ ab 「NICE、COVID-19の治療法3つをガイドライン草案で推奨」英国国立医療技術評価機構(NICE) 2022年11月16日。 2023年2月13日閲覧。
- ^ Donnelly L (2023年2月11日). 「『有意差なし』の抗コロナ薬に約10億ポンドが費やされる」デイリー・テレグラフ. 2023年2月13日閲覧。
- ^ 「医薬品特許プール(MPP)とメルク社、COVID-19の治験薬であるモルヌピラビルのライセンス契約を締結、低・中所得国における広範なアクセス拡大を目指す」メルク社(プレスリリース)。2021年10月27日時点のオリジナルよりアーカイブ。 2021年10月28日閲覧。
- ^ 「メルク社、新型コロナウイルス感染症治療薬の処方を貧困国と共有」ニューヨーク・タイムズ、2021年10月27日。2021年11月27日時点のオリジナルよりアーカイブ。 2021年11月27日閲覧。
- ^ Erman M (2022年2月3日). 「メルク、2022年の売上高が20%近く増加と予測、モルヌピラビルが主因」ロイター. 2022年10月29日閲覧。
- ^ 「メルクとリッジバック、軽度から中等度のCOVID-19感染リスクのある成人の治療薬として、経口抗ウイルス薬モルヌピラビルの緊急使用許可申請を米国FDAに提出すると発表」Merck & Co. (プレスリリース)。2021年10月17日時点のオリジナルよりアーカイブ。 2021年10月17日閲覧。
- ^ 「FDA、メルクとリッジバックのCOVID-19経口治療薬の緊急使用許可申請について協議するため諮問委員会を開催」米国食品医薬品局(FDA)(プレスリリース)2021年10月18日。2021年10月18日時点のオリジナルよりアーカイブ。 2021年10月19日閲覧。
- ^ ab Hensley S (2021年11月30日). 「FDA委員会、メルク社のCOVID薬を混合投票で支持」NPR . 2022年1月4日時点のオリジナルよりアーカイブ。 2021年12月3日閲覧。
- ^ “COVID-19: EMA、モルヌピラビルの段階的審査を開始”.欧州医薬品庁(EMA) . 2021年10月25日. 2021年11月4日時点のオリジナルよりアーカイブ。 2021年11月6日閲覧。
- ^ 「Lagevrio(モルヌピラビル)の販売承認拒否」(PDF) 。 2024年1月14日時点のオリジナルよりアーカイブ(PDF) 。 2024年1月14日閲覧。
- ^ “Lagevrio EPAR”.欧州医薬品庁(EMA) . 2023年6月21日. 2024年1月14日時点のオリジナルよりアーカイブ。 2024年1月14日閲覧。
- ^ Reed J (2021年11月4日). 「英国で初の新型コロナウイルス感染症治療薬が承認」BBCニュースオンライン. 2021年11月4日時点のオリジナルよりアーカイブ。 2021年11月4日閲覧。
- ^ Whipple T (2021年11月4日). 「英国、画期的な新型コロナ対策薬を初めて承認」 . The Times . 2021年11月4日時点のオリジナルよりアーカイブ。 2021年11月5日閲覧。
- ^ 「バングラデシュで新型コロナウイルス感染症の経口薬が利用可能に」The Business Standard、2021年11月9日。2021年11月10日時点のオリジナルよりアーカイブ。 2021年11月10日閲覧。
- ^ “Eskayef's Covid pill hits market”. The Daily Star . 2021年11月10日. 2021年11月9日時点のオリジナルよりアーカイブ。 2021年11月10日閲覧。
- ^ “COVID-19治療薬として抗ウイルス薬ラジェブリオ(モルヌピラビル)が承認されました”. 2022年7月4日時点のオリジナルよりアーカイブ。2022年6月30日閲覧。
- ^ ab Prokhorchuk S (2022 年 2 月 4 日)。 «Промомед» зарегистрировал пероральный препарат MSD для терапии COVID-19 [プロモメッドは、新型コロナウイルス感染症治療用の経口 MSD 医薬品を登録しました]。ヴァデメクム(ロシア語)。 2024 年 1 月 14 日のオリジナルからアーカイブ。2023 年11 月 22 日に取得。
- ^ 世界保健機関(2021). 「医薬品物質の国際一般名(INN):推奨INN:リスト85」. WHO医薬品情報. 35 (1). hdl : 10665/340684 .
- ^ 世界保健機関(2022). 「医薬品物質の国際一般名(INN):推奨INN:リスト87」. WHO医薬品情報. 36 (1). hdl : 10665/352794 .
- ^ “MankindとBDR Pharmaが協力し、COVID-19治療薬Molulifeを発売”. The Economic Times . 2021年12月29日. 2024年1月14日時点のオリジナルよりアーカイブ。2023年11月23日閲覧。
- ^ Priyan V (2022年1月3日). 「コロナウイルス関連企業ニュースまとめ – Emcure Pharmaがインドでモルヌピラビルを発売 – Ascletisがリトナビル経口錠の生産を拡大」. PharmaceuticalTechnology . 2024年1月14日時点のオリジナルよりアーカイブ。 2023年11月23日閲覧。
- ^ Kimball S (2021年11月30日). 「FDA諮問委員会、メルク社の新型コロナウイルス感染症経口治療薬を僅差で承認、有効性と安全性への疑問も」CNBC . 2022年1月1日時点のオリジナルよりアーカイブ。 2022年1月4日閲覧。
- ^ Walker M (2021年11月30日). 「FDAパネル、メルク社のCOVID-19治療薬を僅差で支持」MedPage Today . 2022年1月4日時点のオリジナルよりアーカイブ。 2022年1月4日閲覧。
- ^ Nelson CW, Otto SP (2021年11月29日). 「変異原性抗ウイルス薬:低用量の進化リスク」. Virological . 2022年1月1日時点のオリジナルよりアーカイブ。 2022年1月4日閲覧。
- ^ Lovett S (2021年12月11日). 「免疫抑制状態にある患者への新型抗ウイルス薬の使用に関する科学者の警告」The Independent . 2022年1月4日時点のオリジナルよりアーカイブ。 2022年1月4日閲覧。
- ^ Wruhs O (1986). 「大腿骨幹部骨折に対する釘固定後の安定性の比較研究。死体骨を用いた実験的研究」. Wiener Klinische Wochenschrift. Supplementum (ドイツ語). 169 : 3–16 . PMID 3464133.
- ^ Huang J, Ma Q, Su Z, Cheng X (2024年10月). 「抗SARS-CoV-2治療薬開発の進歩」. Int J Mol Sci . 25 (19) 10820. doi : 10.3390/ijms251910820 . PMC 11477007 . PMID 39409149.
さらに読む
- Thorlund K, Sheldrick K, Meyerowitz-Katz G, Singh S, Hill A (2022年3月). 「モルヌピラビルMOVe-OUT臨床試験の統計的意義の解明」Am J Trop Med Hyg . 106 (5): 1301– 1304. doi :10.4269/ajtmh.21-1339. PMC 9128711. PMID 35276667. S2CID 247406958 .