有機化学において、隣接基関与(NGP、または隣接基支援とも呼ばれる)は、国際純正応用化学連合(IUPAC)によって、反応中心と原子内の孤立電子対、または親分子に含まれるが反応中心と共役していないシグマ結合またはパイ結合に存在する電子との相互作用として定義されています。[1] [2] [3] [4] NGPが作用している場合、反応速度が上昇するのは正常です。また、通常の反応と比較して、反応の立体化学が異常(または予期せぬ)になる可能性もあります。有機化学では、隣接基が多くの反応に影響を与える可能性がありますが (例: 1,3-シクロヘキサジエンなどのジエンと無水マレイン酸の反応では、通常、二次効果 (ディールス・アルダー反応におけるカルボニル基の π 軌道と遷移状態の重なり) によりエンド異性体が生成されます)、このページでは、カルボカチオンとS N 2 反応で見られる隣接基効果に限定しています。
ヘテロ原子孤立電子対によるNGP
このタイプの置換反応では、基質の1つの基が最初に反応に関与し、それによって反応に影響を与えます。NGPの典型的な例としては、硫黄マスタードまたは窒素マスタードと求核剤との反応が挙げられます。硫黄マスタードと求核剤の反応速度は、ヘテロ原子を含まない第一級または第二級アルキル クロリドの場合よりもはるかに速くなります。[5]

Ph−S−CH 2 −CH 2 −ClはCH 3 −CH 2 −CH 2 −Clよりも600倍速く水と反応します。[5]
アルケンによるNGP
アルケンのπ軌道は、カルボカチオンの正電荷を非局在化させることで遷移状態を安定化させることができます。例えば、不飽和トシル酸エステルは、飽和トシル酸エステルよりも求核剤とより速く反応します(水溶液中での溶媒分解では10の11乗倍)。
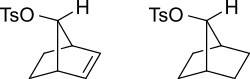
カルボカチオン中間体は共鳴によって安定化され、正電荷が複数の原子に分散されます。下の図にこれを示します。

以下は同じ中間体の別のビューです。

アルケンが反応中心から遠く離れていても、アルケンはこのように作用することができます。例えば、以下のアルキルベンゼンスルホン酸では、アルケンはカルボカチオンを 非局在化することができます。

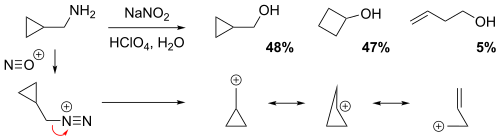
シクロプロパン、シクロブタンまたはホモアリル基によるNGP
希過塩素酸水溶液中でシクロプロピルメタミンと亜硝酸ナトリウムを反応させると、シクロプロピルメチルアルコール48%、シクロブタノール47% 、ホモアリルアルコール(ブタ-3-エン-1-オール)5%の混合物が得られた。[6]非古典的な観点から見ると、正電荷は共鳴によってカルボカチオン中間体構造全体に非局在化し、部分的な(電子不足の)結合が生じる。明らかに、ホモアリルアルコールの収率が比較的低いことから、ホモアリル構造が共鳴に最も寄与していないことがわかる。
芳香族環によるNGP
芳香環は、 正電荷を非局在化することで、 フェノニウムイオンと呼ばれるカルボカチオン中間体の形成を助けることができます。

以下のトシル酸塩を酢酸と溶媒分解で反応させると、単純なSN2反応でBが生成するのではなく、A、B(エナンチオマー)とC+Dの48:48:4の混合物が得られる。[7] [8]

AとBが形成されるメカニズムを以下に示します。

脂肪族CCまたはCH結合によるNGP
脂肪族C-C結合またはC-H結合は、これらの結合が脱離基に近接し、かつ反ペリプラナーである場合、電荷の非局在化を引き起こす可能性がある。対応する中間体は非古典的イオンと呼ばれ、2-ノルボルニル系が最もよく知られている例である。
外部リンク
- IUPACの定義
参考文献
- ^ マーチ、ジェリー(1992年)『有機化学の先端:反応、機構、構造』ワイリー社、314頁。ISBN 978-0-471-60180-7。
- ^ de Rooij, JF; Wille-Hazeleger, G.; Burgers, PM; van Boom, JH (1979). 「核酸のリン酸トリエステルのブロック解除における隣接基の関与」. Nucleic Acids Research . 6 (6): 2237– 2259. doi :10.1093/nar/6.6.2237. PMC 327848. PMID 461188 .
- ^ Stalford, Susanne A.; Kilner, Colin A.; Leach, Andrew G.; Turnbull, W. Bruce (2009-12-07). 「隣接基への関与とオキサカルベニウムイオンへの付加:結核菌オリゴ糖の合成に関する研究」. Organic & Biomolecular Chemistry . 7 (23). Royal Society of Chemistry : 4842– 4852. doi :10.1039/B914417J. PMID 19907773.
- ^ Bowden, Keith (1993). 「エステル加水分解におけるカルボニル基の隣接基関与」.物理有機化学の進歩. 第28巻. Elsevier. pp. 171– 206. doi :10.1016/S0065-3160(08)60182-3. ISBN 978-0-12-033528-2。
- ^ ab クレイデン, ジョナサン; グリーブス, ニック; ウォーレン, スチュアート G. (2012).有機化学(第2版). オックスフォード; ニューヨーク: オックスフォード大学出版局. p. 932. ISBN 978-0-19-927029-3。
- ^ Roberts, JD; Mazur, RH (1951). 「小環化合物. IV. シクロブチル、シクロプロピルカルビニルおよびアリルカルビニル誘導体の相互変換反応」. Journal of the American Chemical Society . 73 (6): 2509– 2520. Bibcode :1951JAChS..73.2509R. doi :10.1021/ja01150a029.
- ^ Cram, Donald J. (1949年12月). 「立体化学の研究. I. 3-フェニル-2-ブタノール異性体の立体特異的ワグナー-メーアヴァイン転位」. Journal of the American Chemical Society . 71 (12): 3863– 3870. Bibcode :1949JAChS..71.3863C. doi :10.1021/ja01180a001.
- ^ Cram, Donald J. (1952年5月). 「立体化学の研究 V. 3-フェニル-2-ブタノール系における分子内転位および溶媒分解反応の中間体としてのフェノニウムスルホネートイオン対」. Journal of the American Chemical Society . 74 (9): 2129– 2137. Bibcode :1952JAChS..74.2129C. doi :10.1021/ja01129a001.