ペルフルオロブタンスルホニルフルオリド
 | |
| 名前 | |
|---|---|
| 推奨IUPAC名 1,1,2,2,3,3,4,4,4-ノナフルオロブタン-1-スルホニルフルオリド | |
| 識別子 | |
3Dモデル(JSmol) | |
| 略語 | NfF |
| ケムスパイダー | |
| ECHA 情報カード | 100.006.175 |
| EC番号 |
|
PubChem CID | |
| ユニイ |
|
CompToxダッシュボード(EPA) | |
| |
| |
| プロパティ | |
| C 4 F 10 O 2 S | |
| モル質量 | 302.09 g/モル |
| 密度 | 1.682 g/mL [ 1 ] |
| 融点 | < −120 °C (-184 °F; 153 K) |
| 沸点 | 65~66℃(149~151°F; 338~339 K)[ 2 ] |
| 関連化合物 | |
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。 | |
ペルフルオロブタンスルホニルフルオリド(ノナフルオロブタンスルホニルフルオリド、NfF)は、無色の揮発性液体で、水とは混ざらないが、一般的な有機溶媒には溶ける。スルホランの電気化学的フッ素化によって生成される。NfF は、パラジウム触媒によるクロスカップリング反応の求電子剤として有用なノナフルオロブタンスルホネート(ノナフレート)への入り口となる。ペルフルオロアルキルスルホニル化剤としての NfF は、より頻繁に使用されるトリフルオロメタンスルホン酸無水物に比べて低コストで安定しているという利点がある。フッ素脱離基は、アミン、フェノキシド、エノラートなどの求核剤で容易に置換され、それぞれスルホンアミド、アリールノナフレート、アルケニルノナフレートを与える。しかし、水には侵されない(水中では pH < 12 で安定)。水酸化バリウムによる加水分解によりBa(ONf) 2が生成され、これを硫酸で処理するとパーフルオロブタンスルホン酸と不溶性の硫酸バリウムが生成されます。
精製

市販のNfFには、製造過程に由来する6~10モル%のペルフルオロスルホランが混入しています。これは、市販のNfFをK 3 PO 4とK 2 HPO 4の1:1モル比の濃水溶液で96時間激しく撹拌することで容易に除去できます。この処理後、水層を除去し、P 2 O 5から蒸留することで、99モル%を超えるNfFを含む製品が得られ、ほぼ定量的に回収できます。[ 3 ]
アリールおよびアルケニルノナフラートの合成
上述のように、アリールおよびアルケニルノナフラートは、パラジウム触媒クロスカップリング反応における求電子剤として有用である。その反応性は、一般的によく見られるトリフラート求電子剤とほぼ同様であるが、ノナフラートは加水分解されてケトン(アルケニルスルホン酸の場合)またはフェノール(アリールスルホン酸の場合)になりにくい傾向がある。ノナフラートの加水分解耐性は、ブッフバルト・ハートウィッグカップリング反応において、この副反応が目的生成物の収率に悪影響を及ぼす可能性があるため、ノナフラートは優れた求電子剤となっている。[ 4 ]
β-ケトエステルのナトリウムエノラートは、1.15当量のNfFと反応し、対応するアルケニルノナフラートを高収率で与える。2-メチルアセト酢酸エチル(R=R'=Me)は、この方法により幾何学的に純粋なE異性体を与える。[ 5 ]
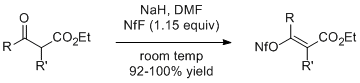
単純なアルデヒドおよびケトンは、DBUやホスファゼンなどの塩基の存在下でNfFと反応し、エノラートを形成せずに高収率でアルケニルノナフレートを与えます。P 2ホスファゼン塩基を-30~-20℃で用いると、非対称に置換されたケトンと低置換アルケニルノナフレートが得られます。[ 3 ]トリフルオロメタンスルホン酸無水物を用いた同様の反応では、高収率を得るために 一般的に高価な2,6-ジ-tert-ブチルピリジンの使用が必要です。
エノラートとNfFとの反応は、エノラートの構造とその金属対イオンの両方に強く依存する。メチルケトンのリチウムエノラートは、エノラートのO原子(期待される)またはC原子(期待されない)への求電子攻撃によって生じる生成物の混合物を与える。この効果はピナコロンのリチウムエノラートで特に顕著であり、C原子攻撃が優先する2:1の混合物を与える。より置換基を有するリチウムエノラートは、収率の変動はあるものの、Oスルホニル化生成物のみを与える。[ 6 ]
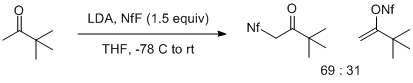
トリメチルシリルエノールエーテルは、0℃から室温で、化学量論比のフッ素源存在下、NfFと反応し、中程度から良好な収率でアルケニルノナフレートを与える。ある研究では、乾燥テトラ-n-ブチルアンモニウムフルオリドが好ましいフッ素源とされたが[ 6 ]、困難な場合にはCsFが使用され、優れた結果が得られている[ 7 ] 。

アリールノナフラートは、炭酸カリウム[ 8 ]やEt 3 N [ 4 ]などの塩基の存在下で、フェノールとNfFから直接、ほぼ定量的収率で合成できます。NaHやBuLi [ 9 ]などのより強い塩基も使用できますが、収率はやや低くなります。
アルコールとの反応
NfFとアルコールの反応はアルキルノナフレートの不安定性を浮き彫りにする。ほとんどの場合、反応の最終生成物はアルキルフッ化物(中間体アルキルノナフレートへのF − の攻撃による)またはオレフィン(中間体ノナフレートからのNfOHの脱離による)のいずれかである。最近、NfFとアルコールの反応によりアルキルノナフレートが生成される際に、遊離したF −を用いてトリメチルシリル基を有する求核剤をその場で活性化し、複数の脱酸素化生成物を生成できることが発見された。[ 10 ]
ビス-ノナフルオロブタンスルホンイミド(Nf 2 NH)の合成
NfFはアセトニトリル中、トリエチルアミン存在下で塩化アンモニウムと反応し、超酸性ビス-ノナフルオロブタンスルホンイミドのトリエチルアンモニウム塩を97%の収率で生成する。対応するカリウム塩は、トリエチルアンモニウム塩のメタノール溶液をKOHで処理することにより得られる。[ 11 ] 酸は、トリエチルアンモニウム塩をアンバーライトIR-100を固定相とし、メタノールを溶離液としてイオン交換クロマトグラフィーにかけることで得られる。[ 12 ] 後者の手順で実際に生成される物質は、MeOH 2 + Nf 2 N -であると考えられる。
参考文献
- ^ 「ペルフルオロ-1-ブタンスルホニルフルオリド」2012年7月22日閲覧。
- ^ 「1,1,2,2,3,3,4,4,4-ノナフルオロブタン-1-スルホニルフルオリド」アメリカ国立標準技術研究所(NIST ). 2012年7月22日閲覧。
- ^ a b Vogel, Michael AK; Christian BW Stark; Ilya M. Lyapkalo (2007). 「ノナフルオロブタン-1-スルホニルフルオリドとホスファゼン塩基の組み合わせを用いたカルボニル化合物からのアルケニルノナフラートの簡単な合成」Synlett . 2007 (EFirst): 2907– 2911. doi : 10.1055/s-2007-991084 . ISSN 0936-5214 .
- ^ a b Meadows, Rebecca E.; Simon Woodward (2008-02-11). 「パラジウム触媒によるアリールトリフラートおよびノナフラートのアミノ化における立体効果と第一級アミンPhCH(R)NH2 (R=H, Me)」. Tetrahedron . 64 (7): 1218– 1224. doi : 10.1016/j.tet.2007.11.074 . ISSN 0040-4020 .
- ^ Bellina, Fabio; Donatella Ciucci; Renzo Rossi; Piergiorgio Vergamini (1999-02-12). 「β-ケトエステル、β-ジケトン、またはα-ジケトン由来のビニルノナフラートの合成と、パラジウム触媒による有機亜鉛ハロゲン化物とのクロスカップリング反応」. Tetrahedron . 55 (7): 2103– 2112. doi : 10.1016/S0040-4020(98)01221-6 . ISSN 0040-4020 .
- ^ a b Lyapkalo, Ilya M.; Matthias Webel; Hans-Ulrich Reißig (2002). 「シリルエノールエーテルからのアルケニルノナフレートの迅速で立体選択的な合成:最適化、適用範囲、および限界」. European Journal of Organic Chemistry . 2002 (6): 1015– 1025. doi : 10.1002/1099-0690(200203)2002:6<1015::AID-EJOC1015>3.0.CO;2-K . ISSN 1099-0690 .
- ^ Bräse, Stefan (1999). 「分子内Heck反応によるビス(エノールノナフレート)の合成と4-エキソ-トリグ環化」. Synlett . 1999 (10): 1654– 1656. doi : 10.1055/s-1999-2892 . ISSN 0936-5214 .
- ^ Shekhar, Shashank; Travis B. Dunn; Brian J. Kotecki; Donna K. Montavon; Steven C. Cullen (2011). 「パラジウム触媒を用いた第一級スルホンアミドとアリールノナフレートの反応の一般的な方法」J. Org. Chem . 76 (11): 4552– 4563. doi : 10.1021/jo200443u . ISSN 0022-3263 . PMID 21510695 .
- ^上村 実; 依光 秀樹; 大島 幸一郎 (2008-02-18). 「Cp∗Liを塩基として:パラジウム触媒を用いたアリール-Xまたはアルケニル-X(X=I, Br, OTf, ONf)と末端アセチレンとのクロスカップリング反応への応用」. Tetrahedron . 64 (8): 1829– 1833. doi : 10.1016/j.tet.2007.11.095 . hdl : 2433/88969 . ISSN 0040-4020 .
- ^ Odoh, Amaechi Shedrack; Keeler, Courtney; Kim, Byoungmoo (2024-05-01). 「SuFExによるアルコールの直接脱酸素多様化」 . Organic Letters . 26 (18): 4013– 4017. doi : 10.1021/acs.orglett.4c01016 . ISSN 1523-7060 .
- ^クエック、サー・キアン;イリヤ・M・リャプカロ。ハン・ヴィン・フイン (2006-03-27)。 「N,N'-ジアルキルイミダゾリウム ビス(ノナフルオロブタン-1-スルホニル)イミドの合成と特性: イオン液体の新しいサブファミリー」。四面体。62 (13): 3137–3145。土井: 10.1016/j.tet.2006.01.015。ISSN 0040-4020。
- ^ Hashmi, A. Stephen K.; Tobias Hengst; Christian Lothschütz; Frank Rominger (2010). 「新規かつ容易に入手可能な窒素非環式金(I)カルベン:構造と金触媒フェノール合成およびアルキンの水和への応用」Advanced Synthesis & Catalysis . 352 (8): 1315– 1337. doi : 10.1002/adsc.201000126 . ISSN 1615-4169 .

