タンパク質構成アミノ酸は、 RNAからの翻訳中にタンパク質に生合成的に組み込まれるアミノ酸です。「タンパク質構成」という言葉は「タンパク質を作る」という意味です。既知の生命体全体で、遺伝的にコードされている(タンパク質構成)アミノ酸は22種類あり、標準的な遺伝コードに20種類、さらに特別な翻訳機構によって組み込まれる2種類(セレノシステインとピロリシン)があります。 [1]
対照的に、非タンパク質構成アミノ酸は、タンパク質に組み込まれないアミノ酸(GABA、L -DOPA、トリヨードチロニンなど)、遺伝的にコードされているアミノ酸の代わりに誤って組み込まれるアミノ酸、または標準的な細胞機構によって直接かつ単独で生成されないアミノ酸(ヒドロキシプロリンなど)です。後者は、多くの場合、タンパク質の翻訳後修飾によって生じます。一部の非タンパク質構成アミノ酸は、非リボソームペプチド合成酵素によって合成される 非リボソームペプチドに組み込まれます
真核生物と原核生物はどちらも、 SECISエレメントと呼ばれるヌクレオチド配列を介してセレノシステインをタンパク質に組み込むことができ、細胞は近くのUGAコドンをセレノシステインとして翻訳する(UGAは通常終止コドンである)。一部のメタン生成原核生物では、UAGコドン(通常は終止コドン)がピロリシンにも翻訳される。[2]
真核生物には、標準的な遺伝暗号の20種類とセレノシステインを加えた、タンパク質構成アミノ酸は21種類しかありません。ヒトはこれらのうち12種類を互いに、または中間代謝の他の分子から合成することができます。残りの9種類は(通常はタンパク質誘導体として)摂取する必要があるため、必須アミノ酸と呼ばれています。必須アミノ酸は、ヒスチジン、イソロイシン、ロイシン、リジン、メチオニン、フェニルアラニン、スレオニン、トリプトファン、バリン(すなわち、H、I、L、K、M、F、T、W、V)です。[3]
タンパク質構成アミノ酸は、リボザイムの自動アミノアシル化システムによって認識できるアミノ酸のセットに関連していることがわかっています。 [4]したがって、非タンパク質構成アミノ酸は、ヌクレオチドベースの生命体の偶発的な進化の成功によって排除されたと考えられます。特定の非タンパク質構成アミノ酸が一般的にタンパク質に組み込まれない理由を説明するために、他の理由も提示されています。例えば、オルニチンとホモセリンはペプチド骨格に対して環化し、比較的短い半減期でタンパク質を断片化します。一方、アルギニン類似体のカナバニンのように、誤ってタンパク質に組み込まれる可能性があるため、毒性を持つものもあります。
原始スープから特定のタンパク質構成アミノ酸が進化的に選択されたのは、非タンパク質構成アミノ酸と比較して、ポリペプチド鎖への組み込みが容易だったためだと示唆されています。[5]
構造
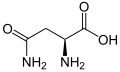
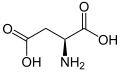
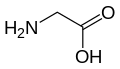
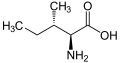
以下は、真核生物の遺伝暗号によってタンパク質合成のために直接コードされている21種類のアミノ酸の構造と略語を示しています。以下に示す構造は標準的な化学構造であり、水溶液中に存在する 典型的な両性イオン型ではありません

-
L-アラニン
(Ala / A) -
L-アルギニン
( Arg / R) -
L-アスパラギン
(Asn / N) -
L-システイン
(Cys / C -
L-
グルタミン酸(Glu / E) -
L-グルタミン
(Gln / Q) -
グリシン
(Gly / G) -
L-ヒスチジン
(His / H) -
L-イソロイシン
(Ile / I) -
L-ロイシン
(Leu / L) -
L-リジン
(Lys / K) -
L-メチオニン
(Met / M) -
L-フェニルアラニン
(Phe / F) -
L-プロリン
(Pro / P) -
L-セリン
(Ser / S) -
L-スレオニン
(Thr / T) -
L-トリプトファン
(Trp / W) -
L-チロシン
(Tyr / Y) -
L-バリン
(Val / V)
IUPAC / IUBMBは現在、以下の2つのアミノ酸の標準略語も推奨しています。
-
L-セレノシステイン
(Sec / U) -
L-ピロリシン
(Pyl / O)
化学的性質
以下は、標準アミノ酸の側鎖の1文字記号、3文字記号、および化学的性質を示す表です。記載されている質量は、天然存在比における元素同位体の加重平均に基づいています。ペプチド結合を形成すると、水分子が1つ脱離します。したがって、タンパク質の質量は、タンパク質を構成するアミノ酸の質量からペプチド結合1つあたり18.01524 Daを引いたものに等しくなります。
一般的な化学的性質
| アミノ酸 | 短縮形 | 略語 | 平均質量 ( Da ) | pI | pK 1 (α-COO − ) |
pK 2 (α-NH 3 + ) |
|---|---|---|---|---|---|---|
| アラニン | A | Ala | 89.09404 | 6.01 | 2.35 | 9.87 |
| システイン | C | システイン | 121.15404 | 5.05 | 1.92 | 10.70 |
| アスパラギン酸 | D | アスパラギン酸 | 133.10384 | 2.85 | 1.99 | 9.90 |
| グルタミン酸 | E | Glu | 147.13074 | 3.15 | 2.10 | 9.47 |
| フェニルアラニン | F | Phe | 165.19184 | 5.49 | 2.20 | 9.31 |
| グリシン | G | Gly | 75.06714 | 6.06 | 2.35 | 9.78 |
| ヒスチジン | H | His | 155.15634 | 7.60 | 1.80 | 9.33 |
| イソロイシン | I | Ile | 131.17464 | 6.05 | 2.32 | 9.76 |
| リジン | K | Lys | 146.18934 | 9.60 | 2.16 | 9.06 |
| ロイシン | L | Leu | 131.17464 | 6.01 | 2.33 | 9.74 |
| メチオニン | M | Met | 149.20784 | 5.74 | 2.13 | 9.28 |
| アスパラギン | N | Asn | 132.11904 | 5.41 | 2.14 | 8.72 |
| ピロリシン | O | Pyl | 255.31 | ? | ? | ? |
| プロリン | P | Pro | 115.13194 | 6.30 | 1.95 | 10.64 |
| グルタミン | Q | Gln | 146.14594 | 5.65 | 2.17 | 9.13 |
| アルギニン | R | Arg | 174.20274 | 10.76 | 1.82 | 8.99 |
| セリン | S | Ser | 105.09344 | 5.68 | 2.19 | 9.21 |
| トレオニン | T | Thr | 119.12034 | 5.60 | 2.09 | 9.10 |
| セレノシステイン | U | Sec | 168.053 | 5.47 | 1.91 | 10 |
| バリン | V | Val | 117.14784 | 6.00 | 2.39 | 9.74 |
| トリプトファン | W | Trp | 204.22844 | 5.89 | 2.46 | 9.41 |
| チロシン | Y | Tyr | 181.19124 | 5.64 | 2.20 | 9.21 |
Side-chain properties
| アミノ酸 | 短縮形 | 略語 | Side chain | Hydro- phobic |
pKa § | Polar | pH | Small | Tiny | Aromatic or Aliphatic |
van der Waals volume (Å 3 ) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| アラニン | A | Ala | -CH 3 | 
|
- | 
|
- | 
|

|
Aliphatic | 67 |
| システイン | C | システイン | -CH 2 SH | 
|
8.55 | 
|
acidic | 
|

|
- | 86 |
| アスパラギン酸 | D | アスパラギン酸 | -CH 2 COOH | 
|
3.67 | 
|
acidic | 
|

|
- | 91 |
| グルタミン酸 | E | Glu | -CH 2 CH 2 COOH | 
|
4.25 | 
|
acidic | 
|

|
- | 109 |
| フェニルアラニン | F | Phe | -CH 2 C 6 H 5 | 
|
- | 
|
- | 
|

|
芳香族 | 135 |
| グリシン | G | Gly | -H | 
|
- | 
|
- | 
|

|
- | 48 |
| ヒスチジン | H | His | -CH 2 - C 3 H 3 N 2 | 
|
6.54 | 
|
弱塩基性 | 
|

|
芳香族 | 118 |
| イソロイシン | I | Ile | -CH(CH 3 )CH 2 CH 3 | 
|
- | 
|
- | 
|

|
Aliphatic | 124 |
| リジン | K | Lys | -(CH 2 ) 4 NH 2 | 
|
10.40 | 
|
塩基性 | 
|

|
- | 135 |
| ロイシン | L | Leu | -CH 2 CH(CH 3 ) 2 | 
|
- | 
|
- | 
|

|
Aliphatic | 124 |
| メチオニン | M | Met | -CH 2 CH 2 S CH 3 | 
|
- | 
|
- | 
|

|
Aliphatic | 124 |
| アスパラギン | N | Asn | -CH 2 CONH 2 | 
|
- | 
|
- | 
|

|
- | 96 |
| ピロリシン | O | Pyl | -(CH 2 ) 4 NHCO C 4 H 5 N CH 3 | 
|
ND | 
|
弱塩基性 | 
|

|
- | ? |
| プロリン | P | Pro | -CH 2 CH 2 CH 2 - | 
|
- | 
|
- | 
|

|
- | 90 |
| グルタミン | Q | Gln | -CH 2 CH 2 CONH 2 | 
|
- | 
|
- | 
|

|
- | 114 |
| アルギニン | R | Arg | -(CH 2 ) 3 NH-C(NH)NH 2 | 
|
12.3 | 
|
強塩基性 | 
|

|
- | 148 |
| セリン | S | Ser | -CH 2 OH | 
|
- | 
|
- | 
|

|
- | 73 |
| トレオニン | T | Thr | -CH(OH)CH 3 | 
|
- | 
|
- | 
|

|
- | 93 |
| セレノシステイン | U | Sec | -CH 2 SeH | 
|
5.43 | 
|
acidic | 
|

|
- | ? |
| バリン | V | Val | -CH(CH 3 ) 2 | 
|
- | 
|
- | 
|

|
Aliphatic | 105 |
| トリプトファン | W | Trp | -CH 2 C 8 H 6 N | 
|
- | 
|
- | 
|

|
芳香族 | 163 |
| チロシン | Y | Tyr | -CH 2 -C 6 H 4 OH | 
|
9.84 | 
|
弱酸性 | 
|

|
芳香族 | 141 |
§:イオン化可能な残基のみが意味のあるpKaを持つ。Asp、Cys、Glu、His、Lys、Tyrの値は、アラニンペンタペプチドの中央に配置されたアミノ酸残基を用いて決定された。[6] Argの値はPace et al. (2009)による。[7] Secの値はByun & Kang (2011)による。[8]
注:小さなペプチド内のアミノ酸残基のpKa値は、タンパク質内にある場合、通常わずかに異なる。タンパク質のpKa計算は、このような状況におけるアミノ酸残基のpKa値の変化を計算するために使用されることがある。
遺伝子発現と生化学
| アミノ酸 | 短縮形 | 略語 | コドン | 出現 | ヒトにおいて必須‡ | |||
|---|---|---|---|---|---|---|---|---|
| 古細菌タンパク質中 (%)& |
細菌タンパク質中 (%)& |
真核生物タンパク質中 (%)& |
ヒトタンパク質中 (%)& | |||||
| アラニン | A | Ala | GCU、GCC、GCA、GCG | 8.2 | 10.06 | 7.63 | 7.01 | なし |
| システイン | C | システイン | UGU、UGC | 0.98 | 0.94 | 1.76 | 2.3 | 条件付き |
| アスパラギン酸 | D | アスパラギン酸 | GAU、GAC | 6.21 | 5.59 | 5.4 | 4.73 | なし |
| グルタミン酸 | E | Glu | GAA、GAG | 7.69 | 6.15 | 6.42 | 7.09 | 条件付き |
| フェニルアラニン | F | Phe | UUU、UUC | 3.86 | 3.89 | 3.87 | 3.65 | はい |
| グリシン | G | Gly | GGU、GGC、GGA、GGG | 7.58 | 7.76 | 6.33 | 6.58 | 条件付き |
| ヒスチジン | H | His | CAU、CAC | 1.77 | 2.06 | 2.44 | 2.63 | はい |
| イソロイシン | I | Ile | AUU、AUC、AUA | 7.03 | 5.89 | 5.1 | 4.33 | はい |
| リジン | K | Lys | AAA、AAG | 5.27 | 4.68 | 5.64 | 5.72 | はい |
| ロイシン | L | Leu | UUA、UUG、CUU、CUC、CUA、CUG | 9.31 | 10.09 | 9.29 | 9.97 | はい |
| メチオニン | M | Met | AUG | 2.35 | 2.38 | 2.25 | 2.13 | はい |
| アスパラギン | N | Asn | AAU、AAC | 3.68 | 3.58 | 4.28 | 3.58 | なし |
| ピロリシン | O | Pyl | UAG* | 0 | 0 | 0 | 0 | なし |
| プロリン | P | Pro | CCU、CCC、CCA、CCG | 4.26 | 4.61 | 5.41 | 6.31 | なし |
| グルタミン | Q | Gln | CAA、CAG | 2.38 | 3.58 | 4.21 | 4.77 | なし |
| アルギニン | R | Arg | CGU、CGC、CGA、CGG、AGA、AGG | 5.51 | 5.88 | 5.71 | 5.64 | 条件付き |
| セリン | S | Ser | UCU、UCC、UCA、UCG、AGU、AGC | 6.17 | 5.85 | 8.34 | 8.33 | なし |
| トレオニン | T | Thr | ACU、ACC、ACA、ACG | 5.44 | 5.52 | 5.56 | 5.36 | はい |
| セレノシステイン | U | Sec | UGA** | 0 | 0 | 0 | >0 | なし |
| バリン | V | Val | GUU、GUC、GUA、GUG | 7.8 | 7.27 | 6.2 | 5.96 | はい |
| トリプトファン | W | Trp | UGG | 1.03 | 1.27 | 1.24 | 1.22 | はい |
| チロシン | Y | Tyr | UAU、UAC | 3.35 | 2.94 | 2.87 | 2.66 | 条件付き |
| 終止コドン† | - | 用語 | UAA、UAG、UGA†† | ? | ? | ? | — | — |
* UAGは通常アンバー色の終止コドンですが、pylTSBCD遺伝子クラスターによってコードされている生物学的機構を持つ生物では、アミノ酸のピロリシンが組み込まれます。[9]
** UGAは通常オパール色(またはアンバー色)の終止コドンですが、SECIS要素が存在する場合はセレノシステインをコードします。
†終止コドンはアミノ酸ではありませんが、完全性のために含まれています
†† UAGとUGAは必ずしも終止コドンとして機能するわけではない(上記参照)。
‡必須アミノ酸はヒトでは合成できないため、食事から摂取する必要がある。条件付き必須アミノ酸は通常、食事から摂取する必要はないが、十分な量を合成できない特定の集団には外因的に供給する必要がある。
&アミノ酸の出現は、それぞれ135の古細菌、3775の細菌、614の真核生物プロテオーム、およびヒトプロテオーム(21,006個のタンパク質)に基づいている。[10]
質量分析
ペプチドおよびタンパク質の質量分析では、残基の質量に関する知識が有用です。ペプチドまたはタンパク質の質量は、残基の質量と水の質量の合計です(モノアイソトピック質量= 18.01056 Da、平均質量 = 18.0153 Da)。残基の質量は、表に示された化学式と原子量から計算されます。[11]質量分析では、イオンには1つ以上の陽子が含まれることもあります(モノアイソトピック質量= 1.00728 Da、平均質量* = 1.0074 Da)。*陽子は平均質量を持つことができません。これは、重陽子を有効な同位体と誤解させる可能性がありますが、これらは異なる種であるはずです(水素(化学)を参照)。
| アミノ酸 | 短縮形 | 略語 | 化学式 | モノアイソトピック質量§ ( Da ) | 平均質量( Da ) |
|---|---|---|---|---|---|
| アラニン | A | Ala | C 3 H 5 NO | 71.03711 | 71.0779 |
| システイン | C | システイン | C 3 H 5 NOS | 103.00919 | 103.1429 |
| アスパラギン酸 | D | アスパラギン酸 | C 4 H 5 NO 3 | 115.02694 | 115.0874 |
| グルタミン酸 | E | Glu | C 5 H 7 NO 3 | 129.04259 | 129.1140 |
| フェニルアラニン | F | Phe | C 9 H 9 NO | 147.06841 | 147.1739 |
| グリシン | G | Gly | C 2 H 3 NO | 57.02146 | 57.0513 |
| ヒスチジン | H | His | C 6 H 7 N 3 O | 137.05891 | 137.1393 |
| イソロイシン | I | Ile | C 6 H 11 NO | 113.08406 | 113.1576 |
| リジン | K | Lys | C 6 H 12 N 2 O | 128.09496 | 128.1723 |
| ロイシン | L | Leu | C 6 H 11 NO | 113.08406 | 113.1576 |
| メチオニン | M | Met | C 5 H 9 NOS | 131.04049 | 131.1961 |
| アスパラギン | N | Asn | C 4 H 6 N 2 O 2 | 114.04293 | 114.1026 |
| ピロリシン | O | Pyl | C 12 H 19 N 3 O 2 | 237.14773 | 237.2982 |
| プロリン | P | Pro | C 5 H 7 NO | 97.05276 | 97.1152 |
| グルタミン | Q | Gln | C 5 H 8 N 2 O 2 | 128.05858 | 128.1292 |
| アルギニン | R | Arg | C 6 H 12 N 4 O | 156.10111 | 156.1857 |
| セリン | S | Ser | C 3 H 5 NO 2 | 87.03203 | 87.0773 |
| トレオニン | T | Thr | C 4 H 7 NO 2 | 101.04768 | 101.1039 |
| セレノシステイン | U | Sec | C 3 H 5 NOSe | 150.95364 | 150.0489 |
| バリン | V | Val | C 5 H 9 NO | 99.06841 | 99.1311 |
| トリプトファン | W | Trp | C 11 H 10 N 2 O | 186.07931 | 186.2099 |
| チロシン | Y | Tyr | C 9 H 9 NO 2 | 163.06333 | 163.1733 |
細胞内の化学量論と代謝コスト
下の表は、大腸菌細胞内のアミノ酸の存在量と、アミノ酸の合成にかかる代謝コスト(ATP)を示しています。負の数は、代謝プロセスがエネルギー的に有利であり、細胞の正味ATPを消費しないことを示しています。[12]アミノ酸の存在量には、遊離型のアミノ酸と重合型のアミノ酸(タンパク質)が含まれます。
| アミノ酸 | 短縮形 | 略語 | 存在量(大腸菌細胞
1個あたり の分子数(×10 8) ) |
合成におけるATPコスト | |
|---|---|---|---|---|---|
| 好気 条件 |
嫌気 条件 | ||||
| アラニン | A | Ala | 2.9 | −1 | 1 |
| システイン | C | システイン | 0.52 | 11 | 15 |
| アスパラギン酸 | D | アスパラギン酸 | 1.4 | 0 | 2 |
| グルタミン酸 | E | Glu | 1.5 | −7 | −1 |
| フェニルアラニン | F | Phe | 1.1 | −6 | 2 |
| グリシン | G | Gly | 3.5 | −2 | 2 |
| ヒスチジン | H | His | 0.54 | 1 | 7 |
| イソロイシン | I | Ile | 1.7 | 7 | 11 |
| リジン | K | Lys | 2.0 | 5 | 9 |
| ロイシン | L | Leu | 2.6 | −9 | 1 |
| メチオニン | M | Met | 0.88 | 21 | 23 |
| アスパラギン | N | Asn | 1.4 | 3 | 5 |
| ピロリシン | O | Pyl | - | - | - |
| プロリン | P | Pro | 1.3 | −2 | 4 |
| グルタミン | Q | Gln | 1.5 | −6 | 0 |
| アルギニン | R | Arg | 1.7 | 5 | 13 |
| セリン | S | Ser | 1.2 | −2 | 2 |
| トレオニン | T | Thr | 1.5 | 6 | 8 |
| セレノシステイン | U | Sec | - | - | - |
| バリン | V | Val | 2.4 | −2 | 2 |
| トリプトファン | W | Trp | 0.33 | −7 | 7 |
| チロシン | Y | Tyr | 0.79 | -8 | 2 |
備考
| アミノ酸 | 略語 | 備考 | |
|---|---|---|---|
| アラニン | A | Ala | 非常に豊富で用途が広く、グリシンよりも硬いが、タンパク質の立体配座にわずかな立体制限しか与えないほど小さい。かなり中性的な挙動を示し、タンパク質の外側の親水性領域と内側の疎水性領域の両方に存在できる。 |
| アスパラギンまたはアスパラギン酸 | B | Asx | いずれかのアミノ酸が位置を占める場合のプレースホルダー |
| システイン | C | システイン | 硫黄原子は重金属イオンと容易に結合します。酸化条件下では、2つのシステインがジスルフィド結合してアミノ酸のシスチンを形成します。シスチンがタンパク質(例えばインスリン)の一部である場合、三次構造が安定化され、タンパク質は変性に対してより耐性になります。したがって、ジスルフィド結合は、消化酵素(例:ペプシンおよびキモトリプシン)や構造タンパク質(例:ケラチン)など、過酷な環境で機能しなければならないタンパク質でよく見られます。ジスルフィドは、それ自体では安定した形状を保つには小さすぎるペプチド(例:インスリン)にも見られます。 |
| アスパラギン酸 | D | アスパラギン酸 | アスパラギン酸はグルタミン酸と同様に振る舞い、強い負電荷を持つ親水性酸性基を持っています。通常、タンパク質の外側に位置し、水溶性になります。正電荷を持つ分子やイオンと結合し、金属イオンを固定する酵素でよく使用されます。タンパク質内部に位置する場合、アスパラギン酸とグルタミン酸は通常、アルギニンおよびリジンと対になります。 |
| グルタミン酸 | E | Glu | グルタミン酸はアスパラギン酸と同様に振る舞い、より長く、やや柔軟な側鎖を持っています。 |
| フェニルアラニン | F | Phe | ヒトにとって必須のフェニルアラニン、チロシン、トリプトファンは、側鎖に大きな硬い芳香族基を持っています。これらは最も大きなアミノ酸です。イソロイシン、ロイシン、バリンと同様に、これらは疎水性であり、折りたたまれたタンパク質分子の内側に配向する傾向があります。フェニルアラニンはチロシンに変換できます |
| グリシン | G | Gly | α炭素に2つの水素原子があるため、グリシンは光学活性ではありません。グリシンは最小のアミノ酸であり、容易に回転し、タンパク質鎖に柔軟性を与えます。コラーゲンの三重らせん構造など、最も狭い空間にも収まります。通常、過剰な柔軟性は望ましくないため、構造成分としてはアラニンよりも一般的ではありません。 |
| ヒスチジン | H | His | ヒスチジンはヒトにとって必須です。わずかに酸性の条件下でも窒素のプロトン化が起こり、ヒスチジンとポリペプチド全体の特性が変化します。多くのタンパク質において、ヒスチジンは調節機構として利用され、後期エンドソームやリソソームなどの酸性領域におけるポリペプチドの構造と挙動を変化させ、酵素の構造変化を促します。しかし、これには少量のヒスチジンしか必要ないため、比較的希少です。 |
| イソロイシン | I | Ile | イソロイシンはヒトにとって必須です。イソロイシン、ロイシン、バリンは大きな脂肪族疎水性側鎖を持っています。これらの分子は強固で、これらの鎖はタンパク質分子の内側に位置する傾向があるため、それらの相互疎水性相互作用はタンパク質の正しい折り畳みに重要です。 |
| ロイシンまたはイソロイシン | J | Xle | いずれかのアミノ酸が位置を占める場合のプレースホルダー |
| リジン | K | Lys | リジンはヒトにとって必須であり、アルギニンと同様の挙動を示します。リジンは、正に帯電した末端を持つ長く柔軟な側鎖を有しています。この鎖の柔軟性により、リジンとアルギニンは表面に多くの負電荷を持つ分子に結合するのに適しています。例えば、DNA結合タンパク質の活性領域にはアルギニンとリジンが豊富に含まれています。この強い電荷により、これら2つのアミノ酸はタンパク質の外側の親水性表面に位置する傾向があります。タンパク質内部に存在する場合、通常はアスパラギン酸やグルタミン酸などの対応する負に帯電したアミノ酸と対になっています。 |
| ロイシン | L | Leu | ロイシンはヒトにとって必須であり、イソロイシンやバリンと同様の働きをします。 |
| メチオニン | M | Met | メチオニンはヒトにとって必須です。常にタンパク質に組み込まれる最初のアミノ酸であり、翻訳後に除去されることがあります。システインと同様に硫黄を含みますが、水素の代わりにメチル基を持っています。このメチル基は活性化することができ、新しい炭素原子が別の分子に追加される多くの反応で使用されます。 |
| アスパラギン | N | Asn | アスパラギン酸と同様に、Asnはアミド基を含み、Aspはカルボキシル基を持っています。 |
| ピロリシン | O | Pyl | リジンに似ていますが、ピロリン環が付いています。 |
| プロリン | P | Pro | プロリンはN末端アミン基に特殊な環を有しており、CO-NHアミド配列を固定された立体配座に押し込みます。αヘリックスやβシートのようなタンパク質の折り畳み構造を破壊し、タンパク質鎖に望ましいねじれを強制します。コラーゲンによく見られ、しばしば翻訳後修飾を受けてヒドロキシプロリンになります。 |
| グルタミン | Q | Gln | グルタミン酸と同様に、GlnはGluがカルボキシル基を持つアミド基を含みます。タンパク質やアンモニアの貯蔵庫として使用され、体内で最も豊富なアミノ酸です。 |
| アルギニン | R | Arg | 機能的にはリジンに類似しています。 |
| セリン | S | Ser | セリンとスレオニンは、ヒドロキシル基で末端が閉じられた短い基を持っています。その水素は除去しやすいため、セリンとスレオニンは酵素において水素供与体として働くことがよくあります。どちらも非常に親水性であるため、可溶性タンパク質の外側領域にはそれらが多く含まれる傾向があります。 |
| トレオニン | T | Thr | ヒトにとって必須のThrは、セリンと同様の働きをします。 |
| セレノシステイン | U | Sec | システインのセレン類似体で、硫黄原子がセレンに置き換わっています。 |
| バリン | V | Val | ヒトにとって必須のValは、イソロイシンやロイシンと同様に振る舞います。 |
| トリプトファン | W | Trp | ヒトにとって必須のTrpは、フェニルアラニンやチロシンと同様に振る舞います。セロトニンの前駆体であり、天然の蛍光を発します。 |
| 不明 | X | Xaa | アミノ酸が不明または重要でない場合のプレースホルダー。 |
| チロシン | Y | Tyr | Tyrは、フェニルアラニン(チロシンの前駆体)やトリプトファンと同様に振る舞い、メラニン、エピネフリン、甲状腺ホルモンの前駆体です。天然の蛍光を発しますが、その蛍光は通常、トリプトファンへのエネルギー移動によって消光されます。 |
| グルタミン酸またはグルタミン | Z | Glx | いずれかのアミノ酸が位置を占める場合のプレースホルダー |
異化
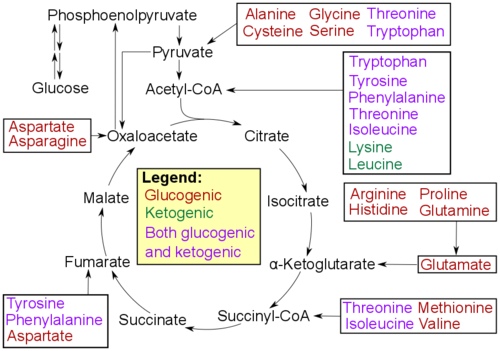
アミノ酸は、主な生成物の特性によって分類できます。[13]
- グルコジェニック型:生成物は糖新生によってグルコースを形成する能力を持ちます。
- ケトジェニック型:生成物はグルコースを形成する能力を持ちません。これらの生成物は、ケトン体生成または脂質合成に使用される場合があります。
- グルコジェニック型とケトジェニック型の両方の生成物に異化されるアミノ酸
参照
参考文献
- ^ Ambrogelly A, Palioura S, Söll D (2007年1月). 「遺伝コードの自然な拡張」. Nature Chemical Biology . 3 (1): 29– 35. doi :10.1038/nchembio847. PMID 17173027
- ^ Lobanov AV, Turanov AA, Hatfield DL, Gladyshev VN (2010年8月). 「遺伝暗号におけるコドンの二重機能」. Critical Reviews in Biochemistry and Molecular Biology . 45 (4): 257–65 . doi :10.3109/10409231003786094. PMC 3311535. PMID 20446809.
- ^ Young VR (1994年8月). 「成人のアミノ酸必要量:現在の推奨事項の大幅な改訂の必要性」(PDF) . The Journal of Nutrition . 124 (8 Suppl): 1517S – 1523S . doi :10.1093/jn/124.suppl_8.1517S. PMID 8064412
- ^ Erives A (2011年8月). 「L-アミノ酸ホモキラリティを必要とするプロトアンチコドンRNA酵素のモデル」. Journal of Molecular Evolution . 73 ( 1–2 ): 10–22 . Bibcode :2011JMolE..73...10E. doi :10.1007/s00239-011-9453-4 . PMC 3223571. PMID 21779963
- ^ Frenkel-Pinter, Moran; Haynes, Jay W.; C, Martin; Petrov, Anton S.; Burcar, Bradley T.; Krishnamurthy, Ramanarayanan; Hud, Nicholas V.; Leman, Luke J.; Williams, Loren Dean (2019-08-13). 「モデルプレバイオティクスオリゴマー化反応における非タンパク質性カチオン性アミノ酸に対するタンパク質性カチオン性アミノ酸の選択的取り込み」米国科学アカデミー紀要. 116 (33): 16338– 16346. Bibcode :2019PNAS..11616338F. doi : 10.1073/pnas.1904849116 . ISSN 0027-8424. PMC 6697887 . PMID 31358633。
- ^ Thurlkill RL, Grimsley GR, Scholtz JM, Pace CN (2006年5月). 「タンパク質のイオン化可能なグループのpK値」. Protein Science . 15 (5): 1214–8 . doi :10.1110/ps.051840806. PMC 2242523. PMID 16597822 .
- ^ Pace CN, Grimsley GR, Scholtz JM (2009年5月). 「タンパク質のイオン化基:pK値とタンパク質の安定性および溶解性への寄与」. The Journal of Biological Chemistry . 284 (20): 13285–9 . doi : 10.1074/jbc.R800080200 . PMC 2679426. PMID 19164280.
- ^ Byun BJ, Kang YK (2011年5月). セレノシステイン残基の立体配座選択性とpK(a)値」. Biopolymers . 95 (5): 345–53 . doi : 10.1002/bip.21581. PMID 21213257. S2CID 11002236
- ^ Rother M , Krzycki JA (2010年8月). 「セレノシステイン、ピロリシン、そしてメタン生成古細菌の独特なエネルギー代謝」Archaea . 2010 : 1–14 . doi : 10.1155/2010/453642 . PMC 2933860. PMID 20847933.
- ^ Kozlowski LP (2017年1月). 「Proteome-pI:プロテオーム等電点データベース」Nucleic Acids Research . 45 (D1): D1112 – D1116 . doi : 10.1093/nar/gkw978 . PMC 5210655. PMID 27789699
- ^ 「すべての元素の原子量と同位体組成」NIST 。 2016年12月12日閲覧。
- ^ Phillips R, Kondev J, Theriot J, Garcia HG, Orme N (2013).細胞の物理生物学(第2版). Garland Science. p. 178. ISBN 978-0-8153-4450-6.
- ^ Ferrier DR (2005). 「第20章:アミノ酸の分解と合成」. Champe PC, Harvey RA, Ferrier DR (編). Lippincott's Illustrated Reviews: Biochemistry (Lippincott's Illustrated Reviews) . Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-2265-0.
参考文献
- ネルソン、デイビッド・L.、コックス、マイケル・M. (2000).レーニンガー生化学原理(第3版). ワース出版社. ISBN 978-1-57259-153-0.
- Kyte J, Doolittle RF (1982年5月). 「タンパク質のハイドロパシー特性を示すための簡単な方法」. Journal of Molecular Biology . 157 (1): 105–32 . CiteSeerX 10.1.1.458.454 . doi :10.1016/0022-2836(82)90515-0. PMID 7108955.
- Meierhenrich, Uwe J. (2008).アミノ酸と生命の非対称性(第1版). Springer. ISBN 978-3-540-76885-2.
- 生化学、Harpers (2015). Harpers Illustrated Biochemistry (第30版). Lange. ISBN 978-0-07-182534-4.
外部リンク
- アミノ酸の1文字コードの起源