ランドル回路は、グルコース脂肪酸回路とも呼ばれ、グルコースと脂肪酸の基質に対する相互阻害を伴う代謝プロセスです。[1] 2型糖尿病とインスリン抵抗性を説明する役割を果たすと理論づけられています。[2] [3]
1963年にこの種を記述したフィリップ・ランドルにちなんで命名された。 [4]
サイクル

ランドルサイクルは、筋肉や脂肪組織におけるグルコースと脂肪酸の酸化と取り込みをめぐる競合に関与する生化学的メカニズムである。このサイクルは燃料選択を制御し、正常組織における基質の需給を適応させる。このサイクルは、燃料代謝に対するより大まかなホルモン制御に加えて、栄養素を介した微調整を加える。この栄養素の利用可能性への適応は、脂肪組織と筋肉の相互作用に適用される。脂肪組織の脂肪分解を制御するホルモンは、脂肪酸の循環濃度に影響を与え、脂肪酸は筋肉における燃料選択を制御する。ランドルサイクルに関与するメカニズムには、アロステリック制御、可逆的リン酸化、主要酵素の発現などがある。[5]異なる主要栄養素組成からなる食事からのエネルギーバランスは同一であるが、全体的なエネルギーバランスに寄与するグルコースと脂肪のバランスは、食事の組成に応じて変化する。[6]

グルコースは節約され、再ルーティングされる
断食状態
断食中は、脂肪分解が活性化され、呼吸のための優先的な燃料源として脂肪酸が供給されます。肝臓では、脂肪酸 のβ酸化によって局所的なエネルギー需要が満たされ、ケトン体生成(脂肪酸からケトン体を生成すること)につながる可能性があります。ケトン体はその後、肝臓以外の組織の需要を満たすために使用されます。ピルビン酸脱水素酵素レベルでのグルコース酸化の阻害により、糖新生の前駆体であるピルビン酸と乳酸が保持されます。 [5]
連邦州
グルコース脂肪酸回路は、高脂肪食後の摂食状態や運動中にも観察されます。この状態では、血漿中の脂肪酸またはケトン体濃度が上昇します。酸化されなかったグルコースはグリコーゲンへと再配分されます。このグリコーゲンへの再配分は、運動後の筋グリコーゲンの急速な再合成や、飢餓状態や糖尿病時に見られる筋肉中のグリコーゲン含有量の増加を説明しています。このメカニズムは、クエン酸回路の中間体を補充します。[5]
解糖経路の阻害
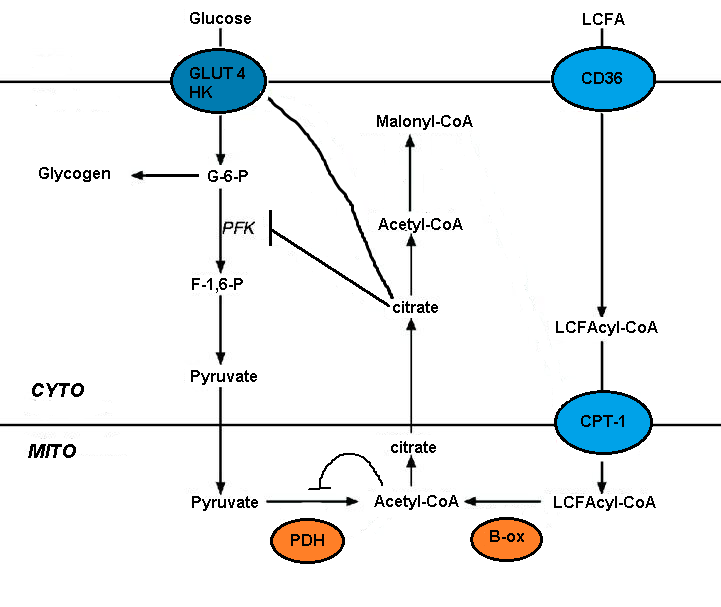
脂肪酸酸化によるグルコース代謝の障害は、いくつかの解糖系の短期的な阻害によって引き起こされる。阻害の程度は解糖経路に沿って増加し、ピルビン酸脱水素酵素のレベルで最も強く、グルコース取り込みと6-ホスホフルクト-1-キナーゼ(PFK-1)のレベルではそれほど強くない。[5]この一連の変化は、脂肪酸酸化によって引き起こされる最初の事象、すなわちミトコンドリア中の[アセチルCoA]/[CoA]および[NADH]/[NAD+]比の上昇によって起こる。これらはいずれもピルビン酸脱水素酵素の活性を阻害する。[7]これらの変化は細胞質クエン酸の蓄積につながり、それがPFK-1を阻害し、続いてグルコース6-リン酸の増加が起こり、最終的にヘキソキナーゼを阻害すると考えられている。[5]
血行動態ストレス
血行動態ストレスは、脂肪酸によるグルコース代謝の阻害を無効化します。この間、基質供給の減少と基質需要の増加が起こります。これにより、細胞内液中のAMP濃度が上昇し、ATP濃度が低下するため、AMP活性化プロテインキナーゼ(AMPK)が活性化されます。ストレス誘導性のAMPK活性化は、即時の代謝適応をもたらし、心臓を虚血性ストレスから保護します。[5] [8] [9]
マロニルCoAによる脂肪酸酸化阻害
マロニルCoAはグルコースの利用を指示し、ミトコンドリアにおける長鎖脂肪酸(LCFA)の取り込みと酸化を制御します。肝臓におけるグルコースの循環は、その取り込みを促進します。グルコースの酸化によりクエン酸が生成され、これはアセチルCoAカルボキシラーゼによってマロニルCoAに変換されます。マロニルCoAは、LCFAの取り込みと酸化を制御するカルニチンパルミトイルトランスフェラーゼ(CPT)の働きを阻害します。グルコース由来のマロニルCoAは、脂肪酸の酸化を防ぎ、脂肪酸のエステル化を促進します。[4] [5]
脂肪酸酸化を制御する細胞質イベント
マロニルCoA濃度
マロニルCoA濃度は、アセチルCoAカルボキシラーゼ(ACC)とマロニルCoA脱炭酸酵素(MCD)のバランスに依存します。AMP活性化プロテインキナーゼ(AMPK)は、肝臓のACCをリン酸化して不活性化することが報告されています。これによりマロニルCoA濃度が低下し、肝臓におけるグルカゴンによる脂肪酸酸化とケトン体生成が促進されます。AMPKは肝臓やその他の組織においてACCをリン酸化して不活性化します。[4] [5]
グルコース-脂肪酸回路におけるAMPKとACCの統合
脂肪酸酸化を阻害するには、ACCが活性化している必要がある。AMPKとMCDはどちらも不活性であり、グルコースの取り込みが促進される。その後、LCFAはエステル化へと経路が転換される。[10]これらの状態は、酸素が豊富な組織で発生し、AMPKが不活性で、グルコースがAMPKを不活性化する(骨格筋で研究されている)。[11]
MCDの阻害は脂肪酸の酸化を抑制し、グルコースの酸化を促進します。MCD欠損マウスを用いた研究では、好気条件下での心臓における脂肪酸とグルコースの酸化に差は見られませんでした。MCDの欠損を補うために、脂肪酸の過剰発現が利用されていると考えられています。[12]
脂肪酸の吸収
長鎖脂肪酸の取り込みは、FAT(脂肪酸トランスロカーゼ)/CD36を含む複数のトランスポーターによって媒介されます。CD36の欠損は脂肪毒性心筋症の症状を緩和します。FAT/CD36はインスリンとAMPKによって制御されている可能性があります。CoA誘導体の形成とそれに伴うAMPKの活性化を伴う輸送の増加は、脂肪酸の効率的な取り込みと代謝を確実にすると考えられます。[5]
燃料選択を制御するミトコンドリアのイベント
脂肪酸は、グルコース酸化を阻害する脂肪酸酸化によってPDHが不活性化されるため、優先的に酸化されます。これは、ミトコンドリア代謝が燃料選択を制御している可能性を示唆しています。細胞呼吸は脂肪酸によって刺激され、これはミトコンドリアにおけるNADHとNAD+の比の上昇と関連しており、エネルギー供給がエネルギー消費を上回っていることを示唆しています。グルコース酸化から脂肪酸酸化への切り替えは、呼吸鎖の複合体1ではなく複合体2に輸送される電子の割合を増加させます。この違いは、酸化的リン酸化の効率を低下させます。脂肪酸を酸化することで、ミトコンドリアは呼吸を増加させ、同時に活性酸素(ROS)の産生を増加させます。[5]
脂肪酸とインスリン
脂肪酸は膵臓β細胞に直接作用し、グルコース刺激によるインスリン分泌を調節する可能性がある。この作用は二相性である。脂肪酸は当初グルコースの作用を増強する。高濃度の脂肪酸に長期間曝露されると、この作用は阻害に変化する。[13]ランドルは、高濃度脂肪酸に起因する生化学的症候群と、飢餓、糖尿病、クッシング症候群などの炭水化物代謝異常との関連性を、脂肪酸症候群という用語で適切に説明できると示唆した。[4]
参考文献
- ^ Bevilacqua S、Buzzigoli G、Bonadonna R、他。 (1990年)。 「NIDDM患者におけるランドル周期の運用」。糖尿病。39 (3): 383–9 .土井:10.2337/糖尿病.39.3.383。PMID 2307295。
- ^ Shuldiner AR, McLenithan JC (2004). 「2型糖尿病の遺伝子と病態生理:ランドルサイクルの繰り返し以上のもの」J. Clin. Invest . 114 (10): 1414–7 . doi :10.1172/JCI23586. PMC 525752 . PMID 15545992.
- ^ Delarue J, Magnan C (2007). 「遊離脂肪酸とインスリン抵抗性」. Current Opinion in Clinical Nutrition and Metabolic Care . 10 (2): 142–8 . doi :10.1097/MCO.0b013e328042ba90. PMID 17285001. S2CID 9620797.
- ^ abcd Randle PJ, Garland PB, Hales CN, Newsholme EA (1963). 「グルコース脂肪酸回路:インスリン感受性と糖尿病の代謝異常における役割」Lancet . 1 (7285): 785–9 . doi :10.1016/S0140-6736(63)91500-9. PMID 13990765.
- ^ abcdefghij Hue L, Taegtmeyer H (2009). 「ランドルサイクルの再考:古い帽子に新しい頭脳を」. American Journal of Physiology. Endocrinology and Metabolism . 297 (3): E578 – E591 . doi :10.1152/ajpendo.00093.2009. PMC 2739696. PMID 19531645 .
- ^ Frayn KN (2003). 「グルコース-脂肪酸回路:生理学的視点」Biochem Soc Trans . 31 (Pt 6): 1115–9 . doi :10.1042/bst0311115. PMID 14641007.
- ^ Bowker-Kinley MM, Davis WI, Wu P, Harris RA, Popov KM (1998). 「哺乳類ピルビン酸脱水素酵素複合体の組織特異的制御の存在を示す証拠」Biochem. J. 329 : 191–6 . doi : 10.1042/bj3290191. PMC 1219031. PMID 9405293 .
- ^ Kudo N, Gillespie JG, Kung L, Witters LA, Schulz R, Clanachan AS, Lopaschuk GD (1996). 「心臓における5'AMP活性化プロテインキナーゼ活性の特性と虚血後の再灌流におけるアセチルCoAカルボキシラーゼ阻害における役割」Biochim Biophys Acta . 1301 ( 1–2 ): 67–75 . doi : 10.1016/0005-2760(96)00013-6 . PMID 8652652.
- ^ Goodwin GW, Taegtmeyer H (2000). 「運動時の代謝状態における心臓のエネルギー恒常性の改善」. American Journal of Physiology. Heart and Circulatory Physiology . 279 (4): H1490 – H1501 . doi :10.1152/ajpheart.2000.279.4.H1490. PMID 11009433.
- ^ Clark H, Carling D, Saggerson D (2004). 「長鎖脂肪酸の生理的濃度に対する心臓AMP活性化プロテインキナーゼの共有結合活性化」Eur J Biochem . 271 (11): 2215–24 . doi : 10.1111/j.1432-1033.2004.04151.x . PMID 15153111.
- ^ Itani SI; Saha AK; Kurowski TG; Coffin HR; Tornheim K; Ruderman NB (2003). 「グルコースは骨格筋への取り込みを自動制御する - AMP活性化プロテインキナーゼの関与」. Diabetes . 52 (7): 1635– 1640. doi : 10.2337/diabetes.52.7.1635 . PMID 12829626.
- ^ Dyck JRB, Hopkins TA, Bonnet S, Michelakis ED, Young ME, Watanabe M, Kawase Y, Jishage K, Lopaschuk GD (2006). 「マウスにおけるマロニルコエンザイムA脱炭酸酵素の欠損は心臓のグルコース酸化を促進し、虚血性障害から心臓を保護する」アメリカ心臓協会誌. 114 (16): 1721– 1728. doi : 10.1161/CIRCULATIONAHA.106.642009 . PMID 17030679.
- ^ Grill V, Qvigstad E (2000). 「脂肪酸とインスリン分泌」. British Journal of Nutrition . 83 : S79 – S84 . doi : 10.1017/S0007114500000994 . PMID 10889796.