軌道混成
化学 において、軌道混成(または混成)とは、原子軌道を混合して、原子価結合理論において電子の対合に適した新しい混成軌道(構成原子軌道とは異なるエネルギー、形状などを持つ)を形成するという概念である。例えば、4つの単結合を形成する炭素原子では、価電子殻s軌道が3つの価電子殻p軌道と結合して、炭素の周りに四面体配置で4つの等価なsp 3混合物を形成し、4つの異なる原子と結合する。混成軌道は、分子構造や原子結合特性の説明に役立ち、空間的に対称的に配置されている。通常、混成軌道は、同等のエネルギーの原子軌道を混合することによって形成される。[ 1 ]
歴史と用途
化学者ライナス・ポーリングは1931年、メタン(CH 4)のような単純な分子の構造を原子軌道を用いて説明する混成理論を初めて提唱しました。[ 2 ]ポーリングは、炭素原子は1つのs軌道と3つのp軌道を用いて4つの結合を形成することを指摘しました。そのため、炭素原子はp軌道を用いて直角に3つの結合を形成し、さらに任意の方向にs軌道を用いて4つ目のより弱い結合を形成すると「推測できる」としました。実際には、メタンには同等の強度のC–H結合が4つあります。任意の2つの結合間の角度は、正四面体結合角109°28' [ 3 ](約109.5°)です。ポーリングは、4つの水素原子が存在する場合、s軌道とp軌道が4つの同等の組み合わせを形成すると仮定し、これを混成軌道と呼びました。それぞれの混成軌道は、その構成を示すためにsp 3で示され、4つのC–H結合のいずれかに沿って配向されています。[ 4 ]この概念は、このような単純な化学系のために開発されたが、後にこのアプローチはより広く応用され、今日では有機化合物の構造を合理化するための効果的なヒューリスティックと考えられている。この概念は、ルイス構造と同等の単純な軌道図を与える。
混成理論は有機化学の不可欠な要素であり、最も説得力のある例の一つはボールドウィン則である。反応機構を描くには、2つの原子が2つの電子を共有する古典的な結合図が必要となる場合がある。[ 5 ]混成理論はアルケン[ 6 ]やメタン[ 7 ]の結合を説明する。主に軌道混成によって決定されるp性またはs性の量は、酸性または塩基性などの分子特性を確実に予測するために用いることができる。[ 8 ]
概要
軌道は分子内の電子の振る舞いをモデル的に表現したものです。単純混成の場合、この近似は原子軌道に基づいています。これは、シュレーディンガー方程式を正確に解くことができる唯一の中性原子である水素原子で得られる軌道に似ています。炭素、窒素、酸素などのより重い原子では、2s軌道と2p軌道が原子軌道として用いられ、これは水素の励起状態軌道に似ています。
混成軌道は、様々な割合で重なり合った原子軌道の混合物であると想定されています。たとえば、メタンでは、各炭素–水素結合を形成する C 混成軌道は、25% の s 特性と 75% の p 特性で構成されているため、sp 3 ( sp-threeと読む) 混成軌道として説明されます。量子力学では、この混成軌道を の形式のsp 3波動関数として説明し、ここで N は正規化定数(ここでは 1/2) であり、pσ は CH 軸に沿って向いてシグマ結合を形成する p 軌道です。この例では、係数の比 (一般に λ と表記) は です。軌道に関連付けられた電子密度は波動関数の 2 乗に比例するため、p 特性と s 特性の比は λ 2 = 3 です。p 特性、つまり p 成分の重みは N 2 λ 2 = 3/4 です。
種類
sp 3

混成とは、原子の視点から見た原子の結合状態を表します。四面体配位炭素(例:メタンCH 4)の場合、炭素は4つの水素原子に向かう4つの軌道を持つ必要があります。
炭素の基底状態の構成は、1s 2 2s 2 2p 2またはもっと簡単に読むことができます。
| C | ↑↓ | ↑↓ | ↑ | ↑ | |
| 1秒 | 2秒 | 2ページ | 2ページ | 2ページ |
この図は、炭素原子が2つの単独占有p型軌道を用いてメチレン(CH 2 )分子中の2つの水素原子と2つの共有結合を形成できることを示唆しており、その仮想的な結合角は、同じ原子上の2つのp軌道間の角度に相当する90°である。しかし、一重項メチレンにおける真のH–C–H角は約102° [ 9 ]であり、何らかの軌道混成が存在することを示唆している。
炭素原子は、二重占有の 2s 軌道から空の 2p 軌道へ電子を励起 (または昇格) することで、メタン内の 4 つの水素原子と結合し、4 つの単一占有軌道を生成することもできます。
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1秒 | 2秒 | 2ページ | 2ページ | 2ページ |
2 つの追加結合の形成によって放出されるエネルギーは、必要な励起エネルギーを補う以上のものであり、エネルギー的には 4 つの CH 結合の形成に有利になります。
量子力学によれば、4つの結合が等価であるとき、エネルギーは最も低くなる。これは、炭素原子上の等価な軌道から結合が形成されることを必要とする。価電子殻(コア軌道は結合にほとんど関与しない)のs波動関数とp波動関数の線形結合として、4つの等価な軌道のセットが得られる。[ 10 ]これらは4つのsp 3混成軌道である。
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1秒 | sp 3 | sp 3 | sp 3 | sp 3 |
CH 4では、4 つの sp 3混成軌道が 4 つの水素の 1s 軌道と重なり合い、長さと強度が等しい 4 つのσ (シグマ) 結合(つまり、4 つの単共有結合) が生成されます。
次の:

翻訳すると次のようになります。

sp 2


他の炭素化合物や分子も同様の方法で説明できます。例えば、エチレン(C 2 H 4)は炭素間に二重結合を持っています。この分子では、炭素間の二重結合には1つのπ(パイ)結合が必要であり、炭素原子1つあたり3つのσ結合しか形成されないため、炭素はsp 2混成します。sp 2混成では、2s 軌道は3つの2p 軌道(通常2p xおよび2p yと表記)のうち2つだけと混成されます。3つ目の2p 軌道(2p z)は混成されません。
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1秒 | sp 2 | sp 2 | sp 2 | 2ページ |
合計3つのsp 2軌道と残りの1つのp軌道を形成する。エチレンでは、2つの炭素原子は、それぞれの炭素原子から1つのsp 2軌道が重なり合うことでσ結合を形成する。分子平面に垂直な炭素原子間のπ結合は、2p-2p軌道の重なりによって形成される。各炭素原子は、2つの水素原子とs-sp 2軌道の重なり合うことでC-H共有結合を形成し、その結合角は全て120°である。水素-炭素結合は全て等しい強度と長さを持ち、実験データと一致する。
sp

三重結合を持つアルキンなどの化合物における化学結合は、sp混成によって説明されます。このモデルでは、2s軌道は3つのp軌道のうち1つだけと混ざり合っています。
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1秒 | sp | sp | 2ページ | 2ページ |
その結果、2つのsp軌道と2つのp軌道が残ります。アセチレン(エチン)(C 2 H 2)の化学結合は、2つの炭素原子間のsp-sp重なりによるσ結合と、p-p重なりによる2つのπ結合で構成されています。また、各炭素原子は水素原子とも180°の角度でσs-sp重なりで結合しています。
分子の形状

混成は分子の形状を説明するのに役立ちます。なぜなら、結合間の角度は混成軌道間の角度とほぼ等しいからです。これは、価電子殻電子対反発(VSEPR)理論とは対照的です。VSEPR理論は、価電子結合理論や軌道理論ではなく、経験則に基づいて分子の形状を予測するために使用できます。[ 11 ]
sp x交雑
典型元素の価電子軌道は、対応するオクテット則を持つ 1 つの s 軌道と 3 つの p 軌道であるため、sp x混成を使用してこれらの分子の形状をモデル化します。
| コーディネート番号 | 形 | 交配 | 例 |
|---|---|---|---|
| 2 | リニア | sp混成(180°) | CO2 |
| 3 | 三角平面 | sp 2混成(120°) | BCl3 |
| 4 | 四面体 | sp 3混成(109.5°) | CCl4 |
| 眼窩間角[ 12 ] | |||
sp x d y交雑
遷移金属の価電子軌道は5つのd軌道、1つのs軌道、そして3つのp軌道から成り、それぞれ18電子則に従うため、sp x d y混成がこれらの分子の形状をモデル化するために用いられる。これらの分子は、異なるd軌道が関与するため、同じ混成に対応する複数の形状をとる傾向がある。平面正方錯体は1つの空軌道を持つため、価電子は16個となる。[ 13 ]
| コーディネート番号 | 形 | 交配 | 例 |
|---|---|---|---|
| 4 | 正方形平面 | sp 2 d 交雑 | 白金塩化物4 2− |
| 5 | 三角両錐形 | sp 3 dハイブリダイゼーション | Fe(CO) 5 |
| 四角錐 | 塩化マンガン5 2− | ||
| 6 | 八面体 | sp 3 d 2混成 | モリブデン(CO) 6 |
| 7 | 五角両錐形 | sp 3 d 3混成 | ZrF 7 3− |
| 蓋付き八面体 | 財務大臣7 − | ||
| キャップ付き三角柱 | タフ7 2− | ||
| 8 | 角柱逆柱状 | sp 3 d 4交雑 | ReF 8 − |
| 十二面体 | モリブデン(CN) 8 4− | ||
| 双頭三角柱 | ZrF 8 4− | ||
| 9 | 三冠三角柱 | sp 3 d 5交雑 | レH 9 2− |
| キャップ付き正方形逆角柱 |
SD x交配
d電子数が少ない特定の遷移金属錯体ではp軌道は空軌道であり、sdx混成がこれらの分子の形状をモデル化するために使用される。[ 12 ] [ 14 ] [ 13 ]
| コーディネート番号 | 形 | 交配 | 例 |
|---|---|---|---|
| 3 | 三角錐 | sd 2混成(90°) | CrO 3 |
| 4 | 四面体 | sd 3ハイブリダイゼーション(70.5°、109.5°) | 塩化チタン |
| 5 | 四角錐 | sd 4ハイブリダイゼーション(65.9°、114.1°) | タングステン(CH 3 ) 5 |
| 6 | C 3v三角柱 | sd 5交雑 (63.4°, 116.6°) | W(CH 3 ) 6 |
| 眼窩間角[ 12 ] | |||
超原子価分子
オクテット展開
一部の一般化学教科書では、主族配位数5以上の混成について、ポーリングが初めて提唱したd軌道を用いた「拡張オクテット」方式を用いて説明されている。しかし、このような方式は、計算化学計算の観点から現在では誤りであると考えられている。
| コーディネート番号 | 分子の形状 | 交配 | 例 |
|---|---|---|---|
| 5 | 三角両錐形 | sp 3 dハイブリダイゼーション | PF5 |
| 6 | 八面体 | sp 3 d 2混成 | SF6 |
| 7 | 五角両錐形 | sp 3 d 3混成 | IF 7 |
1990年、ニューサウスウェールズ大学のエリック・アルフレッド・マグナソンは、第二周期(第3周期)元素の超原子価化合物における結合におけるd軌道混成の役割を明確に否定する論文を発表し、論争と混乱に終止符を打った。この混乱の一部は、これらの化合物を記述するために使用される基底関数系においてd関数が不可欠であるという事実(そうでなければ、不当に高いエネルギーと歪んだ構造が生じる)に起因している。また、d関数が分子波動関数に大きく寄与している。これらの事実は、d軌道が結合に関与しているに違いないという意味に誤って解釈された。[ 15 ] [ 16 ]
共振
計算化学の観点から見ると、混成に加えてシグマ結合共鳴を考慮する方がより良い扱い方となるだろう。これは、各共鳴構造が独自の混成スキームを持つことを意味する。すべての共鳴構造はオクテット則に従わなければならない。[ 17 ]
| コーディネート番号 | 共鳴構造 |
|---|---|
| 5 | 三角両錐形 |
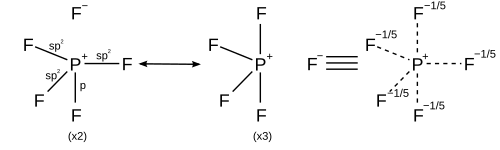 | |
| 6 | 八面体 |
 | |
| 7 | 五角両錐形 |
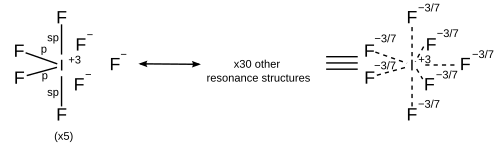 |
計算VB理論では
分子の形状を説明するために、軌道混成の単純なモデルが一般的に用いられていますが、現代の原子価結合計算プログラムでは、混成は異なる方法で計算されます。具体的には、混成は事前に決定されるのではなく、変分最適化によって最低エネルギー解が求められ、その結果が報告されます。これは、軌道混成に対するすべての人為的な制約、具体的には2つの制約が解除されることを意味します。
- 混成は整数値に制限される(等価混成)
- 混成軌道が互いに直交していること(混成欠陥)
つまり、実際には混成軌道は一般に教えられている単純な考え方に従わず、そのため科学計算論文では、より具体的な整数値ではなく、その性質を表すために単に sp x、 sp x d y、または sd x混成軌道と呼ばれます。
等価交雑
理想的な混成軌道は有用ですが、現実にはほとんどの結合は中間的な性質を持つ軌道を必要とします。そのため、各タイプの原子軌道(s、p、d)に柔軟な重み付けを組み込む拡張が必要となり、分子構造が理想的な結合角から外れた場合の結合形成を定量的に記述できるようになります。p性の量は整数値に限定されません。つまり、sp 2.5のような混成も容易に記述できます。
結合軌道の混成はベントの規則によって決定されます。「原子の s 特性は電気陽性置換基に向かう軌道に集中する」。
孤立電子対を持つ分子の場合、結合軌道は等価のsp x混成軌道となる。例えば、水中の酸素の2つの結合形成混成軌道はsp 4.0と記述され、軌道間角は104.5°となる。[ 18 ]これは、これらの混成軌道が20%のs性と80%のp性を持つことを意味しており、酸素の2pサブシェルには3つのp軌道しか含まれていないため、酸素の1つのs軌道と4つのp軌道から混成軌道が形成されることを意味するものではない。
交雑欠陥
s軌道とp軌道が混成して有効なsp x混成体を形成するには、それらの半径が同程度であることが必要である。2p軌道は平均して2s軌道より10%未満大きいが、これは2p軌道に半径の節点が存在しないことに一部起因する。一方、半径の節点を1つ持つ3p軌道は、3s軌道より20~33%大きい。[ 19 ] s軌道とp軌道の半径の差は、グループが進むにつれて大きくなる。化学結合における原子の混成は、局在分子軌道を考慮することで解析できる。例えば、自然結合軌道(NBO)スキームにおいて、自然に局在する分子軌道を用いる。メタン(CH 4 )では、計算されたp/s比は約3であり、「理想的な」sp 3混成と一致するが、シラン(SiH 4 )では、p/s比は2に近い。他の2p元素でも同様の傾向が見られる。水素をフッ素に置換すると、p/s比はさらに低下する。[ 20 ] 2p元素は、直交混成軌道を持つほぼ理想的な混成を示す。より重いpブロック元素では、この直交性の仮定は正当化されない。これらの理想的な混成からの逸脱は、クッツェルニッグによって混成欠陥と名付けられた。[ 21 ]
しかし、ジェラット、クーパー、ライモンディ(SCVB)やシャイク、ヒバティ(VBSCF)などの計算VBグループは、さらに一歩進んで、メタン、エチレン、アセチレンなどのモデル分子の場合でも混成軌道に欠陥があり非直交であり、メタンではsp 3ではなくsp 1.76のような混成になっていると主張しています。[ 22 ]
光電子スペクトル
軌道混成に関する誤解の 1 つは、多くの分子の紫外線光電子スペクトルが誤って予測されるというものです。クープマンスの定理を局在混成体に適用する場合はこのことが当てはまりますが、量子力学では (この場合はイオン化された) 波動関数が分子の対称性に従うことが要求され、これは原子価結合理論における共鳴を意味します。たとえば、メタンでは、イオン化状態 (CH 4 + ) は、放出された電子を 4 つの sp 3軌道のそれぞれに帰属させる 4 つの共鳴構造から構成できます。これら 4 つの構造の線形結合は、構造の数を保存し、3 重に縮退した T 2状態と A 1状態につながります。[ 23 ] [ 24 ]各イオン化状態と基底状態とのエネルギー差はイオン化エネルギーとなり、実験結果と一致する 2 つの値が得られます。

局在分子軌道と正準分子軌道
混成原子軌道から形成される結合軌道は、分子軌道理論の非局在軌道から適切な数学的変換によって形成される局在分子軌道とみなすことができます。基底状態の分子の場合、この軌道変換によって多電子波動関数全体は変化しません。したがって、基底状態の混成軌道による記述は、基底状態の全エネルギーと電子密度、そして全エネルギーが最小となる分子構造に対する非局在軌道による記述と 等価です。
2つのローカライズされた表現

多重結合または複数の孤立電子対を持つ分子は、シグマ対称性およびパイ対称性、あるいはそれと等価な軌道で表される軌道を持つことがあります。異なる価電子結合法では、これら2つの表現のいずれかが用いられます。これらの表現は数学的に等価な多電子波動関数を持ち、占有分子軌道の集合の ユニタリー変換によって関連付けられています。
多重結合の場合、等価軌道(曲がった結合)表現よりもシグマパイ表現が主流である。対照的に、多重孤立電子対の場合、ほとんどの教科書は等価軌道表現を使用している。しかし、シグマパイ表現は、古典的(価電子結合/ルイス構造)結合対と孤立電子対の現代版類似体を含む局所軌道理論である自然結合軌道の文脈内で、WeinholdとLandisによって使用されるなど、また、例えば、自然結合軌道の文脈内でも使用される。[ 25 ]例えば、フッ化水素分子の場合、2つのF孤立電子対は本質的に非混成p軌道であるが、もう1つはsp x混成軌道である。同様の考慮が水にも当てはまる(1つのO孤立電子対は純粋なp軌道にあり、もう1つはsp x混成軌道にある)。
参照
参考文献
- ^ハウスクロフト、キャサリン・E.、シャープ、アラン・G. (2005).無機化学(第2版). ピアソン・プレンティス・ホール. p. 100. ISBN 0130-39913-2。
- ^ Pauling, L. (1931), 「化学結合の性質。量子力学と常磁性磁化率理論から得られた結果の分子構造への応用」アメリカ化学会誌、53 (4): 1367– 1400、Bibcode : 1931JAChS..53.1367P、doi : 10.1021/ja01355a027
- ^ Brittin, WE (1945). 「四面体炭素原子の原子価角」. J. Chem. Educ. 22 (3): 145. Bibcode : 1945JChEd..22..145B . doi : 10.1021/ed022p145 .
- ^ L. ポーリング『化学結合の性質』(第3版、オックスフォード大学出版局、1960年)111~120ページ。
- ^クレイデン, ジョナサン; グリーブス, ニック;ウォーレン, スチュアート;ウォザーズ, ピーター(2001).有機化学(第1版). オックスフォード大学出版局. p. 105. ISBN 978-0-19-850346-0。
- ^有機化学、第3版 マリー・アン・フォックス ジェームズ・K・ホワイトセル2003 ISBN 978-0-7637-3586-9
- ^有機化学第3版2001ポーラ・ユルカニス・ブルースISBN 978-0-130-17858-9
- ^ 「酸と塩基」 Orgo Made Simple . 2015年2月4日時点のオリジナルよりアーカイブ。 2015年6月23日閲覧。
- ^ Isaiah Shavitt (1985),「メチレンの幾何学と一重項-三重項エネルギーギャップ:実験的および理論的決定の批判的レビュー」Tetrahedron、第41巻、第8号、1531ページdoi : 10.1016/S0040-4020(01)96393-8
- ^ McMurray, J. (1995). 化学注釈付き指導者用版(第4版). Prentice Hall. p. 272. ISBN 978-0-131-40221-8
- ^ Gillespie, RJ (2004)、「VSEPRモデルを用いた分子構造の指導」、Journal of Chemical Education、81 (3): 298– 304、Bibcode : 2004JChEd..81..298G、doi : 10.1021/ed081p298
- ^ a b cフランク・ウェインホールド、クラーク・R・ランディス(2005年)『原子価と結合:自然結合軌道のドナー・アクセプター的視点』ケンブリッジ:ケンブリッジ大学出版局、pp. 367, 374– 376, 381– 383. ISBN 978-0-521-83128-4。
- ^ a b Bayse, Craig; Hall, Michael (1999). 「対称性解析による単純遷移金属ポリヒドリド錯体の形状予測」. J. Am. Chem. Soc. 121 (6): 1348– 1358. Bibcode : 1999JAChS.121.1348B . doi : 10.1021/ja981965+ .
- ^カウプ、マーティン(2001年)。「d(0)系における「非VSEPR」構造と結合」。Angew Chem Int Ed Engl . 40 (1): 3534– 3565. doi : 10.1002/1521-3773(20011001)40:19<3534::AID-ANIE3534>3.0.CO;2-# . PMID 11592184 .
- ^ Magnusson, E. (1990). 「第二周期元素の超配位分子:d関数かd軌道か?」J. Am. Chem. Soc . 112 (22): 7940– 7951. Bibcode : 1990JAChS.112.7940M . doi : 10.1021/ja00178a014 .
- ^ David L. Cooper; Terry P. Cunningham; Joseph Gerratt; Peter B. Karadakov; Mario Raimondi (1994). 「超配位第二周期原子への化学結合:d軌道への参加と民主主義」アメリカ化学会誌. 116 (10): 4414– 4426. Bibcode : 1994JAChS.116.4414C . doi : 10.1021/ja00089a033 .
- ^ Richard D. Harcourt; Thomas M. Klapötke (2003). 「電子過剰フッ素含有分子の電子構造の原子価増加(定性的原子価結合)による記述」. Journal of Fluorine Chemistry . 123 (1): 5– 20. Bibcode : 2003JFluC.123....5H . doi : 10.1016/S0022-1139(03)00012-5 .
- ^ Frenking, Gernot; Shaik, Sason編 (2014). 「第3章 NBOによる化学結合の視点」. 『化学結合:化学結合の基礎的側面』 . John Wiley & Sons. ISBN 978-3-527-66471-9。
- ^ Kaupp, Martin (2007). 「原子軌道のラジアルノードの化学結合と周期表における役割」 . Journal of Computational Chemistry . 28 (1): 320– 325. Bibcode : 2007JCoCh..28..320K . doi : 10.1002 / jcc.20522 . ISSN 0192-8651 . PMID 17143872. S2CID 12677737 .
- ^ Kaupp, Martin (2014) [初版 2014]. 「第1章:典型元素の化学結合」. Frenking, Gernod & Shaik, Sason (編) 『化学結合:周期表を横断する化学結合』 . Wiley-VCH. ISBN 9781234567897。
- ^ Kutzelnigg, W. (1988年8月). 「直交ハイブリッドと非直交ハイブリッド」. Journal of Molecular Structure: THEOCHEM . 169 : 403–419 . doi : 10.1016/0166-1280(88)80273-2 .
- ^ Shaik, Sason; Danovich, David; Hiberty, Philippe (2022). 「原子価結合理論における化学結合の性質について」(PDF) . The Journal of Chemical Physics . 157 (9): 090901. Bibcode : 2022JChPh.157i0901S . doi : 10.1063/5.0095953 . PMID 36075734 .
- ^ Andrei M. Tokmachev; Andrei L. Tchougreeff; Igor A. Misurkin (2001). 「厳密に局所化されたジェミナルアプローチの半経験的反対称化積におけるイオン化ポテンシャル」. International Journal of Quantum Chemistry . 85 (3): 109– 117. doi : 10.1002/qua.1060 .
- ^ Sason S. Shaik; Phillipe C. Hiberty (2008). 『化学者のための原子価結合理論ガイド』ニュージャージー州: Wiley-Interscience. pp. 104– 106. ISBN 978-0-470-03735-5。
- ^ウェインホールド、フランク、ランディス、クラーク・R. (2012). 『自然結合軌道による化学の発見』ホーボーケン、ニュージャージー州: ワイリー、pp. 67– 68. ISBN 978-1-118-11996-9。




