| |
 | |
| 臨床データ | |
|---|---|
| ATCコード |
|
| 識別子 | |
| |
| CAS番号 | |
| PubChem CID |
|
| IUPHAR/BPS |
|
| ドラッグバンク | |
| ケムスパイダー | |
| ユニイ |
|
| チェビ | |
| チェムブル | |
| PDBリガンド |
|
| CompToxダッシュボード (EPA) |
|
| ECHA 情報カード | 100.109.946 |
| 化学および物理データ | |
| 式 | C 28 H 26 N 4 O 3 |
| モル質量 | 466.541 g·mol −1 |
| 3Dモデル(JSmol) |
|
| |
 北 北 はい (これは何ですか?)(確認) はい (これは何ですか?)(確認) | |
スタウロスポリン(抗生物質AM-2282またはSTS)は、1977年にストレプトマイセス・スタウロスポレウス(Streptomyces staurosporeus)から単離された天然物です。[1]スタウロスポリンは、このタイプのビスインドール化学構造を共有する50種類以上のアルカロイド の中で最初のものでした。スタウロスポリンの化学構造は、 1994年にX線結晶構造解析によって解明されました。[2]
スタウロスポリンは、抗真菌作用から抗高血圧作用に至るまで、幅広い生物学的活性を持つことが発見されました。[3] これらの活性への関心から、化学と生物学の分野で大規模な研究が行われ、抗がん治療の可能性が発見されました。
生物学的活動
スタウロスポリンの主な生物学的活性は、キナーゼへのATP結合を阻害することにより、タンパク質キナーゼを阻害することである。これは、スタウロスポリンがキナーゼのATP結合部位に強い親和性を示すことで達成される。スタウロスポリンは、多くのキナーゼに高い親和性を示すものの、選択性は低いという点で、典型的なATP競合型キナーゼ阻害剤である。[4]キナーゼポケットの構造解析により、スタウロスポリンに対する相対位置が保存されている主鎖原子が、スタウロスポリンの多様性に寄与していることが実証された。[5]この特異性の欠如は、スタウロスポリンの臨床応用を妨げているが、貴重な研究ツールとなっている。研究では、スタウロスポリンはアポトーシスを誘導するために使用されている。これがどのように媒介されるのかというメカニズムは十分に解明されていない。スタウロスポリンがアポトーシスを誘導する方法の一つは、カスパーゼ3を活性化することであることがわかっています。[6]低濃度では、細胞の種類に応じて、スタウロスポリンは特定の細胞周期効果を誘導し、細胞を細胞周期のG1期またはG2期で停止させます。 [7]
化学ファミリー
スタウロスポリンはインドロカルバゾールの一種である。インドロカルバゾールの中で最も頻繁に単離されるグループであるインドロ(2,3-a)カルバゾールに属する。このうち、スタウロスポリンは最も一般的なサブグループであるインドロ(2,3-a)ピロール(3,4-c)カルバゾールに属する。これらは、ハロゲン化(塩素化)と非ハロゲン化の2つのクラスに分類される。ハロゲン化インドロ(2,3-a)ピロール(3,4-c)カルバゾールは、C-7炭素が完全に酸化され、β-グリコシド結合を含むインドール窒素が1つだけ存在する。一方、非ハロゲン化インドロ(2,3-a)ピロール(3,4-c)カルバゾールは、グリコシル化されたインドール窒素と、完全に還元されたC-7炭素の両方を有する。スタウロスポリンは非ハロゲン化クラスに属する。[8]
スタウロスポリンは、新規タンパク質キナーゼ阻害剤 ミドスタウリン(PKC412)の前駆体です。[9] [10]ミドスタウリンに加え、スタウロスポリンはK252c(スタウロスポリンアグリコンとも呼ばれる)の商業的合成における出発物質としても使用されています。天然の生合成経路において、K252cはスタウロスポリンの前駆体です。

生合成
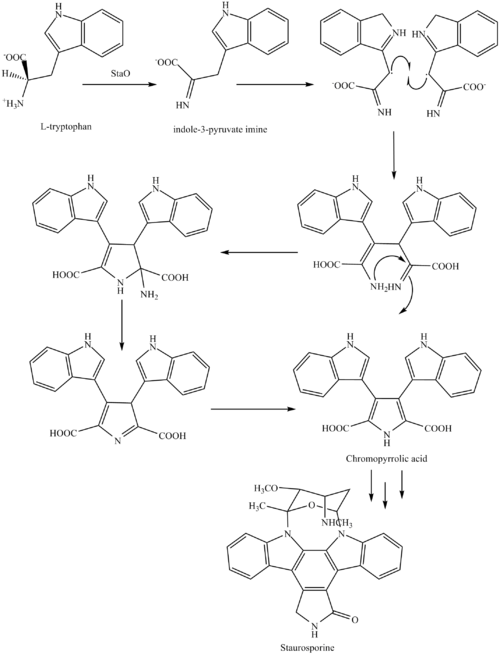
スタウロスポリンの生合成は、両性イオン型のアミノ酸L-トリプトファンから始まります。トリプトファンは、 L-アミノ酸酸化酵素(FAD依存性と思われる)である酵素StaOによってイミンに変換されます。このイミンはStaDの作用を受け、2つのイミン分子間の二量化生成物と考えられる、未同定の中間体を形成します。クロモピロール酸は、この中間体からVioE(ビオラセインの生合成に利用されます。ビオラセインは、この経路の分岐点から生成され、レベッカマイシンにも分岐する天然物です)が失われた後に生成される分子です。シトクロムP450酵素によって触媒されると考えられるアリール-アリールカップリング反応により、芳香族環系が形成されます。[8]
続いてインドール窒素間の求核攻撃が起こり、環化が起こり、その後StaCの支援を受けて脱炭酸反応が起こり、スタウロスポリンアグリコン、すなわちK252cのみが生成される。グルコースはStaA/B/E/J/I/KによってNTP-L-リストアミンに変換され、続いてStaGによってスタウロスポリンアグリコンの1位インドール窒素に付加される。StaN酵素は糖を2位インドール窒素に付加することで不利な立体配座に転位させ、中間体O-デメチル-N-デメチルスタウロスポリンを形成する。最後に、StaMAによる4'アミンのO-メチル化とStaMBによる3'-ヒドロキシのN-メチル化により、スタウロスポリンが形成される。[8]
前臨床研究
リポソーム ナノ粒子に封入されたスタウロスポリンは、マウスモデルにおいて、アポトーシス阻害活性の高い抗がん剤としての使用を阻んできた毒性副作用を伴わずに、生体内で腫瘍を抑制することが示されています。カリフォルニア大学サンディエゴ校ムーアがんセンターの研究者たちは、細胞のpH環境を操作することで、高い薬剤負荷効率を実現するプラットフォーム技術を開発しました。マウスの神経膠芽腫モデルにスタウロスポリンを注入したところ、蛍光観察により、スタウロスポリンは主に腫瘍に蓄積することが確認されました。また、遊離化合物を投与された対照群マウスと比較して、マウスの体重減少は見られず、毒性の低減が示唆されました。[11] [12]
スタウロスポリンに密接に関連する化合物のリスト
参考文献
- ^ 大村 誠、岩井 勇、平野 明、中川 明、粟屋 純、土屋 秀、他 (1977年4月). 「ストレプトマイセス由来の新規アルカロイドAM-2282.分類、発酵、単離および予備的特性評価」. The Journal of Antibiotics . 30 (4): 275– 282. doi : 10.7164/antibiotics.30.275 . PMID 863788.
- ^ 船戸直、高柳秀、今田裕、戸田裕、針ヶ谷裕、大村秀 (1994). 「X線解析によるスタウロスポリンの絶対配置」。四面体レット。35 (8): 1251–1254。土井:10.1016/0040-4039(94)88036-0。
- ^ Rüegg UT, Burgess GM (1989年6月). 「スタウロスポリン、K-252、UCN-01:強力だが非特異的なタンパク質キナーゼ阻害剤」. Trends in Pharmacological Sciences . 10 (6): 218–20 . doi :10.1016/0165-6147(89)90263-0. PMID 2672462.
- ^ Karaman MW, Herrgard S, Treiber DK, Gallant P, Atteridge CE, Campbell BT, et al. (2008年1月). 「キナーゼ阻害剤の選択性の定量分析」. Nature Biotechnology 26 ( 1): 127– 132. doi :10.1038/nbt1358. PMID 18183025. S2CID 205273598.
- ^ Tanramluk D, Schreyer A, Pitt WR, Blundell TL (2009年7月). 「酵素阻害剤の選択性と乱交性の起源:スタウロスポリンへのタンパク質キナーゼ結合の事例研究」. Chemical Biology & Drug Design . 74 (1): 16– 24. doi :10.1111/j.1747-0285.2009.00832.x. PMC 2737611. PMID 19519740 .
- ^ Chae HJ、Kang JS、Byun JO、Han KS、Kim DU、Oh SM、他。 (2000年10月)。 「骨芽細胞におけるスタウロスポリン誘導性アポトーシスの分子機構」。薬理学的研究。42 (4): 373–381 .土井:10.1006/phrs.2000.0700。PMID 10987998。
- ^ Bruno S, Ardelt B, Skierski JS, Traganos F, Darzynkiewicz Z (1992年1月). 「タンパク質キナーゼ阻害剤スタウロスポリンの正常リンパ球および白血病リンパ球の細胞周期およびクロマチン構造に対する異なる影響」. Cancer Research . 52 (2): 470– 473. PMID 1728418.
- ^ abc Ryan KS (2008). 「レベッカマイシン、スタウロスポリン、およびビオラセイン生合成酵素の構造研究」(PDF) .博士論文. マサチューセッツ工科大学. オリジナル(PDF)から2012年3月14日にアーカイブ。
- ^ Midostaurin Archived 2014-09-01 at the Wayback Machine product page, Fermentek
- ^ Wang Y, Yin OQ, Graf P, Kisicki JC, Schran H (2008年6月). 「糖尿病患者におけるミドスタウリンの用量および時間依存性薬物動態」. Journal of Clinical Pharmacology . 48 (6): 763– 775. doi :10.1177/0091270008318006. PMID 18508951. S2CID 26657407.
- ^ ニュースリリース(2013年10月21日)「研究により、扱いが難しいながらも非常に強力な抗がん化合物の安全な送達システムが特定された」カリフォルニア大学サンディエゴ校ヘルスシステム。 2013年10月27日閲覧。
- ^ Mukthavaram R, Jiang P, Saklecha R, Simberg D, Bharati IS, Nomura N, et al. (2013). 「チロシンキナーゼ阻害剤の高効率リポソームカプセル化は、in vivo毒性および腫瘍反応プロファイルの改善につながる」International Journal of Nanomedicine . 8 (1): 3991– 4006. doi : 10.2147/IJN.S51949 . PMC 3808212 . PMID 24174874.