| 表面鉄沈着症 | |
|---|---|
| その他の名前 | 中枢神経系の表在性ヘモジデローシス、中枢神経系の表在性ヘモジデローシス、中枢神経系の表在性ヘモジデローシス |
中枢神経系の表在性ヘモジデローシスは、脳脊髄液に関連する神経組織への慢性的な鉄沈着によって起こる脳の病気です。これは、神経組織へのヘモジデリンの沈着により起こり、神経細胞の喪失、神経膠症、および脱髄を伴います。この病気は、1908年にRCハミルが剖検を行った後に初めて発見されました。[1]この病気の検出は、MRI技術の出現により診断がはるかに容易になるまで、主に死後に行われました。表在性ヘモジデローシスは、一般的に希少疾患とみなされており、2006年時点で科学文献に報告された症例は合計270件未満であり、[2]幅広い年齢層の人々に影響を与え、男性は女性の約3倍の頻度で発症します。[3]表在性ヘモジデローシスの報告症例数はMRI技術の進歩により増加していますが、依然として希少疾患です。
症状
表在性鉄沈着症は、脳損傷に起因する多くの症状を特徴とする:[4]
- 感音難聴- これは表在性鉄沈着症に伴う最も一般的な症状であり、全く聴こえないことは稀です。多くの場合、最初に最も高い音が聞こえなくなり、1年から12年かけて難聴が進行し、最終的には完全な難聴、あるいは低音以外の全ての聴力を失います。
- 運動失調- 歩行障害。2番目に多い症状です。
- 錐体路徴候- 錐体路の状態を示すさまざまな徴候。
- 認知症- 表面鉄沈着症患者の約 4 分の 1 に発生します。
- 膀胱の障害
- 無嗅覚症- 嗅覚の喪失。
- 瞳孔不同- 瞳孔の大きさが不均等な状態。[3]
原因
表在性鉄沈着症の最も一般的に説明される根本原因は、脳のくも膜下腔への慢性出血であり、これにより赤血球、つまり血液細胞が脳脊髄液中に放出される。慢性出血は、動静脈奇形または海綿状血管奇形、脊髄の粘液乳頭状上衣腫、慢性硬膜下血腫、脳室シャント、脊髄脳脊髄液漏出[5]、または慢性くも膜下出血など、多くの原因から発生する可能性がある。慢性出血源は、過去の脳手術または中枢神経系外傷の結果である可能性があり、これが表在性鉄沈着症の最も一般的な原因である可能性があり、表在性鉄沈着症は何年も経ってから現れる。[6]報告された症例の最大半数では、出血源が発見されなかった。[6]
病理学
血液細胞は脳脊髄液中に本来は存在しないため、そこに存在すると問題となる。血液細胞は最終的に分解されると、ヘムを含むタンパク質であるヘモグロビンを放出する。ヘモグロビンは分解され、鉄を含むヘムを脳脊髄液中に放出する。このヘムレベルの上昇に反応して、ベルクマングリアとミクログリアはヘムオキシゲナーゼ1を生成する。ヘムオキシゲナーゼ1は遊離ヘムをビリベルジン、一酸化炭素、鉄に分解する。このヘムの分解こそが、最終的に表在性鉄沈着を引き起こす鉄沈着の原因となる。 [ 7]過剰な遊離鉄は脳脊髄液中を循環して神経組織に沈着し、そこで活性酸素種の生成を触媒する。活性酸素種はDNA、脂質、タンパク質に損傷を与え、細胞にとって毒性がある。[8]
鉄沈着は鉄欠乏性脳組織に多く見られ、鉄濃度は正常値の1.79~8.26倍に達する。鉄貯蔵タンパク質であるフェリチンは、過剰なヘムに反応してグリア細胞によって鉄を隔離するために過剰産生され、その産生量は正常値の20.1~27.4倍に達する。過剰な鉄、フェリチン、および赤血球は、脳脊髄液のキサントクロミーを引き起こす可能性がある。神経細胞の種類の中で、鉄沈着はオリゴデンドログリア細胞に優先的に見られるようで、これはオリゴデンドログリア細胞が中枢神経系において鉄のシンクとして機能するという考えによって裏付けられている。シュワン細胞もまた、しばしば損傷を受け、脱髄に寄与する。[7]
鉄沈着は、下側頭葉、脳幹、小脳、脳室周囲構造、脊髄、および第VIII脳神経に最も多く見られます。鉄沈着は第I脳神経および第II脳神経にも見られますが、この障害は第VIII脳神経に比べて症状を呈する頻度は低く[3] 、これは第VIII脳神経に鉄沈着の影響を特に受けやすいグリア細胞が顕著に存在することで説明できます[9] 。
罹患した神経組織には「泡状体」、「球状体」、「細胞様体」の存在が指摘されているが、それが何であるか、またその起源は依然として不明瞭である。これらは軸索小体が腫大したものであると考えられているが、アストロサイト起源である可能性を示唆する証拠もいくつか存在する。[10]
診断
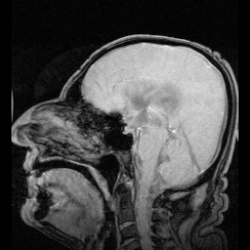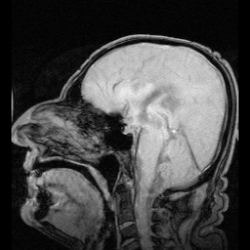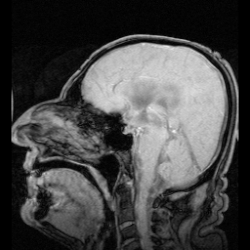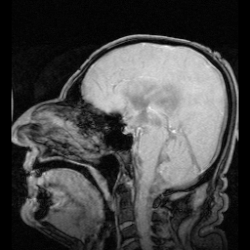
表在性鉄沈着症の早期発見は通常MRIで行われる。表在性鉄沈着症の特徴である鉄沈着は、罹患組織に低信号帯として現れ、小脳には特徴的な信号縁が現れる。高信号縁が見られることは稀である。[9]脳脊髄液のサンプルを採取すると、キサントクロミー、赤血球数の増加、鉄およびフェリチン濃度の上昇、タウ、アミロイドβ(Aβ42)、神経フィラメント軽鎖(NFL)、グリア線維性酸性タンパク質(GFAP)の濃度上昇によって鉄沈着症が明らかになることもあるが、脳脊髄液は正常なこともある。[11]表在性鉄沈着症はまれな疾患であり、神経学の教科書にも十分に記載されていないため、顕著な症状が現れるまで気付かれない可能性があり、そのため検出は複雑である。[12]
処理
表在性鉄沈着症を完治させる治療法は今のところなく、現在の症状を緩和し、さらなる症状の発症を防ぐ治療のみが有効である。出血源が特定できれば(発見されないこともよくある)、出血源の外科的治療が可能である。この方法は、場合によってはさらなる症状の発症を止める効果があることが証明されているが、すでに現れている症状には効果がない。[9]表在性鉄沈着症の患者は、脂溶性鉄キレート剤であるデフェリプロン(商品名フェリプロックス) による治療がよく行われる。この薬は中枢神経系で鉄をキレートすることが実証されているからである。[13]デフェリプロンの使用は重度の好中球減少症 を伴うが、このリスクおよび関連する合併症は通常、絶対好中球数を測定する週1回の血液検査を実施することで最小限に抑えられる。[14]
最も一般的な症状である難聴の緩和は、人工内耳の使用によって様々な成功を収めてきました。ほとんどの人はインプラント手術後も大きな改善に気づきませんが、これは蝸牛自体ではなく、前庭蝸牛神経(脳神経VIII)の損傷によるものと考えられます。[15]中には、ほぼ正常な聴力に戻るなど、はるかに良好な結果が得られる人もいますが、現時点ではこの治療に対する反応がどれほど良好であるかを判断することは困難です。[16]
2025年の症例報告では、表面鉄沈着症の患者の難治性パニック発作とうつ病に対する電気けいれん療法(ECT)の成功例が報告されており、8回の前頭葉治療後に顕著な改善がみられました。[17]
参考文献
- ^ Hamill, RC (1908) 脳、脊髄、髄膜の黒色症の症例報告. J. Nerv. Ment. Dis. , 35, 594.
- ^ Scheid R, Frisch S, Schroeter ML (2009年10月). 「中枢神経系の浅部鉄沈着症 - ステロイドによる治療?」Journal of Clinical Pharmacy and Therapeutics . 34 (5): 603–5 . doi : 10.1111/j.1365-2710.2009.01030.x . PMID 19753681.
- ^ abc Fearnley JM, Stevens JM, Rudge P (1995年8月). 「中枢神経系の表在性鉄沈着症」. Brain . 118 (Pt 4) (4): 1051–66 . doi :10.1093/brain/118.4.1051. PMID 7655881.
- ^ 山脇 剛志, 桜井 功 (2013年7月). 「表在性鉄沈着症の診断と治療」.脳神経. 65 (7): 843–55 . PMID 23832987.
- ^ Schievink, Wouter I.; Maya, Marcel; Moser, Franklin; Nuño, Miriam (2021-11-09). 「SIHにおける持続性腹側脊髄液漏の長期リスク」. Neurology . 97 (19): e1964 – e1970 . doi :10.1212/WNL.0000000000012786.
- ^ ab McCarron MO, Flynn PA, Owens C, Wallace I, Mirakhur M, Gibson JM, Patterson VH (2003年9月). 「脳神経外科手術後数年経過した中枢神経系の表在性鉄沈着症」Journal of Neurology, Neurosurgery, and Psychiatry . 74 (9): 1326–8 . doi :10.1136/jnnp.74.9.1326. PMC 1738683. PMID 12933948 .
- ^ ab Koeppen AH, Michael SC, Li D, Chen Z, Cusack MJ, Gibson WM, Petrocine SV, Qian J (2008年10月). 「中枢神経系の表在性鉄沈着症の病理」. Acta Neuropathologica . 116 (4): 371–82 . doi :10.1007/s00401-008-0421-z. PMID 18696091. S2CID 31359242.
- ^ Andersen HH, Johnsen KB, Moos T (2014年5月). 「慢性炎症を起こした中枢神経系における鉄沈着と神経変性への寄与」. Cellular and Molecular Life Sciences . 71 (9): 1607–22 . doi :10.1007/s00018-013-1509-8. PMC 3983878. PMID 24218010 .
- ^ abc Kumar N (2007年4月). 「表在性鉄沈着症:関連性と治療への影響」Archives of Neurology . 64 (4): 491–6 . doi : 10.1001/archneur.64.4.491 . PMID 17420310.
- ^ Kellermier H, Wang G, Wiley C (2009年4月). 「中枢神経系の表層鉄沈着症における鉄の局在」. Neuropathology . 29 (2): 187–95 . doi :10.1111/j.1440-1789.2008.00943.x. PMC 2667447. PMID 18694445 .
- ^ Kondziella D, Zetterberg H (2008年10月). 「中枢 神経系表在性鉄沈着症におけるタウタンパク質の過リン酸化」. Journal of the Neurological Sciences . 273 ( 1– 2): 130– 2. doi :10.1016/j.jns.2008.06.009. PMID 18617192. S2CID 1944944.
- ^ Simeoni S, Puccetti A, Tinazzi E, Tomelleri G, Corrocher R, Lunardi C (2008年6月). 「全身性硬化症と中枢神経系の表在性鉄沈着症:偶発性か因果関係か?」. Rheumatology International . 28 (8): 815–8 . doi :10.1007/s00296-008-0523-x. PMID 18193230. S2CID 20693384.
- ^ Levy M (2019年8月26日). 「表在性鉄沈着症の治療におけるデフェリプロン(フェリプロックス®)の観察研究」
- ^ トリクタ F、ユトレヒト J、ガラネロ R、コネリー J、ロゾバ A、スピノ M、パームブラッド J (2016 年 10 月)。 「デフェリプロン誘発性無顆粒球症: 20 年間の臨床観察」。アメリカ血液学雑誌。91 (10): 1026–31 .土井:10.1002/ajh.24479。PMC 5129477。PMID 27415835。
- ^ Sydlowski SA, Cevette MJ, Shallop J, Barrs DM (2009年6月). 「人工内耳患者における表在性鉄沈着症」. Journal of the American Academy of Audiology . 20 (6): 348–52 . doi :10.3766/jaaa.20.6.3. PMID 19594083.
- ^ Hathaway B, Hirsch B, Branstetter B (2006). 「表在性鉄沈着症患者における人工内耳移植の成功」. American Journal of Otolaryngology . 27 (4): 255–8 . doi :10.1016/j.amjoto.2005.09.020. PMID 16798402.
- ^ Pierpoint G, Saini K (2025年10月23日). 「浅部鉄沈着症における難治性不安および抑うつに対する電気けいれん療法:症例報告」. Clinical Neuropharmacology . doi :10.1097/WNF.0000000000000660. PMID 41236390.