チオ硫酸塩
 | |
 | |
| 名称 | |
|---|---|
| IUPAC名 | |
| 識別番号 | |
| |
3Dモデル(JSmol) | |
| ChEBI | |
| ケムスパイダー | |
パブリックケムCID | |
| UNII |
|
コンプトックスダッシュボード(EPA) | |
| |
| |
| 性質 | |
| S 2 O2−3 | |
| モル質量 | 112.12 g·mol −1 |
| 共役酸 | チオ硫酸 |
| 関連化合物 | |
関連化合物 | |
特に記載がない限り、データは標準状態(25 °C [77 °F]、100 kPa)における材料のものです。 | |
チオ硫酸塩(IUPAC推奨の綴り。イギリス英語ではthiosulphateと呼ばれることもある)は、化学式S2Oの硫黄のオキシアニオンです2−3チオ硫酸塩は、この陰イオンを含む化合物、すなわちチオ硫酸の塩、例えばチオ硫酸ナトリウム(Na 2 S 2 O 3)やチオ硫酸アンモニウム((NH 4 ) 2 S 2 O 3)を指すこともあります。チオ硫酸塩は天然に存在します。チオ硫酸塩は水の塩素を急速に除去するため、製紙業界では漂白を止めるために使用されます。チオ硫酸塩は主に繊維の染色や天然物質の漂白に使用されます。[ 2 ]
構造と結合
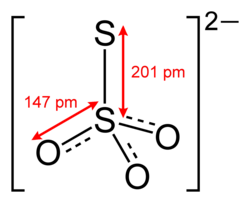
チオ硫酸イオンは中心の硫黄原子で四面体構造をとります。チオ硫酸イオンはC 3v対称性を持ちます。外側の硫黄原子の価数は2、中心の硫黄原子の価数は6です。酸素原子の価数は2です。SS距離は約チオ硫酸ナトリウムの201pmは単結合に適切です。SO距離は硫酸塩のSO距離 よりもわずかに短くなります。
長年にわたり、チオ硫酸イオン中の硫黄原子の酸化状態は、中心原子が硫酸イオンと同様に+6 、末端原子が硫化物イオンと同様に-2であると考えられてきた。この見解では、どちらのS原子の酸化状態も変化しないため、堆積物中の嫌気性条件下で細菌にエネルギーを供給する酸化還元機構として、チオ硫酸イオンから硫酸イオンと硫化物への不均化反応は考えられなかった。しかし、 X線吸収端近傍構造(XANES)分光測定により、硫黄原子の電荷密度は、中心S原子と末端S原子の酸化状態がそれぞれ+5と-1であることが明らかになった。この観察結果は、微生物発酵からエネルギーを解放する酸化還元機構として、チオ硫酸イオンから硫酸イオンと硫化物への不均化反応が考えられたことと一致する。[ 3 ]
生成
チオ硫酸イオンは、亜硫酸イオンと元素硫黄の反応、および硫化物の不完全酸化(例:黄鉄鉱の酸化)によって生成されます。 チオ硫酸ナトリウムは、水酸化ナトリウムに溶解した硫黄の不均化によって生成されます
反応


チオ硫酸イオンは酸と反応して二酸化硫黄と様々な硫黄環を生成する。[ 4 ]
- 8 S 2 O2−3+ 16 H + → 8 SO 2 + S 8 + 8 H 2 O
この反応は硫黄コロイドを生成し、光のレイリー散乱を実証するために使用できます。白色光を下から照射すると、横から青い光、上からオレンジ色の光が見えます。これは、正午と夕暮れの空が色づくのと同じメカニズムによるものです。
チオ硫酸イオンはヨウ素と反応してテトラチオ酸イオンを生成します。
- 2 S 2 O2−3+ I 2 → S 4 O2−6+ 2 I −
この反応はヨウ素滴定の鍵となります。臭素(X = Br)と塩素(X = Cl)により、チオ硫酸イオンは硫酸イオンに酸化されます
- S 2 O2−3+ 4 × 2 + 5 H 2 O → 2 SO2−4+ 8 X − + 10 H +
金属および金属イオンとの反応
チオ硫酸イオンは遷移金属と広範囲にわたり多様な錯体を形成します。
チオ硫酸イオンは金属との親和性を反映し、酸性条件下では金属を急速に腐食します。鉄鋼とステンレス鋼は、チオ硫酸イオンによって引き起こされる孔食に対して特に敏感です。モリブデンはステンレス鋼の孔食に対する耐性を向上させます。アルカリ性水溶液環境および中温(60℃(140°F))では、炭素鋼とステンレス鋼は、高濃度の塩基(30%/w水酸化カリウム)、チオ硫酸イオン(10%/w)およびフッ化物イオン(5%/wフッ化カリウム)。
フィルム写真では、チオ硫酸塩が定着剤として大量に使用されています。これは、チオ硫酸イオンが銀と錯体を形成する能力を利用しているからです。チオ硫酸ナトリウム(通称ハイポサルファイト)は、写真において現像後の白黒ネガやプリントの定着に広く使用されていました。現代の「迅速」定着液では、定着速度が3~4倍速いため、チオ硫酸アンモニウムが定着塩として使用されています。[ 5 ]
チオ硫酸塩は、シアン化物イオンよりも毒性の低い代替物として、金や銀を鉱石から抽出または浸出するために使用されてきた。[ 2 ]
他の塩との反応
無機亜硝酸塩はチオ硫酸塩と加熱すると激しく爆発する。この組み合わせは、救急医療においてシアン化物解毒剤キットとして使用されているが、それぞれ別々の薬剤として使用されている。[ 6 ] [ 7 ]
生化学
ロダナーゼ(チオ硫酸硫黄転移酵素)酵素は、チオ硫酸イオンをチオシアン酸イオンと亜硫酸イオン に変換することで、シアン化物イオンの解毒を触媒します
- CN − + S 2 O2−3 → SCN − + SO2−3
チオ硫酸ナトリウムは、亜硝酸アミルおよび亜硝酸ナトリウム、およびヒドロキソコバラミンと組み合わせて使用されます。複合体IVにおける細胞呼吸の阻害によって引き起こされる急速な細胞内低酸素症を回復させるには、救急隊員による即時投与が必要であるため、病院前環境で最も効果的です。[ 7 ] [ 8 ]
ミトコンドリア内のチオ硫酸硫黄転移酵素(TST )を活性化します。TSTは肥満や2型(インスリン抵抗性)糖尿病の予防に関与しています。[ 9 ] [ 10 ]
チオ硫酸塩は、 Chlorobium limicola forma thiosulfatophilumのような硫黄を酸化する細菌の増殖において、電子供与体として働く。これらの細菌は、チオ硫酸塩(および他の供給源)からの電子と二酸化炭素からの炭素を用いて、逆クレブス回路を通じて炭素化合物を合成する。[ 11 ]
一部の細菌はチオ硫酸塩を代謝することができる。[ 12 ]
鉱物
チオ硫酸イオンは、非常に希少な鉱物であるシドピエテルサイトPb4 (S2O3 ) O2 ( OH) 2の成分です。[ 13 ]
命名法
チオ硫酸塩は許容される一般名であり、ほぼ常に使用されています。
機能的置換IUPAC名はスルフロチオエートです。系統的添加IUPAC名はトリオキシドスルフィド硫酸塩(2-)またはトリオキシド-1κ3O-二硫酸塩( S - S )(2-)です。[ 1 ]
チオ硫酸塩は、チオ硫酸のエステル(例: O , S-ジメチルチオ硫酸塩CH 3 −O−S(=O) 2 −S−CH 3 )も指します。このような種は稀です。
参考文献
- ^ a b国際純正応用化学連合(2005).無機化学命名法(IUPAC勧告2005年). ケンブリッジ(英国):RSC – IUPAC . ISBN 0-85404-438-8139,329ページ。電子版。
- ^ a b Barberá, JJ; Metzger, A.; Wolf, M. 「亜硫酸塩、チオ硫酸塩、および亜ジチオン酸塩」。Ullmann 's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi : 10.1002/14356007.a25_477 . ISBN 978-3-527-30673-2。
- ^ Vairavamurthy, A.; Manowitz, B.; Luther, GW; Jeon, Y. (1993). 「チオ硫酸塩中の硫黄の酸化状態と嫌気性エネルギー代謝への影響」. Geochimica et Cosmochimica Acta . 57 (7). Elsevier BV: 1619– 1623. Bibcode : 1993GeCoA..57.1619V . doi : 10.1016/0016-7037(93)90020-w . ISSN 0016-7037 .
- ^ Steudel, Ralf (1982). 「同素環式硫黄分子」.無機環系. Topics in Current Chemistry. Vol. 102. pp. 149– 176. doi : 10.1007/3-540-11345-2_10 . ISBN 978-3-540-11345-4。
- ^ Sowerby, ALM編 (1961). 『写真辞典:アマチュアとプロの写真家のための参考書』(第19版). ロンドン: Illife Books Ltd
- ^ Kaye, Seymour M. (1978年1月1日). 「N-亜硝酸塩」.爆発物及び関連物品百科事典(PDF) (技術報告書). 第8巻, ピルボニトロリック酸によるM1増粘剤. ニュージャージー州ドーバー: 陸軍兵器研究開発センター - 大口径兵器システム研究所. p. N107. LCCN 61-61759 . ADA057762, PATR 2700.
- ^ a b Hamel, J. (2011). 「急性シアン化物中毒のレビューと治療の最新情報」(PDF) . Critical Care Nurse . 31 (1): 72– 81, quiz 82. doi : 10.4037/ccn2011799 . PMID 21285466. 2014年8月18日閲覧.
- ^ Miles, Bryant (2003年2月24日). 「阻害剤と脱共役剤」(PDF) .テキサスA&M大学. 2016年3月4日時点のオリジナル(PDF)からアーカイブ。 2015年11月25日閲覧。
- ^ Stylianou, IM (2005). 「Fob3b肥満QTLのマイクロアレイ遺伝子発現解析により、位置候補遺伝子Sqleが同定され、コレステロールおよび解糖経路が変動した」.生理学的ゲノミクス. 20 (3): 224– 232. CiteSeerX 10.1.1.520.5898 . doi : 10.1152/physiolgenomics.00183.2004 . PMID 15598878 .
- ^ Morton, NM; Beltram, J.; Carter, RN (2016). 「痩せ型マウスにおける脂肪細胞発現抗糖尿病標的としてのチオ硫酸硫黄転移酵素の遺伝学的同定」 Nature Medicine . 22 (7): 771– 779. doi : 10.1038 / nm.4115 . PMC 5524189. PMID 27270587 .
- ^ Buchanan, Bob B.; Arnon, Daniel I. (1990-04-01). 「光合成における逆クレブス回路:ついに合意」.光合成研究. 24 ( 1): 47– 53. Bibcode : 1990PhoRe..24...47B . doi : 10.1007/BF00032643 . ISSN 1573-5079 . PMID 24419764. S2CID 2753977 .
- ^ Hogan, CM; Nodvin, SC (2011年5月10日) [2007年3月25日]. Cleveland, CJ; Jorgensen, A. (編). 「硫黄」 . The Encyclopedia of Earth . ワシントンD.C.: Environmental Information Coalition - National Council for Science and the Environment. 2011年9月9日時点のオリジナルよりアーカイブ。 2025年11月29日閲覧。
- ^ Roberts, AC; Cooper, MA; Hawthorne, FC; Stanley, CJ; Key, CL; Jambor, JL (1999). 「シドピエテルサイト, Pb 4 (S 6+ O 3 S 2- )O 2 (OH) 2 , ナミビア・ツメ産のチオ硫酸塩含有新鉱物種」. The Canadian Mineralogist . 37 : 1269-1273.
